ZIF-8@纤维素酶-细胞共固定化体系的构建及强化丁酸合成的应用
王雨薇, 尹成泰, 刘婷婷, 江 凌*,3
(1.南京工业大学 食品与轻工学院,江苏 南京 211816;2.南京工业大学 海外教育学院,江苏 南京 211816;3.南京工业大学 材料化学工程国家重点实验室,江苏 南京 211816)
固定化酶技术是将酶用人工方法固定在特定载体上,进行催化生产,具有稳定性好、易于纯化和可连续化反应等优点[1]。该技术是生物催化的核心技术,其较高的重复可利用率减少了多余的下游后续处理和纯化过程[2],提高了生物催化过程的经济性,已成为酶工程研究的重要方向。
目前,利用金属-有机骨架 (metal-organic frameworks,MOFs)作为酶固定化的载体材料[3]受到越来越多的关注,MOFs作为一种具有周期性骨架结构的新型多孔材料,拥有较好的生物兼容性、易于调节的孔径、巨大的比表面积、易于修饰的金属结构和配体,以及温和的合成条件[4],这些都为其作为固定化载体材料提供了有力的支持[5]。沸石咪唑酯骨架(zinc zeolitic imidazolate frameworks,ZIFs)作为一种重要的MOFs材料也兼具以上特点。研究证明,将酶嵌入MOFs(ZIFs)中构建固定化酶体系为改善酶固有的脆弱性提供了新的可能,同时也为MOFs赋予了新的生物功能[6-7]。目前已有一些利用MOFs固定细胞方面的报道,Liang等设计了一种具有生物活性的多孔合成壳,用β-半乳糖苷酶包裹酵母,来提高其在贫瘠营养环境中的存活率[8]。Ji等将Morella theracetica细胞包裹在均质MOFs单层中,以实现对氧化应激的保护[9]。
丁酸(CH3CH2CH2COOH)作为一种重要的四碳短链有机酸,被广泛应用于食品[10-11]、医药[12-14]、农业[15]、动物饲料[16]等领域。例如在食品工业中,丁酸能够增强食品中的奶油风味,其酯类因具有水果香气,可作为添加剂用于糖果、饮料、冰淇淋等食品中。酪丁酸梭菌(Clostridium tyrobutyricum,Ct)是国内外研究聚焦最多的产丁酸菌株,因其丁酸产量大、得率高、稳定性好,被认为是生物法制备丁酸的最优势菌株[17-18]。但在实际生产过程中,酪丁酸梭菌对小麦秸秆、软木[19]和玉米芯[20]等廉价的生物质原料无法直接利用,且由于环境复杂性导致的胁迫因素的存在,会影响丁酸产量的进一步提升。
作者基于仿生矿化法原位合成ZIF-8纳米材料,分隔包覆纤维素酶和酪丁酸梭菌,构建ZIF-8@纤维素酶-Clostridium tyrobutyricum(ZIF-8@纤维素酶-Ct)共固定化体系。其中,利用ZIF-8@固定纤维素酶用于水解玉米芯制备可发酵性糖,进一步将固定纤维素酶的ZIF-8作为保护性外骨骼结晶于细胞表面,形成包覆层以增强细胞稳定性,增强Ct抗胁迫性能的同时,提高Ct细胞原料利用率,从而开发廉价生物质资源的同步酶解发酵合成丁酸的新工艺路线。
1 材料与方法
1.1 材料与试剂
酪丁酸梭菌Clostridium tyrobutyricum ATCC 25755于作者所在实验室-80℃低温冻藏柜中保藏。
强化梭菌培养基 (reinforced clostridium medium,RCM):1 L体系中含有10 g胰蛋白胨、10 g牛肉浸粉、3 g酵母粉、5 g葡萄糖、1 g可溶性淀粉、5 g氯化钠、3 g无水乙酸钠、0.5 g L-半胱氨酸盐酸盐;pH 6.8±0.2;固体培养基需再加入15 g琼脂。
发酵中用的RCM(G-)培养基为不添加葡萄糖的RCM培养基。
所用的纤维素酶为Cellic®CTec2诺维信纤维素酶,购于诺维信(中国)生物技术有限公司。在Cellic®CTec2中,纤维素酶提供了关键酶活性,水解纤维素中的(1,4)-β-D-葡萄糖苷键和其他β-D-葡聚糖。其质量浓度近似值为1.15 g/mL。
1.2 酪丁酸梭菌菌种活化及扩大培养
取出保藏的菌种划线于RCM琼脂平板表面生长,挑取单菌落,接种于RCM培养基中,于37℃恒温培养箱中静置过夜培养12~16 h。
1.3 Ct菌泥制备
取2 mL菌液离心(12 000 r/min、4℃、2 min),加去离子水洗涤2~3次,得到菌泥,使用冷冻干燥机对菌泥进行冻干处理为后续FT-IR、XRD、UVVis表征使用。
在菌泥中加入体积分数2.5%戊二醛(1 mL)固定,充分混匀,过夜固定后离心(12 000 r/min、4℃、2 min),倒去上清液,依次加入不同体积分数的乙醇(10%、30%、50%、70%、100%)洗脱,开盖过夜晾干,用于后续SEM表征使用。
1.4 ZIF-8@纤维素酶-Ct共固定化体系的合成与制备
将Ct菌液离心(10 000 r/min、4℃、3 min),加
去离子水洗涤2~3次,再依次加入去离子水(30 mL)、0.5 mol/L硝酸锌溶液(200 μL)、1 mol/L 2-甲基咪唑(1 mL),充分混匀,置于37℃摇床过夜培养
6~8 h。再取20 mg包覆ZIF-8的Ct细胞与10 mL
纤维素酶溶液(50 mmol/L乙酸缓冲液、pH 4.8)混合,在30℃、180 r/min振荡50 min后离心(10 000 r/min、4℃、3 min),加去离子水洗涤2次冲洗掉多余材料。利用1.3中的方法得到ZIF-8@纤维素酶-Ct菌泥,戊二醛处理以备后续表征使用。
1.5 结构表征
1.5.1 SEM形态表征使用Sigma HD扫描电镜观察Ct和ZIF-8@纤维素酶-Ct的形貌和结构。
1.5.2 傅里叶变化红外光谱(FT-IR)分析使用Nicolet IS 10傅里叶变换红外光谱仪测定包覆着菌的ZIF-8@纤维素酶-Ct样品和纯ZIF-8样品的红外光谱。将这两种不同样品分别与固体KBr粉末混合,利用研钵研磨细碎同时注意干燥处理,取适量混合物粉末,均匀浅铺一层在压片模具中,在一定压力下制成薄片,进行FT-IR分光光度测定。在500~4 000 cm-1的波数下记录透射率。
1.5.3 X射线粉末衍射(XRD)测定使用X’Pert PRO MPD X射线粉末衍射仪分析ZIF-8和ZIF-8@纤维素酶-Ct样品的结晶形态及结晶度。样品烘干利用研钵研磨细碎后加入到玻璃样品架的凹槽中间,利用X射线粉末衍射仪在0~90°(测量角度2θ)扫描范围内测定。
1.6 分析方法
1.6.1 比生长率测定使用全波长酶标仪测定在600 nm处的不同pH条件下Ct和ZIF-8@纤维素酶-Ct菌液的OD值,再除以相应的生长时间得到比生长率。从10 mL样品管中各取100 μL样品置于96孔酶标板中,通过全波长酶标仪测定。
1.6.2 细胞活力测定使用二乙酸荧光素(FDA)检测不同pH条件下Ct和ZIF-8@纤维素酶-Ct菌液的细胞活力,该试剂可以代谢活跃的细胞被水解成明亮的荧光素。从10 mL样品管中各取100 μL置于96孔酶标板中,再在每孔加入2 μL的FDA母液(5 mg FDA粉末溶于1 mL丙酮),置于30℃恒温培养箱内孵育20 min。使用全波长酶标仪分别在490 nm激发波长、526 nm发射波长下,实时检测两个样品的吸光度。相对细胞活力是以同实验组的最高的吸光度为100%进行标化,得到各个条件下的相对细胞活力。
1.6.3 相对活性氧(ROS)水平测定使用荧光探针2’,7’-二氯荧光素二乙酸酯(DCFH-DA)对不同pH条件下Ct和ZIF-8@纤维素酶-Ct进行活性氧检测。DCFH-DA本身没有荧光,可以自由地穿过细胞膜,进入细胞内,可被细胞内的酯酶水解生成DCFH。细胞内的活性氧可以通过氧化无荧光的DCFH生成有荧光的DCF(2’,7’-二氯荧光素),检测DCF的荧光从而得到细胞内活性氧的水平[21-22]。用N,N-二甲基甲酰胺(DMF)稀释得到DCFH-DA(10 μmol/L),取1 mL菌液和1 μL DCFH-DA于2 mL棕色离心管,置于37℃恒温培养箱内孵育20 min,每隔3~5 min颠倒混匀一下,使探针和菌液充分接触。用去离子水洗涤2~3次,以充分除去未进入细胞内的DCFH-DA。使用全波长酶标仪在488 nm激发波长、525 nm发射波长下,实时检测刺激前后荧光的强弱。
1.6.4 纤维素酶酶活力测定纤维素酶酶活力的测定采用DNS法,首先根据试剂盒配制标准葡萄糖溶液制作标准曲线,用于计算水解出的葡萄糖。接着加入l00 μL质量浓度为1 g/L的待测液和900 μL DNS显色液,摇匀后放入100℃沸水浴中,10 min后立即取出,流水冷却至室温,稀释相应倍数后于540 nm处测OD值,再从标准曲线中查出对应的葡萄糖的物质的量。酶活力定义为在50℃、pH 7.0条件下,每分钟催化纤维素水解成1 μmol的葡萄糖称为1 U。
1.7 玉米芯水解物的预处理制备
玉米芯的水解液按文献报道的方法制备[23]。首先,使用研磨机将玉米芯研磨成直径小于5 mm的生物质细粉,用0.02 mol/L H2SO4进行预处理,固液质量体积比为10 g∶100 mL,在121℃下处理30 min。将商品化的纤维素酶Cellic®CTec2按照2%(体积分数)的比例加入到pH为5.5的稀酸水解液中,在50℃、180 r/min的条件下水解3 d。用多层纱布过滤出不溶性固体残留物,剩余溶液用旋转蒸发仪浓缩至总糖质量浓度为60 g/L。
将获得的玉米芯悬浮液,用1 mol/L NaOH调节pH至4.5。此外,在丁酸发酵的对照组中,在预处理后的玉米芯中添加2%(体积分数)的游离商品纤维素酶,在50℃、180 r/min的条件下水解纤维素为葡萄糖。
1.8 同步糖化发酵法(simultaneous saccharification and fermentation,SSF)生产丁酸
以玉米芯酶解释放的葡萄糖为碳源,对丁酸进行分批发酵。厌氧瓶中培养6~8 h的细胞悬浮液接种于预处理的稻草悬浮液中进行SSF(40℃、pH 4.5),并同时补充RCM(G-)培养基。
2 结果与讨论
2.1 ZIF-8@纤维素酶-Ct细胞的表征分析
2.1.1 SEM分析Ct和ZIF-8@纤维素酶-Ct的SEM分析结果如图1所示。从图1(a)中可以看出,没有ZIF-8包覆的细胞表面较为光滑,而图1(b)中显示,基于仿生矿化的方法成功使硝酸锌和2-甲基咪唑水溶液合成了ZIF-8,并包覆在了Ct的表面,且颗粒分布均匀。

图1 Ct和ZIF-8@纤维素酶-Ct的SEM图Fig.1 SEM images of Ct and ZIF-8@cellulase-Ct
2.1.2 FT-IR分析采用FT-IR对ZIF-8和ZIF-8@纤维素酶-Ct进行了分析,结果如图2所示。单一 的ZIF-8在2 925.62 cm-1和3 137.05 cm-1处 的吸收峰分别归属于其组分2-甲基咪唑上的不对称脂肪族和芳香族的C—H键的伸缩振动。ZIF-8@纤维素酶-Ct与ZIF-8相比除了具有上述位置附近的吸收峰,还在1 241 cm-1处有C=O伸缩振动吸收峰,表明存在蛋白质[24],主要归因于添加的纤维素酶;在1 078 cm-1处有醚键伸缩振动吸收峰,这些可归因于Ct。总而言之,这些结果证实了ZIF-8、纤维素酶和Ct成功耦合在一起,且所有峰的位置均未发生明显变化,即ZIF-8的结构在包覆的过程中也没有被破坏。

图2 ZIF-8和ZIF-8@纤维素酶-Ct的FT-IR图Fig.2 FT-IR spectra of ZIF-8 and ZIF-8@cellulase-Ct
2.1.3 XRD分析对单一的ZIF-8和ZIF-8@纤维素酶-Ct进行了XRD分析,结果如图3所示。对于纯的ZIF-8而言,在2θ为7.02°、10.39°、12.70°、18.14°处有4个明显的衍射峰,分别归因(011)、(002)、(112)和(222)空间群[24],在XRD图谱中的对应位置也可以找到响应的特征峰。ZIF-8@纤维素酶-Ct在相同的散射角下表现出的峰位与纯ZIF-8基本一致,表明通过纤维素酶固定化后ZIF-8纳米粒子的物化性质不变。

图3 ZIF-8和ZIF-8@纤维素酶-Ct的XRD图Fig.3 XRD spectra of ZIF-8 and ZIF-8@cellulase-Ct
2.2 共固定化体系的酶解性能研究
2.2.1 ZIF-8-SSF最佳酶解条件的确定为了最大限度提高酶活性,对酶解的两个重要参数pH和温度进行优化。但最佳酶解条件的确定,还需要在被包覆的Ct细胞的存活率和固定化纤维素酶的酶活力之间折中。一般来说,纤维素酶在二氧化硅[25]、(聚)离子液体[26]和磁性纳米粒子[27]等不同载体上的固定化有利于提高其相对活性和稳定性。MOFs也被证明是一种很好的固定化载体[28]。就酶活力而言,两种情况下游离纤维素酶和固定化纤维素酶的最适温度均为50℃(见表1)。在较低温度(30~40℃)下,游离纤维素酶的活力略高于固定化纤维素酶。当温度超过最适温度时,游离纤维素酶的活力急剧下降,在80℃时损失81.06%,与之前的报道一致[29]。ZIF-8固定化纤维素酶具有较高的热稳定性,在80℃下仍能保持约50%的残余酶活力。这种稳定性的提高可能和酶与载体的多点连接从而限制了构象的流动性和灵活性有关[29]。除相同的最适温度外,游离纤维素酶和固定化纤维素酶的最适pH也均为4.5(见表1)。与游离纤维素酶相比,固定化纤维素酶在较宽的pH范围内(4.0~7.0)表现出相对较高的活性。在pH为7.0时,游离纤维素酶的活力仅为最适条件的36.23%,而固定化纤维素酶的活力仍能保持59.72%。固定化纤维素酶的pH耐受性增强可能是由于其对不利环境引起的构象变化的敏感性减弱所致。

表1 不同温度和pH下游离纤维素酶和固定化纤维素酶的相对活性Table 1 Relative activity of free cellulase and immobilized cellulase under different temperature and pH
研究了不同pH和温度条件下无包覆的和被包覆的Ct细胞的活力。如表2所示,无包覆的Ct细胞对温度变化非常敏感,在50℃时只有11.73%的细胞活力,在60℃时死亡率为100%。相比之下,ZIF-8外骨骼赋予细胞更高的高温耐力,并能够在50℃下保持超过50%的细胞存活率,这与最近的一项研究结果一致,即可以在微生物细胞上涂上MOFs以提高其在热应激下的生存能力[30]。无包覆的和被包覆的Ct细胞在40℃下都表现出最佳的存活率。从pH 4.0到7.0,细胞存活率增加(见表2)。当pH设置为4.5时,无包覆的Ct相较于被包覆的细胞存活率明显下降,仅有47.15%的荧光被检测到。而ZIF-8包覆的Ct保持了76.31%的活力,表明了ZIF-8在低pH条件下提供了耐酸潜力。然而,当pH从4.5到5.0时,被包覆的Ct细胞的存活率仅提高了约3%,而固定化纤维素酶的活力却有所下降(见表1)。在此基础上,确定pH为4.5,温度为40℃为SSF的最佳条件。

表2 不同温度和pH条件下无包覆的和被包覆的Ct的相对细胞活力Table 2 Relative cell viability of naked Ct and coated Ct under different tempreature and pH
2.2.2包覆的Ct对预处理的玉米芯的水解和转化为了评价游离纤维素酶和固定化纤维素酶的性质,研究了在pH 4.5时,在不同温度(30、40、50、60℃)下纤维素水解率和葡萄糖转化率。将预处理后的玉米芯悬浮液分为游离纤维素酶和无包覆的Ct组(对照组),以及ZIF-8@纤维素酶包覆的Ct组(处理组),预处理后的玉米芯经酶解后,纤维素转化为葡萄糖,在50℃时超过67%的预处理玉米芯被水解成葡萄糖(见表3)达到最大转化率。与固定化纤维素酶相比,游离纤维素酶表现出更高的纤维素水解率,这与Ingle等报道的结果基本一致[31]。与游离纤维素酶相比,在40℃下固定化纤维素酶的水解率仅略有下降,56.02%的纤维素被水解。同时,温度对无包覆的和被包覆的Ct细胞的葡萄糖转化率也有很大影响(见表3)。在40℃时,葡萄糖转化率最高,二者均可达85%以上,这与之前获得的最适温度(40℃)非常吻合。此外,无包覆的Ct细胞在高温下对葡萄糖转化能力显著降低,50℃时葡萄糖转化率仅为34.58%,60℃时仅为2.16%,表明固有敏感的Ct细胞对热应激敏感。

表3 不同温度下游离纤维素酶和无包覆的Ct组(对照组)、ZIF-8@纤维素酶包覆的Ct组(处理组)的纤维素水解率和葡萄糖转化率Table 3 Cellulose hydrolysis rates and glucose conversion percentages of free cellulase and naked Ct group(control group),ZIF-8@cellulase coated Ct group(treatment group)at different temperature
2.3 共固定化体系的发酵性能研究
2.3.1 耐酸性能研究pH对微生物的发酵过程有着重要的影响,通过改变发酵培养基的pH可以影响细胞内代谢过程中关键酶的活性[32],从而影响菌体的生长速率和产物合成。在Ct中,pH的高低不仅会影响丁酸和乙酸合成途径中的关键酶的活性,还可以影响到酶的表达水平[33]。因此在微生物发酵过程中,pH对菌体代谢具有重要影响,是判断ZIF-8保护作用的重要指标。
将置于37℃恒温培养箱,在不同pH条件(4.5、5.0、5.5、6.0、6.5、7.0)的RCM培养基中生长8 h的Ct和ZIF-8@纤维素酶-Ct取出,测定比生长率、相对细胞活力和相对活性氧(ROS)水平,结果如图4所示。在较低pH时,Ct的生长受到较大的抑制,pH为4.5时抑制效果最为明显。在pH 7.0的条件下,Ct和ZIF-8@纤维素酶-Ct的生长效果最好,可视为生长最适pH,且被包覆的Ct的细胞生长情况均优于无包覆的,其中,在pH 6.0时保护效果最为显著,相较于无包覆的菌株,ZIF-8@纤维素酶-Ct的比生长率提高了11.48%,相对活性氧水平则降低了24.92%,提高了Ct耐酸性。

图4 不同pH条件下Ct和ZIF-8@纤维素酶-Ct的比生长率、相对细胞活力及相对活性氧水平Fig.4 Specific growth rate,relative cell viability and relative reactive oxygen levels of Ct and ZIF-8@cellulase-Ct under different pH conditions
2.3.2 耐氧性能研究Ct作为专性厌氧菌,缺乏好氧菌所具有的超氧化物歧化酶和过氧化氢酶,所以在有氧的环境中会受到超氧根负离子和过氧化氢的毒害,因此只能进行严格的无氧代谢[34]。但是营造严苛的无氧条件较为困难,对于Ct,生长环境中存在氧气会对其正常生长产生一定的影响,因此提高其耐氧水平,对于其生产具有一定的辅助意义。
将置于37℃恒温培养箱,在不同氧气体积分数(0、10%、21%)的RCM培养基中生长10 h的Ct和ZIF-8@纤维素酶-Ct取出,测定比生长率、相对细胞活力和相对活性氧(ROS)水平,结果如图5所示。可以看出,在严格厌氧的条件下,即氧气体积分数为0时,Ct和ZIF-8@纤维素酶-Ct的生长效果最好,符合Ct专性厌氧的生长特性,同时在此氧气体积分数条件下可以看出有无包覆对于其生长指标的影响不是特别显著,在氧气体积分数为10%的条件下保护效果能够凸显,有ZIF-8和纤维素酶包覆的Ct的细胞生长情况仍然是总体优于无外骨骼包覆的,但在未除氧的培养基中的Ct和ZIF-8@纤维素酶-Ct生长情况均不佳,说明添加了包覆对细胞的保护作用也在一定的限度范围内。
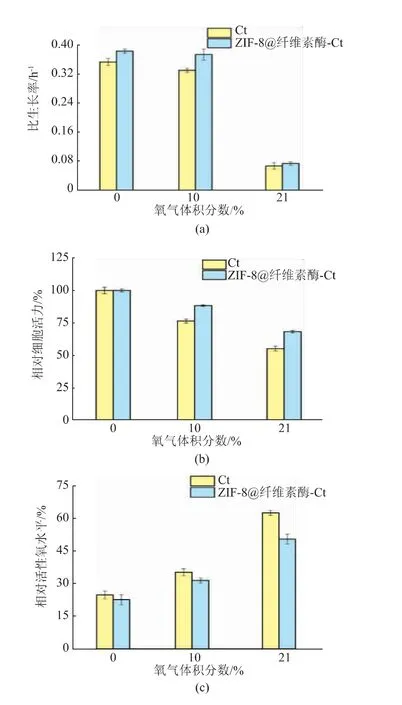
图5 不同氧气体积分数下Ct和ZIF-8@纤维素酶-Ct的比生长率、相对细胞活力及相对活性氧水平Fig.5 Specific growth rate,relative cell viability and relative reactive oxygen levels of Ct and ZIF-8@cellulase-Ct under different O2 volume ratio
2.4 ZIF-8@纤维素酶-Ct与Ct发酵产丁酸的对比研究
各种木质纤维素原料水解所得的葡萄糖浓度一般不能直接用于丁酸发酵。因此,水解液必须通过蒸发浓缩到所需的葡萄糖浓度[35]。这一耗时耗力的生产过程不利于丁酸工业化发酵的推进。作者提出了一种新的丁酸发酵工艺MOFs(ZIF-8)介导的同步糖化发酵法(ZIF-8-SSF),选择玉米芯作为模式基质。木质纤维素原料水解24 h后,加入营养充足的RCM(G-)培养基加速被释放的葡萄糖的利用。烦琐的蒸发浓缩步骤可以消除,但葡萄糖浓度的降低可能会导致丁酸终浓度的降低。但固定化纤维素酶的pH稳定性、热稳定性增强,表明ZIF-8-SSF工艺可能具有提高丁酸产量的潜力。如表4所示,由于预处理玉米芯释放的葡萄糖可以温和地维持细胞的生长和代谢,所以依然可以在没有RCM(G-)培养基的情况下产生少量的丁酸;加入RCM(G-)培养基后,葡萄糖开始大量消耗,32 h后几乎不再转化为丁酸,被纤维素酶和ZIF-8包覆的Ct细胞产生更多的丁酸,32 h最终质量浓度达到6.74 g/L,比无包覆Ct细胞高12.52%。

表4 血清瓶中游离纤维素酶和无包覆的Ct与ZIF-8-SSF的丁酸发酵情况Table 4 Butyric acid fermentation of free cellulase and naked Ct versus ZIF-8-SSF in serum bottles
3 结语
作者使用仿生矿化的方法将硝酸锌溶液和2-甲基咪唑溶液制备ZIF-8,再分隔包覆纤维素酶和Ct,获得ZIF-8@纤维素酶-Ct共固定化体系。采用SEM、FT-IR、XRD等方式进行表征分析,其中SEM结果显示,成功制备出ZIF-8颗粒,并均匀包覆在Ct细胞表面。FT-IR结果显示,ZIF-8@纤维素酶-Ct具有ZIF-8和Ct两者的吸收峰,且载体包覆细胞并没有改变载体的结构。XRD结果显示,ZIF-8和纤维素酶在Ct细胞表面附着后物化性质不变。在SSF过程中,保持细胞活力和酶活力的最适条件为40℃、pH 4.5。在此优化条件下,玉米芯的水解率可达56.02%,葡萄糖转化率为85.61%。通过对比在不同pH和氧气体积分数下Ct和ZIF-8@纤维素酶-Ct的生长情况,可以看出ZIF-8@纤维素酶-Ct的生长状态总体较无包覆的Ct具有更高、更稳定的比生长率、相对细胞活力和较低的相对活性氧水平,相较于其他固定化体系,ZIF-8@纤维素酶-Ct共固定化体系具有操作简易,便于放大过程,且具有良好的保护效果。发酵结果表明,ZIF-8-SSF丁酸产量32 h内最终质量浓度达到6.74 g/L,比无包覆的Ct提高了12.52%。

