温肾填精方及其拆方对肾阳虚不孕小鼠生殖功能的影响
董文然, 刘 奕, 陆 华
(成都中医药大学,四川 成都 610075)
现代社会发展迅速,人类面对日益增加的压力,熬夜、酗酒、暴饮暴食、纵欲等不良生活作息频率升高,阳虚质升高至整体人群偏颇体质前3位[1],诱发肾阳不足成为当代人群常见证候,更是成为不孕症的主要证候之一[2]。肾阳对机体有调节脏腑功能和增强机体活动的作用,而线粒体的功能在于为人体活动提供能量,现代医学研究发现,肾阳虚证与线粒体功能减退、能量代谢失调存在一定相关性[3]。本研究聚焦于肾阳虚证不孕小鼠生殖功能,从肾阳虚-线粒体动力学-能量代谢-生殖层面探讨温肾填精复方的效用机制。
1 材料
1.1 动物 SPF级昆明雌性小鼠144只,4~6周龄,体质量(20±2)g;SPF级昆明雄性小鼠20只,6~8周龄,体质量(30±3)g,均由成都达硕实验动物有限公司提供,实验动物生产许可证号SCXK(川)2020-030,饲养于屏障环境,采用分笼饲养,每笼6只,自由进食饮水,保持温度20~26 ℃,相对湿度40%~70%,昼夜光照。
1.2 药物 羟基脲片(500 mg/片)购于山东齐鲁制药有限公司),取2 g研成粉末,50 mL冰生理盐水配成混悬液,置于4 ℃冰箱中保存;孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG,1 000 IU/支)购于北京索莱宝科技有限公司,溶于20 mL 0.9%生理盐水中,置于-20 ℃冰箱中保存;人绒毛膜促性腺激素(chorionic gonadotropin,HCG,2 000 IU/支)购于丽珠集团丽珠制药厂,溶于20 mL 0.9%生理盐水中,置于-20 ℃冰箱中保存。温肾填精免煎剂由熟地黄15 g、山药15 g、山茱萸15 g、菟丝子15 g、淫羊藿10 g、肉苁蓉10 g、骨碎补10 g组成,1剂相当于免煎颗粒11.4 g,溶于0.9%生理盐水中配成0.23 g/mL混悬液;拆方一(资冲颗粒免煎剂)由熟地黄15 g、山药15 g、山茱萸15 g、菟丝子15 g组成,1剂相当于免煎颗粒8.4 g,溶于0.9%生理盐水中配成0.17 g/mL混悬液;拆方二(温肾补阳免煎剂)由淫羊藿10 g、肉苁蓉10 g、骨碎补10 g组成,1剂相当于免煎颗粒3.0 g,溶于0.9%生理盐水中配成0.06 g/mL混悬液,均由四川新绿色药业科技发展有限公司提供。
1.3 试剂 透明质酸酶(北京索莱宝科技有限公司,货号H3884);Quinn’s缓冲培养液ART-1023(美国SAGE公司,批号19230140);线粒体膜电位检测试剂盒(JC-1)(上海碧云天生物技术有限公司,货号C2006);RNA提取液(TRIzol,美国Invitrogen公司,货号15596018);HyPureTMMolecular Biology Grade Water(美国HyClone公司,货号SH30 538.02);5×All-In-One MasterMix(with AccuRT Genomic DNA Removal Kit)(货号G492)、EvaGreen Express 2×qPCR MasterMix-No Dye(货号0194844830001)(加拿大ABM公司);MOUSE ATP/NO/cAMP/cGMP ELISA KIT(上海联迈生物工程有限公司,货号EDL202009068);伊红、苏木素(美国Thermo Fisher公司,批号392155、420699);中性环保速干胶(南昌雨露实验器材有限公司,批号2018042101);4%多聚甲醛通用型组织固定液(北京兰杰柯科技有限公司,批号1810898)。三氯甲烷、异丙醇、无水乙醇(国药集团化学试剂有限公司,货号10006818、80109218、10009218);95%乙醇、二甲苯、多聚甲醛(成都市科隆化学品有限公司,批号2018012501、2018011701、2017041401)。
1.4 仪器 SW-CK-2FD型洁净工作台(苏州安泰空气技术有限公司);Allegra X-15R型台式冷冻离心机(美国Beckman Coulter公司);CFX96型实时荧光定量PCR系统(美国Bio-Rad公司);V4800型组织匀浆机(北京鼎昊源科技有限公司);80102型激光共聚焦培养皿(无锡耐思生命科技股份有限公司);LSM710型激光共聚焦显微镜(德国Zeiss公司);CK-40解剖显微镜(日本Olympus公司);3111型CO2细胞培养箱(美国Thermo Scientific公司);Vortex-5型振荡器(海门市其林贝尔仪器制造有限公司);Finnpipetter F3型微量移液器、Multiskan FC型酶标仪(美国Thermo Fisher公司);WGLL-125BE型恒温干燥箱、KD-98-ⅡA型恒温水浴锅(天津市泰斯特仪器有限公司);RM2235型石蜡切片机、DM1000型徕卡显微成像系统、819型切片刀(德国Leica公司);10212020C型盖玻片、1a5105型载玻片(江苏世泰实验器材有限公司)。
2 方法
2.1 分组与造模 小鼠适应性饲养1周后观察其阴道涂片,将动情周期规律的72只4周龄小鼠纳入实验,随机数字表法分为自然周期组、促排对照组、阳虚模型组、温肾填精颗粒组、温肾补阳颗粒组、资冲颗粒组。参考课题组前期阳虚小鼠造模方式[4]并进行优化,自然周期组、促排对照组每天上午9:00灌胃给予15 mL/kg生理盐水,其他4组小鼠同时间点灌胃给予400 mg/kg冰羟基脲混悬液,其间监测小鼠体质量、肛温、动情周期改变。21 d后,小鼠出现体质量和肛温下降、动情周期紊乱的现象,提示造模成功。
2.2 给药 造模结束后各组小鼠灌胃给予相应药物,每天1次,连续15 d,剂量为按《人和动物间按体表面积折算的等效剂量比率表》(成人体质量按60 kg计,小鼠平均体质量按20 g计)换算后的20倍,即温肾填精颗粒组、资冲颗粒组、温肾补阳颗粒组分别为3.4、2.5、0.9 g/kg,而自然周期组、促排对照组、阳虚模型组小鼠灌胃给予等容量生理盐水。
2.3 合笼 干预结束后,除自然周期组外,各组小鼠下午16:00腹腔注射5 IU PMSG,48 h后(即第3天下午16:00)腹腔注射5 IU HCG,超促排卵后每组随机选取6只雌鼠,与雄鼠1∶1~2∶1比例进行合笼。第2天早上观察各笼小鼠阴栓情况,如发现阴栓即代表受孕,另置于其他笼中饲养并进行标记,待子代小鼠出生后进行计数。
2.4 标本收集与处理 超促排完成后各组随机选取6只雌鼠,于超促排卵后12 h(自然周期组通过阴道涂片选取动情前期者)腹腔注射4%水合氯醛麻醉,眼眶静脉丛采血,收集到2 mL离心管中,4 ℃冰箱静置过夜,3 000 r/min离心10 min,分离得到血清。脱颈椎法处死,摘取双侧卵巢,将一侧卵巢放在4%多聚甲醛固定液中,另一侧置于冻存管内,放入液氮中保存待检。
2.5 ELISA法检测血清ATP、NO、cAMP、cGMP水平 根据相应试剂盒说明书步骤,检测各组小鼠血清ATP、NO、cAMP、cGMP水平。
2.6 卵母细胞获取及计数 除自然周期组外,其余各组随机选取6只小鼠,超促排卵后16 h(自然周期组通过阴道涂片选取动情前期者)水合氯醛麻醉,摘取双侧输卵管至35 mm培养皿中,在体视显微镜下戳破输卵管壶腹部,逐渐撕扯输卵管,释放所有卵丘,置于含透明质酸酶的培养皿中,分离颗粒细胞,将其卵母细胞再次放入含有M2培养液的培养皿内,在显微镜下观察卵母细胞分期并进行计数及鉴定。结果,GV期胞浆内可见生发泡;MⅠ期生发泡破裂,第一极体尚未排出;MⅡ期胞质均匀、卵周隙小,第一极体排出且表面光滑、透明带清晰均匀;异常卵的卵子形状不规则,胞质内出现折光区或大空泡,透明带增厚或凸起。
2.7 卵母细胞线粒体膜电位(ΔΨm)检测 按“2.6”项下方法分离卵母细胞,置于含JC-1工作液的培养皿中,在37 ℃下孵育20 min,JC-1缓冲液洗涤2次,将卵母细胞转移共聚焦培养皿内,在激光共聚焦显微镜下观察拍照,通过Zen blue lite 2.3软件分析图像,测量红、绿荧光数值。
2.8 HE染色观察卵巢组织病理形态 小鼠卵巢经固定、冲洗、脱水、透明后包埋于石蜡中,切成5 μm薄片,在温水中展平后捞起,贴附于载玻片后进行烘烤,二甲苯脱蜡后进行HE染色,树脂胶封片,采用显微成像系统对组织样品进行拍照,通过Image Pro Plus 6.0软件对图片中卵巢的各级卵泡和黄体计数。
2.9 RT-qPCR法检测线粒体功能相关基因的mRNA表达 液氮中取出小鼠卵巢组织,加入TRIzol后放入匀浆仪中进行总RNA抽提,检测RNA浓度及纯度,稀释至500 ng/μL,反转录试剂盒合成cDNA,采用EvaGreen Express 2× qPCR MasterMix-No Dye进行扩增,条件为预变性95 ℃ 10 min;95 ℃ 15 s,60 ℃ 60 s,共40个循环,每批样品设3个复孔,以β-actin为内参,2-ΔΔCT法计算各指标相对表达量,引物序列见表1,由生工生物工程上海(股份)有限公司合成。

表1 引物序列
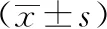
3 结果
3.1 温肾填精方及其拆方对小鼠合笼情况的影响 与自然周期组、促排对照组比较,阳虚模型组小鼠产仔数减少(P<0.01);与阳虚模型组比较,各中药组小鼠产仔数均有所增加,以资冲颗粒组、温肾补阳颗粒组更明显(P<0.05);与自然周期组、促排对照组比较,阳虚模型组小鼠活胎数减少(P<0.01);与阳虚模型组比较,各中药组小鼠活胎数增加(P<0.01);各组小鼠死胎数比较,差异无统计学意义(P>0.05),见表2。

表2 各组小鼠合笼子代数量
3.2 温肾填精方及其拆方对小鼠血清ATP、NO、cAMP、cGMP水平的影响 与自然周期组比较,阳虚模型组小鼠血清ATP、cAMP水平降低(P<0.05,P<0.01),NO水平升高(P<0.05),cGMP水平无明显变化(P>0.05);与促排对照组比较,阳虚模型组小鼠血清NO、cGMP水平升高(P<0.05,P<0.01),cAMP水平降低(P<0.01),ATP水平无明显变化(P>0.05);与阳虚模型组比较,各中药组小鼠血清ATP、cAMP水平升高(P<0.05,P<0.01),cGMP水平均降低(P<0.01),但各中药组组间无显著差异(P>0.05);与阳虚模型组比较,温肾填精颗粒组、资冲颗粒组小鼠血清NO水平降低(P<0.01),温肾补阳颗粒组无明显变化(P>0.05);温肾补阳颗粒组较资冲颗粒组NO水平有所升高(P<0.05),见表3。

表3 各组小鼠血清ATP、NO、cAMP、cGMP水平
3.3 温肾填精方及其拆方对小鼠获卵数的影响 与自然周期组比较,阳虚模型组小鼠异常卵数减少(P<0.01),MⅡ期卵率降低(P<0.01),总卵数、MⅡ期卵数、异常卵率无明显变化(P>0.05);与促排对照组比较,阳虚模型组小鼠总卵数、MⅡ期卵数减少(P<0.01),MⅡ期卵率降低(P<0.01),异常卵率升高(P<0.01),异常卵数无明显变化(P>0.05);与阳虚模型组比较,各中药组小鼠总卵数组增加,以温肾填精颗粒组、温肾补阳颗粒组更明显(P<0.01);与阳虚模型组比较,各中药组小鼠MⅡ期卵数增加(P<0.05,P<0.01),MⅡ期卵率升高(P<0.01),异常卵率降低(P<0.01),异常卵数无明显变化(P>0.05);温肾补阳颗粒组较资冲颗粒组MⅡ期卵率升高更显著(P<0.05),见表4、见图1。

表4 各组小鼠获卵分期及计数

图1 超促排卵后16 h小鼠输卵管采集MⅡ期卵和异常卵(×100)
3.4 温肾填精方及其拆方对小鼠卵母细胞ΔΨm的影响 与自然周期组、促排对照组比较,阳虚模型组小鼠卵母细胞ΔΨm降低(P<0.05,P<0.01);与阳虚模型组比较,各中药组小鼠卵母细胞ΔΨm升高(P<0.05),但各中药组组间无显著差异(P>0.05),见表5、图2。

表5 各组小鼠

图2 不同卵母细胞ΔΨm(×400)
3.5 温肾填精方及其拆方对小鼠卵巢内各级卵泡的影响 与自然周期组、促排对照组比较,阳虚模型组小鼠原始卵泡数、成熟卵泡数、黄体数减少(P<0.01),次级卵泡数、闭锁卵泡数增加(P<0.01);阳虚模型组小鼠初级卵泡数较自然周期组增加,较促排对照组减少(P<0.05);与阳虚模型组比较,各中药组小鼠原始卵泡数、成熟卵泡数增加(P<0.01),闭锁卵泡数减少(P<0.01),初级卵泡数、次级卵泡数、黄体数无明显变化(P>0.05);与资冲颗粒组比较,温肾填精颗粒组、温肾补阳颗粒组小鼠闭锁卵泡数减少(P<0.01),见表6、图3。

表6 各组小鼠卵巢各级卵泡数及黄体数

图3 各组小鼠卵泡期卵巢HE染色(×200)
3.6 温肾填精方及其拆方对小鼠卵巢线粒体功能的影响 与自然周期组比较,阳虚模型组小鼠Mfn1、OPA1 mRNA表达降低(P<0.05,P<0.01),Drp1 mRNA表达升高(P<0.01);与阳虚模型组比较,温肾填精颗粒组小鼠Mfn1、OPA1 mRNA表达升高(P<0.05,P<0.01),温肾填精颗粒组和资冲颗粒组小鼠Drp1 mRNA表达降低(P<0.05,P<0.01);与温肾填精颗粒组比较,资冲颗粒组和温肾补阳颗粒组OPA1 mRNA表达降低(P<0.05,P<0.01);各组小鼠Fis1 mRNA比较,差异均无统计学意义(P>0.05),见表7。
4 讨论
温肾填精方是由四川省名中医陆华研究员的经验方资冲颗粒结合温肾补阳类中药而成,方中熟地黄、山茱萸、山药肝肾脾并补,以补肾阴为主;淫羊藿、肉苁蓉补肾壮阳,暖宫助孕,全方配伍滋肾填精、温肾补阳,共同发挥补肾益天癸、养血滋冲任的功效[5]。本研究依据中医理论,在前期羟基脲模型的基础上对肾阳虚模型加以优化,将冰水与羟基脲复合进行灌胃,小鼠出现体质量下降、肛温降低等表现,结合合笼后小鼠无法成功受孕等结果分析,冰羟基脲可以更敏锐地建立肾阳虚证不孕的动物模型,随后将温肾填精复方拆解为养肾精的资冲颗粒方和温肾阳的温肾补阳方,与温肾填精复方分别干预模型小鼠,观察其对生殖功能的影响,并从线粒体动力学及能量代谢角度阐述其效用机制。

表7 各组小鼠线粒体动力学相关基因mRNA表达
现代医学研究将环磷酸腺苷(cAMP)和环磷酸鸟苷(cGMP)作为辅助判断阴虚、阳虚的客观指标[6-8]。本研究中模型组小鼠cAMP/cGMP比值降低,代表肾阳虚模型建立成功;中药干预后,cAMP/cGMP比值趋向正常,说明温肾填精方通过填肾精化肾气、温肾阳助温煦的功效,调节机体阴阳状态。
线粒体是卵母细胞重要细胞器,其产出ATP供应卵母细胞成熟过程中所需能量,ATP的合成受阻,导致卵子发育异常[9-10]。NO易过氧化干扰线粒体电子转移,削弱线粒体呼吸水平,降低ATP产生。此外,ATP合成同样受到线粒体内膜与外膜之间电位差(ΔΨm)的驱动[11-12]。国内外均有学者认为ΔΨm下降,标志着卵母细胞凋亡早期的信号[13-14]。本研究发现,肾阳虚状态下NO水平过高,ΔΨm呈低水平状态,影响线粒体功能,ATP合成降低,导致卵细胞成熟率低,异常卵多,卵巢储备功能下降,小鼠不孕。温肾补阳颗粒组通过增强机体阳气促进ATP合成,加强能量代谢,改善卵母细胞质量;资冲颗粒组通过滋肾填精,固护先天之本,提高机体免疫功能,减少NO水平,解除体内能量代谢抑制,降低卵泡闭锁发生;温肾填精复方取长避短,有效恢复卵巢储备。
1914年Lewis等[15]首次提出线粒体动力学基本概念,其在女性生殖方面的调控中扮演重要角色。Carvalho等[16]将小鼠Mfn1基因敲除,发现Mfn1缺乏影响卵泡-颗粒细胞间通讯,阻滞卵泡发育,小鼠出现不育,且卵母细胞中线粒体结构存在明显缺陷,氧化磷酸化水平及ATP合成明显降低,成为阻止卵母细胞生长和排卵的主要原因。Udagawa等[17]同样发现Mfn基因敲除小鼠卵巢出现了低水平ATP、mtDNA拷贝数下降,ROS升高,线粒体肿胀、嵴缺失或破裂等表现,使小鼠出现不育。说明线粒体动力学调控分子紊乱,导致线粒体在卵母细胞细胞质内分布异常、线粒体功能下降,是卵母细胞无法发育成熟、卵巢功能下降的原因之一。本研究发现模型小鼠线粒体动力学相关因子表达失衡,影响卵母细胞线粒体能量供应,无法支撑卵母细胞减数分裂,卵母细胞发育受到抑制;另一方面,线粒体分裂增加,融合下降,启动细胞凋亡控制系统,卵巢内卵母细胞闭锁加速。温肾填精颗粒组线粒体动力蛋白趋衡,且优于拆方组,表明该方通过改善线粒体动力水平,提高线粒体功能,增强能量代谢水平,使卵母细胞数量、质量得到提升,卵巢储备功能得以改善,恢复小鼠生殖功能。
本实验结果显示,肾阳虚小鼠卵子功能减退、卵巢储备功能降低,生殖能力低下,温肾填精复方及拆方对其生殖功能均有正向调节作用,温肾助阳方擅于提高能量代谢缓解阳虚表征,资冲颗粒方长于降低卵泡闭锁发生,温肾填精复方通过药物间相互配伍,酌盈剂虚,改变妊娠结局,可能与以下几项机制有关:①抑制NO异常高水平表达,使线粒体内氧化磷酸化趋近正常,增加ΔΨm,增强线粒体呼吸水平,加强ATP合成,保护卵母细胞减数分裂,改善卵子功能,增强卵巢储备;②平衡线粒体动力学蛋白水平,改善线粒体功能及分布,加强线粒体能量代谢,并抑制细胞过度凋亡,减少异常卵子及闭锁卵泡发生。而本实验中各治疗组未涉及量效关系研究,将在后续进一步开展研究。
综上所述,温肾填精复方在改善肾阳虚不孕小鼠生殖功能上存在一定疗效,可为日后临床中肾阳虚不孕症中卵巢储备功能下降患者,提高其卵巢功能,改善受孕结局提供参考依据。

