酱醪中耐盐高产酶菌株的筛选、分离和鉴定及其生化特性分析
周佳慧,林礼钊,吴惠贞,林伟锋*
(1.华南理工大学 食品科学与工程学院,广州 510640;2.鹤山市东古调味食品有限公司,广东 江门 529738)
酱油是以蛋白质原料和淀粉质原料为主,经米曲霉等多种微生物共同发酵酿制而成的调味品[1],具有独特的风味、色泽和丰富的营养价值[2]。传统上,酱油采用开放式的酿造工艺[3],是一个天然混合发酵的过程,曲霉、乳酸菌、酵母等外界微生物由于空气流动被带入到曲料生产的环节中,然后在发酵阶段加入一定量的盐水进行长时间的晒制,发酵周期长且酱油质量受环境影响大。由于天然微生物制曲法生产的酱油难以进行工厂的大规模生产来满足人们日益增长的需求,现代的酱油生产往往采用米曲霉纯种制曲法,发酵工艺也从完全开放式晒池发酵转换为密封性较佳的罐式发酵。酱油生产技术上的改良虽然能够大幅度地缩短酱油的发酵时长,使生产过程更可控,提高酱油的稳定性,但是也为酱油发酵带来了弊端,纯种制曲和封闭发酵方式这种过于单一的微生物体系,不能给酱油带来足够丰富的风味。
半开放池式发酵结合了传统及现代发酵工艺的特点,在开放式晒池的基础上设置了有一定高度的玻璃顶棚,保证充足日晒的同时,又防止了雨水等污染物进入晒池,降低外界环境对其中发酵微生物的影响。半开放式的晒池也为部分有利于酱油发酵的微生物的进入提供了机会,能够丰富酱油的微生物发酵体系[4]。酱油发酵是多种微生物共同作用的过程,曲霉[5-6]能够分解淀粉和蛋白质,生成还原糖、氨基酸等物质;乳酸菌[7]能在发酵前期产生乳酸等酸类物质,降低发酵体系的pH,进一步为酵母[8-9]发挥作用提供条件,两者产生的醇类、酯类等物质为酱油贡献了独特的香气[10]和风味[11]。本研究拟从半开放池式发酵的高盐稀态酱醪中分离纯化微生物,探究其酶系组成及特点,并从中筛选具有应用潜力的优质菌种,为酱油的多种菌株混合制曲[12-13]或在发酵各阶段投入不同种类的菌株提供理论和技术支持,使酱油发酵工艺得到进一步改进。
1 材料与方法
1.1 材料与试剂
酱醪:由鹤山市东古调味食品有限公司提供;牛肉膏、细菌学蛋白胨、琼脂、酵母提取粉:广东环凯微生物科技有限公司;氯化钠、葡萄糖、可溶性淀粉、磷酸二氢钾、乙酸钠、柠檬酸三铵、硫酸镁、硫酸锰:均为分析纯,广东广试试剂科技有限公司;福林酚试剂、DNS试剂:国药集团化学试剂有限公司;脱脂奶粉:市售。
1.2 培养基
一号筛选培养基:在LB培养基的基础上添加氯化钠50 g/L,脱脂奶粉20 g/L。二号筛选培养基:在MRS培养基的基础上添加氯化钠50 g/L,脱脂奶粉20 g/L。三号筛选培养基:在PDA培养基的基础上添加氯化钠50 g/L,脱脂奶粉20 g/L。脱脂牛奶培养基:脱脂奶粉20 g/L,氯化钠50 g/L,琼脂20 g/L,pH自然。淀粉培养基:在LB培养基的基础上添加氯化钠50 g/L,可溶性淀粉2 g/L。种子培养基:细菌学蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,pH为7.0。发酵培养基:细菌学蛋白胨10 g/L,酵母提取物5 g/L,氯化钠50 g/L,pH为7.0。营养琼脂培养基:细菌学蛋白胨10 g/L,牛肉膏3 g/L,氯化钠5 g/L,琼脂20 g/L,pH为7.3。灭菌条件:121 ℃,灭菌20 min,脱脂奶粉110 ℃,单独灭菌15 min。
1.3 仪器与设备
PHS-3C pH计 上海雷磁仪器有限公司;ZHJH-C1214B超净工作台、ZXSD-B1270生化培养箱 上海智城分析仪器制造有限公司;GF-6100电子天平 日本AND公司;PHG-9140A电热恒温鼓风干燥箱 上海精宏实验设备有限公司;CX31光学显微镜 日本奥林巴斯公司;THZ-98C恒温振荡器 上海一恒科学仪器有限公司;H1850R高速台式冷冻离心机 湖南湘仪实验仪器开发有限公司;Thermal Cycler 2720 PCR仪 美国应用生物系统公司;HH-4数显恒温水浴锅 常州澳华仪器有限公司;TU-1901双光束紫外可见分光光度计 北京普析通用仪器有限责任公司;SN510C立式压力蒸汽灭菌锅 重庆雅马拓科技有限公司;BC/BD-200HET卧式冷藏冷冻转换柜 青岛海尔特种电冰柜有限公司;DYY-6C电泳仪 北京六一生物科技有限公司。
1.4 方法
1.4.1 耐盐高产酶微生物的筛选流程
耐盐高产酶微生物的筛选流程见图1。

图1 筛菌过程Fig.1 Process of screening strains
1.4.2 耐盐高产酶微生物的初筛
分别从晒池中选取发酵6,30,60 d的酱醪,按上、中、下三层采样,称取25 g酱醪和225 mL生理盐水混合均匀后,取1 mL液体于装有9 mL生理盐水的试管中,混匀后用梯度稀释法依次进行稀释,取10-2,10-3,10-4梯度样品各100 μL分别涂布在氯化钠浓度为5%、10%、15%的初筛培养基上,一号、二号筛选培养基的培养条件为37 ℃,三号筛选培养基的培养条件为30 ℃,分别静置培养2~3 d后,菌落附近一旦有溶解圈出现,就说明该菌株能生产蛋白酶。
1.4.3 耐盐高产酶微生物的复筛
挑取周围有溶解圈的菌落点种在脱脂牛奶培养基及淀粉培养基上,37 ℃培养2 d后,测量脱脂牛奶培养基上菌落的蛋白溶解圈直径,将碘液喷洒在淀粉培养基上,测量淀粉溶解圈直径,挑取溶解圈与菌落直径比(D/d值)较大的菌株,并在LB培养基上分区域划线纯化,将得到的单菌落接入种子培养基中,在37 ℃条件下培养12 h后,用移液枪接入甘油管保种,储存在-40 ℃冰箱中。
1.4.4 菌株发酵液的酶活测定
在种子培养基中活化复筛保种的菌株,37 ℃、200 r/min培养12 h后取1 mL活化后的液体转接到发酵培养基中,24 h后,取发酵液在4000 r/min下离心15 min,以上清液作为待测酶液,参照GB/T 23527-2009,用福林酚法测定蛋白酶活性。根据酪氨酸标准曲线回归方程y=0.01033x+0.00269(R2=0.99973)计算发酵液中的蛋白酶活力。用DNS法测定淀粉酶活性[14],通过麦芽糖标准曲线回归方程y=0.61518x-0.03618(R2=0.99996)计算发酵液中的淀粉酶活力。优选高产蛋白酶菌株。
1.4.5 菌株产酶的稳定性分析
将筛选得到的菌株进行传代产酶稳定性分析,接种至发酵培养基中,在37 ℃、200 r/min的条件下每隔24 h转接1次,传代20 d,隔天取发酵上清液测定蛋白酶活性。
1.4.6 菌种鉴定
1.4.6.1 菌落及菌体形态观察
将活化后的高产蛋白酶的菌株涂布到LB固体培养基上,37 ℃培养24 h后,观察其菌落特征并挑取单菌落进行革兰氏染色,在显微镜下观察其菌体形态。
1.4.6.2 生理生化试验
将活化后的高产蛋白酶的菌株涂布在营养琼脂平板上,37 ℃培养24 h后,挑取单菌落于2 mL生理盐水中混匀,取100 μL菌液加入芽孢杆菌生化鉴定管中,培养数天后观察小管颜色变化。同时,取活化后的菌液1 mL加入带有杜氏小管的发酵培养基中,37 ℃培养4 d后,通过观察杜氏小管中是否产生气泡来检测菌株是否产气。根据菌株的生理生化结果,查阅《伯杰氏细菌鉴定手册》和《常见细菌系统鉴定手册》,按照书中提到的鉴定方法分析筛选得到菌株的生理生化特征。
1.4.6.3 菌株的16S rDNA鉴定
对筛选得到的菌株进行16S rDNA扩增,用试剂盒提取筛选得到的菌株的基因组DNA,以其为模板,上下游引物为细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)。PCR扩增反应体系(30 μL):DNA 1 μL,上下游引物各1 μL,2×PCR Mix 15 μL,剩下由ddH2O补足至30 μL。PCR条件:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸75 s,35次循环,72 ℃修复延伸5 min。经琼脂糖凝胶电泳后,将扩增产物送至广州天一辉远基因科技有限公司测序,序列结果在NCBI数据库中比对,根据序列同源性利用MEGA-X软件构建系统发育树。
1.4.7 菌株的生长特性
将活化后的菌株以1%的接种量接种至发酵培养基中,在37 ℃、200 r/min条件下培养48 h。0~24 h每隔2 h取发酵液测定OD600值、pH值,以时间为横坐标,OD600值、pH值为纵坐标绘制菌株生长曲线及pH值曲线;0~48 h每隔6 h取发酵上清液测定蛋白酶活力,以时间为横坐标,蛋白酶活力为纵坐标绘制菌株产酶曲线;0~24 h每隔3 h取发酵液测定总酸(以乳酸计)及氨基酸态氮含量,以时间为横坐标,总酸及氨基酸态氮含量为纵坐标绘制菌株总酸及氨基酸态氮含量变化曲线。
1.5 数据处理
使用Origin 9.65软件对数据进行处理和图表绘制,SPSS Statistics 19软件进行差异显著性分析。
2 结果与讨论
2.1 菌株的筛选
氨基酸态氮含量和还原糖含量是体现酱油品质的重要指标,与发酵体系中的蛋白酶及淀粉酶活力密切相关[15]。所以本试验主要考察菌株分泌蛋白酶和淀粉酶能力,目的是筛选出不同于酱油发酵的传统微生物,丰富菌种资源。菌株分泌的蛋白酶能够水解培养基中的脱脂奶粉,从而使菌落周围乳白色的培养基变为透明的溶解圈。同理,菌株分泌的淀粉酶能够将培养基中的淀粉水解成糊精、麦芽糖、葡萄糖等物质,导致菌落周围的培养基不能与碘反应产生蓝色络合物,从而形成溶解圈。经过多次涂布及纯化后,从初筛培养基中挑选了63株蛋白酶酶活较好的菌株,继续采用脱脂牛奶培养基和淀粉培养基对菌株进行蛋白酶及淀粉酶复筛,测量溶解圈直径,发现有15株菌在菌落周围形成明显的蛋白溶解圈及淀粉溶解圈,其溶解圈直径见表1。分别将15株菌株命名为ST-1、ST-2、ST-3、ST-4、ST-5、ST-6、ST-7、ST-8、ST-9、ST-10、ST-11、ST-12、ST-13、ST-14、ST-15。

表1 菌株在不同平板上的溶解圈直径Table 1 Diameters of dissolution circles of strains on different plates mm

续 表 mm
2.2 菌株蛋白酶及淀粉酶活力测定
由于平板溶解圈的大小还与菌落大小及酶的扩散速率等影响因素有关,因此平板溶解圈的大小不能作为判断菌株产酶能力的直接依据,还需要对15株菌株进行摇床发酵测定酶活。各菌株的蛋白酶活力和淀粉酶活力见表2。综合考量下,由于菌株ST-1、ST-6、ST-12的蛋白酶活力均能达40 U/mL,且淀粉酶活力都超过20 U/mL,因此选择这3株菌株进行后续的研究。

表2 不同菌株的酶活结果Table 2 Results of enzymatic activities of different strains U/mL
2.3 菌株产酶的传代稳定性
菌株在传代培养的过程中有基因丢失的风险,会造成菌株变异,使得其代谢产物发生变化。菌株的传代稳定性是该菌运用于工业生产的关键,如果菌株在传代过程中容易发生变异,就会限制其使用次数,增加工业生产成本。因此,为了评估菌株产酶能力的传代稳定性,分别考察了菌株ST-1、ST-6、ST-12传代后的产酶能力,结果见图2。


图2 菌株的传代稳定性Fig.2 Generation stability of strains
由图2可知,传代20次后,3株菌产蛋白酶和淀粉酶的能力均有所下降,其中,菌株ST-12产蛋白酶的能力下降最为明显,而菌株ST-1传代20次后其蛋白酶活力和淀粉酶活力仍可分别达到第1代的90%和86%。因此,选择产酶传代稳定性最高的菌株ST-1作为进一步研究的对象。
2.4 菌株的形态及生理生化鉴定结果
菌株ST-1在LB 固体培养基上的菌落呈乳白色不透明状,表面粗糙,有褶皱,中间微凸,边缘不规则,有少许黏性,易于挑取。菌体经革兰氏染色后利用普通显微镜进行观察,100倍显微镜下菌体的形态见图3。菌体为紫色,呈杆状,有芽孢,确定菌株ST-1为革兰氏阳性菌。

图3 菌株ST-1的菌落菌体形态和芽孢形态Fig.3 Colony and spore morphology of strain ST-1
生理生化试验结果见表3。

表3 菌株ST-1的生理生化鉴定结果Table 3 Physiological and biochemical identification results of strain ST-1
由表3可知,菌株ST-1对淀粉、酪素、明胶等具有水解能力,V-P试验呈阳性,能够利用柠檬酸盐,分解D-木糖和D-甘露醇,还原硝酸盐,与倪鑫鑫等[16]的试验结果类似。根据《伯杰氏细菌鉴定手册》和《常见细菌系统鉴定手册》中芽孢杆菌属的特征描述,初步确定菌株ST-1属于芽孢杆菌属。
在酱油的工业化生产中,常出现由微生物大量繁殖而引起的酱油胀罐发浑的现象[17-19],给工厂造成巨大的经济损失。由于芽孢杆菌有较强的耐受性,已有研究人员在胀气变质的酱油中筛选出了个别能引起酱油胀气变质的芽孢杆菌,因此,对菌株ST-1进行产气检测试验非常有必要。菌株ST-1产气检测结果见图4。

图4 菌株ST-1产气检测结果Fig.4 Gas production test results of strain ST-1
由图4可知,菌株ST-1在发酵培养基中培养4 d后,杜氏小管中没有气泡产生,证明该菌株不会引起酱油胀气变质。
2.5 菌株的分子鉴定结果
将提取到的菌株的DNA进行PCR扩增后,得到一段长度约为1500 bp的序列,琼脂糖凝胶电泳结果见图5。将所获序列提交NCBI进行BLAST分析,菌株ST-1的系统发育树见图6。

图5 菌株ST-1的16S rDNA琼脂糖凝胶电泳图Fig.5 16S rDNA agarose gel electrophoresis of strain ST-1

图6 菌株ST-1的系统发育树Fig.6 Phylogenetic tree of strain ST-1
由图6可知,菌株ST-1与菌珠BacillusamyloliquefaciensNBRC 15535(登录号:NR 041455.1)的亲缘关系最近,序列相似性为99.72%,结合菌株形态及生理生化鉴定结果,鉴定该菌株为解淀粉芽孢杆菌。
2.6 菌株的生长特性
菌株ST-1的生长曲线见图7中a,适应期为0~2 h,菌株在适应期内合成必需量的酶、辅酶或某些中间产物,以适应新的培养环境。对数生长期为2~10 h,且在2~8 h时生长最为旺盛,浓度快速升高,此时期的菌株活力最强。12 h后,菌株ST-1进入稳定期,个体形态及生理指标都较为稳定,利于菌种取样保存。该菌株的稳定期与对数生长期均较短,表明菌株更倾向于消耗有机物,而稳定期长则有利于菌株产生代谢物质[20]。菌株的pH变化曲线见图7中b,在0~4 h时发酵液pH略微下降,随后持续上升,符合菌株的总酸变化情况,菌株在生长前期大量繁殖,使得培养基pH降低,在生长稳定后,细菌分泌蛋白酶,分解蛋白胨等氮源,形成铵态氮,导致培养基pH升高。菌株的发酵产酶曲线见图7中c,当发酵30 h后,发酵液中蛋白酶酶活达到最高值70.21 U/mL。菌株的氨基酸态氮含量变化曲线见图7中d,培养基中的蛋白质被微生物分泌的蛋白酶分解,导致发酵液中氨基酸态氮含量逐渐上升。
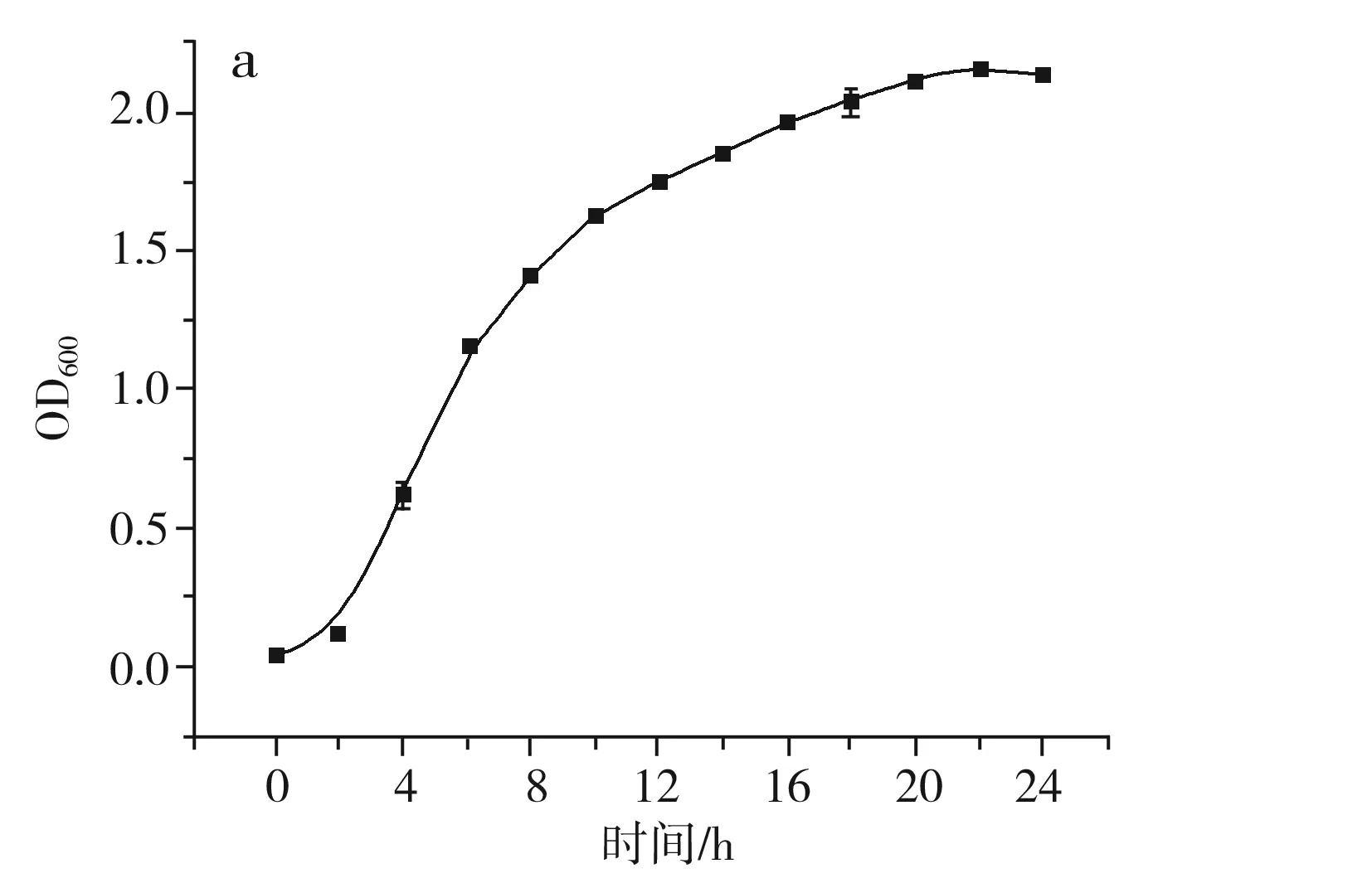



图7 菌株ST-1生长过程中理化指标的变化Fig.7 Changes of physical and chemical indexes during the growth of strain ST-1
3 结论
采用梯度稀释法和平板溶解圈法从半开放式晒池中的高盐稀态酱醪中筛选出1株耐盐芽孢杆菌ST-1,摇床发酵1 d后,其蛋白酶活力为62.08 U/mL,淀粉酶活力为31.17 U/mL。菌株ST-1传代20次后酶活稳定,其菌落呈乳白色不透明状,表面粗糙,有褶皱,中间微凸,边缘不规则,有少许黏性;对淀粉、酪素、明胶等具有水解能力,V-P试验呈阳性,能够利用柠檬酸盐,分解D-木糖和D-甘露醇,还原硝酸盐。结合16S rDNA序列分析,鉴定该菌株为解淀粉芽孢杆菌。
解淀粉芽孢杆菌是兼性厌氧菌,有运动性,在自然界中分布广泛,常用于食品的微生物发酵[21],有一定的耐盐能力,能够产蛋白酶及淀粉酶。目前,人们多采用在酱油酿造过程中添加耐盐乳酸菌及酵母的方法来促进酱油风味物质的形成,提高产品品质,而对酱醪中芽胞杆菌的研究较少。但近年来,许多研究人员对酱油发酵过程中的微生物动态变化进行了细致的探索[22],发现芽孢杆菌也对酱油发酵起着不可忽视的重要作用[23-25]。张梦寒[26]将解淀粉芽孢杆菌JY06的突变株C12和E6添加至酱醪中用于酱油发酵,结果发现能有效降低酱油中的氨基甲酸乙酯含量和瓜氨酸含量;吴博华等[27]、张丽杰等[28]将筛选得到的芽孢杆菌用于酱油制曲,盐卤发酵后发现酱油中的吡嗪类物质含量显著提高。本研究中解淀粉芽孢杆菌ST-1产中性蛋白酶能力较强,后期可对该菌株的产酶能力进行优化,研究该菌株在酱油发酵过程中的应用,为酱油发酵工艺提供优秀的菌种资源。

