重组大肠杆菌产活性短肽高密度发酵研究
(厦门金达威集团股份有限公司,福建 厦门 361022)
大肠杆菌遗传背景清晰、代谢可塑性强、培养条件简单、生长周期短,是代谢工程和合成生物学的最佳宿主生物之一[1]。随着大肠杆菌基因重组技术与大肠杆菌高密度发酵技术的发展,重组大肠杆菌的高密度发酵已成为发酵工业的研究热点之一[2]。高密度发酵技术可以提高基因工程菌的发酵密度和产物的时空产率,缩短生产周期,缩小发酵规模,降低生产设备投入,可以极大地提高目的产物在市场上的竞争力[3]。
代谢工程育种通过针对性菌株改造获得目的产物,可以大大提高育种效率与产量[4]。代谢控制发酵是一个复杂过程,重组大肠杆菌的内部代谢调控机制和外界环境(如培养条件、培养基配方、补料策略及表达系统的诱导方式),都对菌体高密度生长和异源蛋白表达具有重要影响[5]。目前,重组大肠杆菌高密度发酵工艺一般都使用天然培养基,其主要氮源为蛋白胨和酵母浸粉[6-11],这些天然培养基成分复杂,不同生产厂商的产品质量差异大,易造成发酵不稳定,且价格相对较高,导致发酵成本较大。无机盐培养基[12-15]是一种成分明确、价格低廉的培养基,其操作工艺简易且发酵稳定,在重组大肠杆菌工业化培养中具有极佳的应用价值。六胜肽EEMQRR是一种SNAP-25蛋白N端来源的衍生肽,由谷氨酸、谷氨酸、甲硫氨酸、谷氨酰胺、精氨酸和精氨酸组成。EEMQRR参与竞争SNAP-25在融泡复合体的位点,从而影响复合体的形成,当融泡复合体稍不稳定时,囊泡不能有效释放神经递质,从而促使肌肉收缩减弱,防止皱纹的形成。EEMQRR广泛应用在化妆品和护肤品领域,市场需求巨大。笔者以实验室自行构建的表达活性短肽EEMQRR的重组大肠杆菌作为出发菌株,对其无机盐培养基高密度发酵工艺进行研究,为该工艺推广至大肠杆菌重组表达其他相关产物提供理论依据和实践基础。
1 材料和方法
1.1 菌株和质粒
菌种为E.coliBL21(DE3);活性短肽EEMQRR基因及表达质粒pET-30a由笔者实验室保藏。
1.2 培 养 基
活化培养基:蛋白胨10 g/L,酵母粉5 g/L,氯化钠10 g/L,采用10%氢氧化钠溶液调整pH至7。
种子培养基:氯化钠3.5 g/L,酵母浸粉10 g/L,葡萄糖1 g/L,磷酸氢二钾3.68 g/L,磷酸二氢钾1.32 g/L,采用10%氢氧化钠溶液调整pH至7,灭菌条件为115 ℃,30 min。
TB培养基:蛋白胨12 g/L,酵母提取物24 g/L,磷酸氢二钾12.54 g/L,磷酸二氢钾2.31 g/L,甘油4 mL/L。
有机发酵培养基:葡萄糖25 g/L,蛋白胨35 g/L,酵母浸粉7.5 g/L,氯化铵6.7 g/L,磷酸氢二钠22.3 g/L,磷酸二氢钾8.5 g/L,硫酸镁1.25 g/L,硫酸钠1.8 g/L。其中葡萄糖、硫酸镁单独115 ℃,15 min灭菌;其余组分灭菌条件为121 ℃,20 min;灭菌后用氨水调整pH至7。
有机补料培养基:酵母浸粉50 g/L,蛋白胨25 g/L,葡萄糖400 g/L,硫酸镁4 g/L:葡萄糖、硫酸镁单独115 ℃,15 min灭菌;其余组分灭菌条件为121 ℃,20 min;消毒后合并补料。
无机盐发酵培养基:葡萄糖20 g/L,酵母浸粉4 g/L,磷酸氢二铵4 g/L,硫酸镁0.8 g/L,柠檬酸1.7 g/L,硫酸钠3 g/L,100×微量元素溶液6.6 mL/L,维生素B120 mg/L。其中微量元素溶液和维生素B1过滤除菌,于发酵前加入;葡萄糖单独115 ℃,15 min灭菌;其余组分灭菌条件为121 ℃,20 min;灭菌后用氨水调整pH至7。
100×微量元素溶液:柠檬酸铁10 g/L,四水合氯化锰1.5 g/L,六水合氯化钴0.25 g/L,二水合钼酸钠0.25 g/L,二水合氯化铜0.15 g/L,二水合醋酸锌1.3 g/L,硼酸0.3 g/L,乙二胺四乙酸0.84 g/L,纯水溶解后定容至1 L,过滤除菌,4 ℃保藏。
无机盐补料培养基:葡萄糖700 g/L,硫酸镁4 g/L,100×微量元素溶液2 mL/L,维生素B10.5 g/L。
1.3 培养方法
1.3.1 菌种活化
取冻存于-80 ℃的甘油菌,用接种环沾取后在活化培养基上均匀划线,于恒温培养箱中37 ℃倒置培养过夜,获得单克隆菌体。
1.3.2 种子培养
接种环挑取活化的单克隆菌体,接种至10 mL活化培养基中,37 ℃,200 r/min恒温振荡培养过夜。以5%的接种量(以体积计,下同)将活化培养基接种至150 mL种子培养基中,培养至OD600为1~1.5。
1.3.3 摇瓶发酵
活化培养基以5%的接种量转接到50 mL TB培养基中,37 ℃,200 r/min恒温振荡培养至OD600为0.6~0.8,加入终浓度为0.08 mmol/L的IPTG,诱导培养6 h。
1.3.4 5 L发酵罐培养工艺
按照5%的接种量将种子培养基接入灭菌后的无机盐发酵培养基中,二者混合后总体积为3 L。发酵罐温度全程控制在30 ℃,pH用氨水调节至7并维持在该水平,通过转速和通风量交替调整控制溶氧为20%~30%。发酵前期流加补料培养基并控制葡萄糖质量浓度为1~3 g/L,当OD600为70~80时,先加入1 g/L的酵母浸粉溶液,再加入终浓度为0.2 mmol/L的IPTG开始诱导表达,诱导后使用DO-stat补料方式,30 ℃培养至发酵结束。
1.3.5 发酵工艺优化
通过研究发酵培养基类型、碳源、诱导时机、铵离子浓度和有机氮源等因素对活性短肽EEMQRR表达的影响,以获得最佳发酵表达条件。
1.4 检测方法
1.4.1 发酵液中葡萄糖质量浓度和生物量测定
葡萄糖质量浓度通过西尔曼M-100生物传感器分析仪测定;生物量以UV-8000分光光度计测量菌液在600 nm波长下的吸光度OD600表征。
1.4.2 发酵液中铵离子浓度测定
铵离子浓度根据苯酚-次氯酸盐方法(Berthelot反应)测定,具体操作条件和步骤参考文献[16]。
1.4.3 活性短肽EEMQRR表达分析
发酵结束后收集菌体,经Avestin纳米级超高压均质机破碎菌体并离心,获得菌体全菌裂解液、裂解液上清和裂解液沉淀。全菌裂解液和裂解液沉淀中所含的目标包涵体可用缓冲液(尿素8 mol/L、tris-HCl 50 mmol/L、NaCl 200 mmol/L、咪唑25 mmol/L,pH 7.2)重悬溶解为可溶性蛋白,用SDS-PAGE检测目的蛋白,并利用ImageJ软件分析目的产物在全菌裂解液中的纯度。
1.4.4 活性短肽EEMQRR表达量检测
首先,分别取BSA标准品(2 mg/mL)0.5,1.0,1.5,2.0,2.5 μL至96孔酶标板中;然后,将供试样品稀释适当倍数后取1 μL至酶标板中,重复3孔;最后,各孔加入200 μL考马斯亮蓝染色液反应。用multiskan go酶标仪测定A595吸光值,依据A595绘制标准曲线并计算供试样品全菌裂解液的蛋白质质量浓度,结合1.4.3节目的产物在全菌裂解液中的纯度,计算出目的产物的表达量。
2 结果与分析
2.1 摇瓶发酵表达
大肠杆菌表达目的蛋白液定位在胞内、胞外和周质3个腔内。根据表达产物的定位,目的基因在大肠杆菌中的表达形式一般分为胞内表达和分泌表达,以胞内表达为主要形式,胞内产物可分为可溶性表达和不溶性的包涵体形式。
笔者初步设想通过实现活性多肽包涵体,得到多倍体的不溶性串联多肽,经过复性后用特异性胰蛋白酶降解活性多肽,纯化获得活性单肽。首先对实验室构建成功的BL21(DE3)/pET30a-EEMQRR(32倍体和48倍体)进行摇瓶发酵验证,然后对产物EEMQRR在大肠杆菌中表达情况进行分析,结果如图1(a,b)所示。由图1(a)可知:笔者构建的活性短肽EEMQRR的32倍体和48倍体均在重组大肠杆菌中有高效表达,表达量及纯度随着诱导时间的延长而增加。SDS-PAGE电泳显示:2个蛋白分子量大小分别约为30,50 kD,与设计序列分子量大小相符。经ImageJ软件分析,EEMQRR 32倍体的质量约占总蛋白的47.7%,EEMQRR 48倍体的质量约占总蛋白的57.1%,基于产物效率及表达纯度,优先选择EEMQRR 48倍体菌株作为后续5 L罐无机盐培养基高密度发酵菌种。由图1(b)可知:活性短肽EEMQRR多倍体均以包涵体的形式表达,符合笔者设想,可以为后续蛋白质纯化提供实验基础。

M—Marker泳道;1—诱导前样品;2—EEMQRR(32倍体)诱导 2 h;3—EEMQRR(32倍体)诱导4 h;4—EEMQRR(32倍体) 诱导6 h;5—EEMQRR(48倍体)诱导2 h;6—EEMQRR(48倍体)诱导4 h;7—EEMQRR(48倍体)诱导6 h。
2.2 5 L发酵罐无机盐培养基验证及工艺研究
重组大肠杆菌摇瓶发酵表达活性肽由于受溶氧、补料、诱导方式及发酵条件等各种因素限制,往往达不到工业化生产的水平。在确认摇瓶工艺条件后,通过5 L发酵罐发酵对主要影响因素进行研究,以提高产量、优化成本,简化操作工艺,进而实现工业化大生产。
2.2.1 活性短肽工程菌的5 L发酵罐分批补料发酵
为了评估活性短肽EEMQRR规模化生产的潜力,在5 L发酵罐中对EEMQRR 48倍体进行补料发酵。无机盐培养基营养成分明确,在营养匮乏的情况下,大肠杆菌会不断合成体内所需的氨基酸,从而为活性短肽的高效合成提供机会。相较于无机盐培养基,营养丰富的有机培养基是常规高密度发酵的基础。笔者对两个不同发酵培养基的发酵工艺进行比较,发酵结果如图2(a,b)所示。由图2(a,b)可知:1) 有机培养基在高密度发酵诱导前已经提前泄漏表达,发酵24 h的OD600为77.56,放罐终点表达量为4.4 g/L;2) 无机盐培养基分批补料发酵过程中基本无泄漏表达,发酵12 h时OD600达到75.72,随后加入IPTG开始诱导,诱导后OD600仍持续增长,放罐终点时OD600达到了145.8,且表达量可达12.72 g/L,优势明显。该工艺经过实验室重复验证,结果表明其稳定可行。

图2 5 L发酵罐分批补料发酵情况
2.2.2 碳源选择实验
在重组大肠杆菌分批补料发酵时,葡萄糖和甘油是最常用的两种碳源。理论上当以葡萄糖为唯一碳源时容易产生乙酸,从而影响大肠杆菌的生长和外源基因的表达,所以在使用葡萄糖为碳源时,一般采用限制流加方式来补料。为降低葡萄糖产乙酸的效应,部分实验采用甘油替代葡萄糖作为碳源。在无机盐培养基中分别以甘油和葡萄糖作为唯一碳源进行发酵培养并比较,结果如图3所示。在无机盐培养基中以甘油为碳源时,OD600很难达到理想值,最高增长到约25就停滞不前,不符合高密度发酵要求,也无法实现高产,故笔者在后续实验中选择葡萄糖作为唯一分批补料发酵的碳源。

图3 5 L发酵罐分批补料发酵碳源实验
2.2.3 诱导时机选择
在重组大肠杆菌表达活性短肽EEMQRR 48倍体的无机盐培养基分批补料发酵过程中,OD600达到80时属于该菌株对数中后期,比生长速率μ>1,发酵结束时OD600>140,目的产物表达量达到12.72 g/L。在OD600为25~30时开始诱导,OD600最高为54,由于诱导过早,造成菌体代谢负担较早过重,重组质粒丢失,表达量较低。在OD600为50~60时诱导,表达量较OD600为25~30时明显提高,不过仍无法与OD600为70~80时相比。为获得活性多肽的最高产量,综合考虑发酵菌体得率和活性短肽表达量,选择在OD600为70~80时开始诱导,发酵结果如图4(a,b)所示。

图4 诱导时机对菌体生长和活性短肽表达的影响
2.2.4 铵离子浓度优化
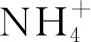

图5 不同铵根离子浓度对活性短肽发酵的影响
2.2.5 有机氮源的影响
蛋白胨和酵母浸粉是重组大肠杆菌高密度发酵中最常用的2种有机氮源,虽然它们能为基因工程菌发酵培养提供丰富的营养,但是它们成分不明确,并且用量大、价格高,不利于工业化成本控制。实验结果表明:有机培养基中蛋白胨的存在促使重组大肠杆菌在加入IPTG诱导前已泄漏表达,最终造成活性短肽产量低,而无机盐培养基则没有出现该情况,结果如图6(a,b)所示。因此,以氨水作无机氮源的发酵培养基,其成分和用量明确,原料价格低廉,适合重组大肠杆菌表达活性短肽。重组大肠杆菌在无机盐培养基高密度发酵时存在前期起步较慢,中后期菌体发生自溶的现象。进一步的优化实验显示:在无机盐培养基基础上适量添加有机氮源,即在发酵初始和诱导时分别加入4 g/L和1 g/L酵母浸粉,有利于促进前期菌体生长和避免中后期自溶,可以提升发酵工艺的稳定性。

M—Marker泳道;1—诱导前样品;2—EEMQRR(48倍体) 诱导3 h;3—EEMQRR(48倍体)诱导17 h。
3 结 论
以活性短肽为目的产物,从摇瓶发酵出发,经SDS-PAGE电泳计算出活性短肽EEMQRR 48倍体的表达量占总蛋白的57.1%,其表达形式为胞内包涵体;通过在5 L发酵罐对BL21(DE3)/pET30a-EEMQRR进行有机培养基和无机盐培养基的高密度发酵对比,确立无机盐培养基的优势;先后考察碳源、诱导时机、铵离子浓度和有机氮源等重要因素对EEMQRR 48倍体表达的影响,确定无机盐发酵培养基的最佳发酵工艺。最佳发酵工艺:以葡萄糖为唯一碳源,当OD600为70~80时开始诱导,发酵过程中铵离子最适浓度为152 mmol/L且不能积累超过228 mmol/L,同时在发酵初始和诱导时分别加入4 g/L和1 g/L酵母浸粉以提高发酵工艺的稳定性。研究结果为活性短肽的产业化提供了实验基础数据,并且通过多批次发酵证明了无机盐培养基高密度发酵工艺的可重复性和高效性,该工艺具有推广至重组大肠杆菌高效表达其他目的蛋白的商业化价值。

