多组学技术探讨GRAP2在复发性流产中的潜在作用机制
王琳琳,邓志敏,周林燕,杨静,赵玉林,李龙飞*,程艳香*
(1.武汉大学人民医院妇产科,武汉 430060;2.深圳中山泌尿外科医院生殖中心,深圳市围着床期生殖免疫重点实验室,深圳中山生殖与遗传研究所,深圳 518045)
近年来随着社会发展带来的生活方式的改变、工作压力的增大以及女性生育年龄的上升等因素,我国不孕不育患者的数量逐年增加。不孕不育已成为影响人类发展与健康的全球性医学和社会学问题,严重干扰患者身心健康和家庭幸福,同时也给社会稳定和医疗卫生等诸多方面带来严峻挑战[1]。复发性流产是常见的妊娠并发症,定义为发生于孕20周前、连续2次或2次以上的自然流产,其发病率占育龄女性的1%~5%[2]。复发性流产的病因极其复杂,除染色体异常外,生殖道解剖因素、感染性疾病、内分泌紊乱、自身免疫疾病、高凝倾向、心理及环境因素等均有可能导致流产的发生[3]。然而,仍有近半数复发性流产患者病因不明[4]。本文拟结合多组学技术及生物信息学手段探讨复发性流产的可能机制,为临床诊疗提供新思路。
资料与方法
一、研究对象
在NCBI(National center for biotechnology)的公共GEO数据库(https://www.ncbi.nlm.nih.gov/)中检索含有人源复发性流产早孕期绒毛样本信息的数据芯片,下载可用数据集(GSE43256、GSE73025、GSE22490)作为分析对象。GSE43256芯片信息:Illumina Human Methylation27 BeadChip,平台是GPL8490,该芯片中包含10例复发性流产早孕期绒毛组织和10例正常早孕期绒毛组织的甲基化数据;GSE73025芯片信息:Exiqon miRCURY LNA microRNA array,平台是GPL20917,包含5例复发性流产和5例健康女性早孕期绒毛组织的miRNA表达数据;GSE22490芯片信息:Affymetrix Human Genome U133 Plus 2.0 Array,平台是GPL570,包含4例复发性流产早孕期胎盘组织和6例健康女性胎盘组织的mRNA表达数据。
二、方法
1.关键基因的筛选:通过R包(GEOquery、limma、dplyr、tidyverse)对原始数据进行校对、数据ID转换及分析。不同数据集采用不同的|log2FC|进行筛选,主要是考虑在获取足够数量数据的同时,尽量让|log2FC|保持较高的值。GSE43256筛选的标准为|log2FC|>0.1[5-6],GSE73025筛选的标准为|log2FC|>1.5,GSE22490筛选的标准为|log2FC|>0.5,全部数据为调准后P<0.05。GSE73025筛选获得的差异miRNA经miRWalk(http://mirwalk. umm.uni-heidelberg.de/)、miRDB(http://www. mirdb.org/)和Diana Tools(http://diana.imis.athena-innovation.gr/DianaTools/index.php)网站,进行目标mRNA的配对,并取3个网站数据的交集,得到GSE73025数据集关键的mRNA信息。最后,GSE43256、GSE73025和GSE22490的差异分子取交集(Vennny 2.1.0)[5,7-8],得到GRB2相关衔接蛋白2(GRB2-related adapter protein 2,GRAP2)。
2.关键基因的qPCR验证:为了验证目的基因的表达水平,本研究纳入2018—2021年于深圳中山泌尿外科医院生殖中心就诊的21例早孕期自然流产女性,其中包括3例复发性流产患者及18例早孕期健康妊娠但由于个人原因选择行人流手术的患者(患者夫妻双方及胎儿均染色体正常)。采集蜕膜及绒毛组织,提取组织总RNA(Qiagen RNeasy Plus Mini Kit,Qiagen,德国),采用逆转录试剂盒逆转录成cDNA并进行定量分析(PrimeScript RT Reagent Kit,Takara,日本;Luna Universal qPCR Master Mix,NEB,美国)。actin前向引物:5′-GCCTTTGCCGATCCGC-3′;actin反向引物:5′-GCCGTAGCCGTTGTCG-3′。GRAP2前向引物:5′-GGCCGCCTGCACAACA-3′;GRAP2反向引物:5′-GAAGAGTTTATCGGGTCATGGG-3′。数据以actin作为内参,进行相对表达量的计算,并进行3次重复实验。
3.关键基因的信息获取:通过Human protein atlas(https://www.proteinatlas.org/)和GeneCards(https://www.genecards.org/)获取GRAP2的组织、细胞表达水平及亚细胞定位。通过String(https://string-db.org/)获取GRAP2前10的互作蛋白。通过UCSC(http://genome.ucsc.edu/cgi-bin/hgGateway)获取GRAP2的基本信息,包括基因ID、转录本信息、蛋白ID等,并通过GeneCards获取GRAP2的突变信息,进一步采用SnapGene(版本4.1.9)和DOG(版本2.0)软件,分别绘制GRAP2外显子序列及蛋白二级结构;蛋白三级结构经PDB(https://www.rcsb.org/)获得。
4.基因突变对转录本及蛋白结构的影响:采用varSEAK(https://varseak.bio/)和Mutation Taster(https://www.mutationtaster.org/)分别预测GeneCards中获得的GRAP2基因突变位点对转录本剪切、蛋白结构的影响,及是否造成疾病。varSEAK中对转录本剪切的预测等级,分为1~5,等级越高,代表影响转录本剪切的概率越高。Mutation Taster中对蛋白结构的影响:PhyloP值介于-15~6之间,越高越保守,越高对蛋白的影响越大;Phast Cons值介于0~1之间,越高越保守,越高对蛋白的影响越大。
结 果
一、数据处理与关键分子获取
在NCBI数据库中,按照“Recurrent miscarriage + Homo sapiens + Series”的条目搜索后得到14个GSE数据集,剔除非复发性流产、复发性流产合并其他疾病、非绒毛组织、非早孕期标本、原始数据不全等数据,得到可用数据集3个(GSE43256、GSE73025、GSE22490)(图1A)。在|log2FC|>0.1且调整后P<0.05的条件下,从数据集GSE43256中共得到1 690个DNA甲基化差异表达基因。|log2FC|>1.5且调整后P<0.05的条件下,GSE73025得到48个差异表达的miRNA,进一步通过miRWalk、miRDB和Diana Tools得到差异表达miRNA的互作mRNA,取交集得到1 828个关键mRNA。|log2FC|>0.5且调整后P<0.05的条件下,GSE22490得到110个差异表达mRNA。将上述3个数据集取交集后得到关键分子GRAP2(图1B、C)。
二、GRAP2的表达及亚细胞结构定位
Human protein atlas的数据显示,在蛋白层面,GRAP2主要表达于胎盘组织及免疫细胞富集的器官,包括扁桃体、淋巴结、脾脏等(图2A);在母胎界面,GRAP2具体表达于绒毛(图2B)和蜕膜(图2C),并且在内膜组织(图2D)中也有表达;在RNA层面,GRAP2除了高表达于免疫细胞富集的器官,还在血液淋巴细胞中也有丰富的表达,特别是T细胞(图2E)。有趣的是,在胎盘组织中,GRAP2主要表达于纤维细胞及巨噬细胞(图2F)。
组学原始数据显示,复发性流产患者绒毛组织中GRAP2存在高甲基化现象,且靶miRNA表达水平升高。胎盘组织含有绒毛组织及蜕膜组织,组学数据显示复发性流产患者胎盘组织GRAP2的表达水平升高。本研究qPCR数据显示,与正常对照组相比,自然流产患者蜕膜组织显著高表达GRAP2(P=0.034 6),复发性流产患者蜕膜组织的GRAP2表达水平亦有升高的趋势,但无统计学差异(P>0.05);与正常对照组相比,复发性流产患者绒毛的GRAP2表达水平有下降的趋势,但无统计学差异(P>0.05),相反,自然流产患者绒毛的GRAP2表达水平显著升高(P=0.002 3)(图2G、H)。
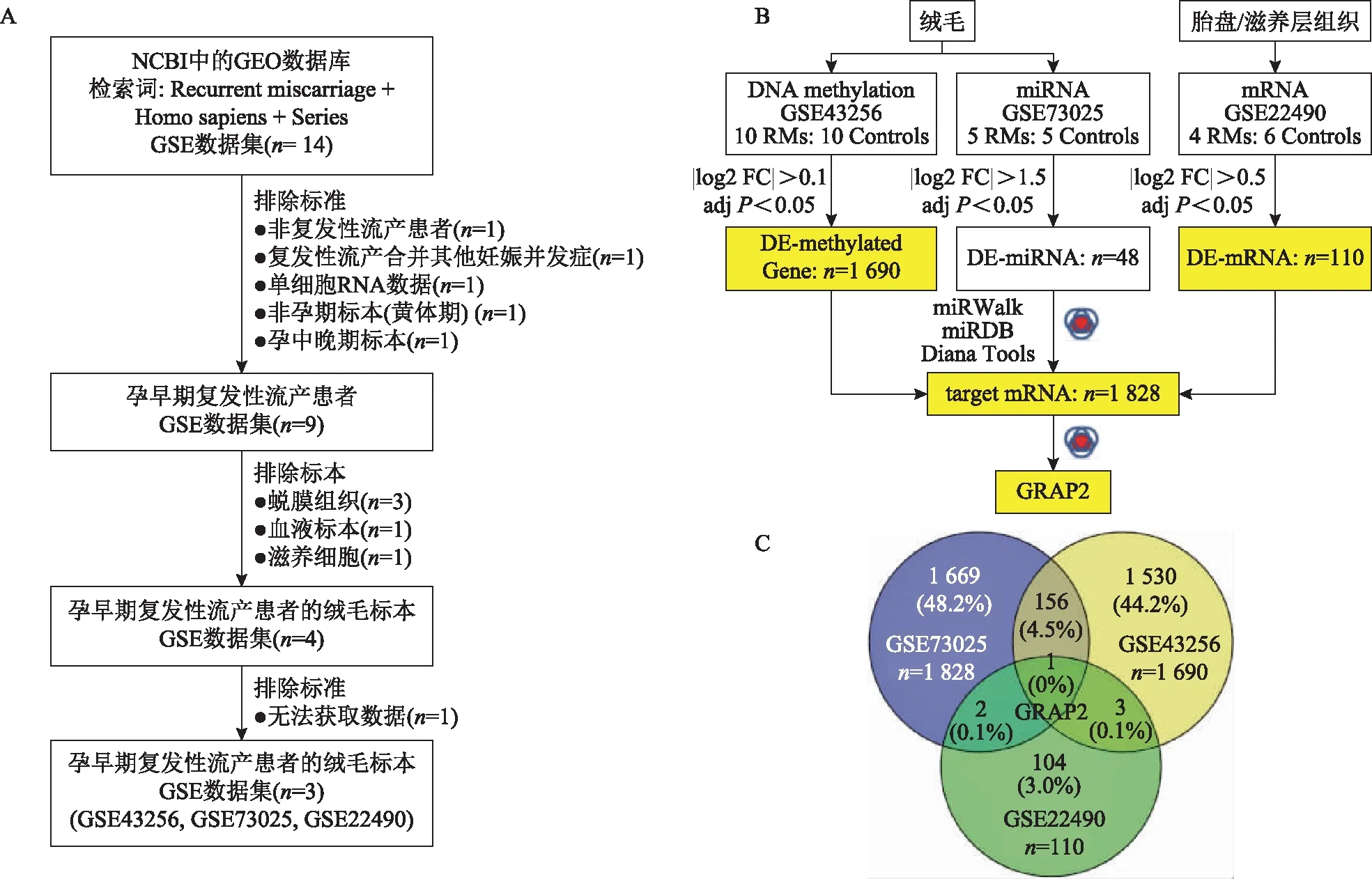
A:原始GEO数据集的获取;B、C:GRAP2的获取。
GRAP2的亚细胞结构定位数据显示,GRAP2在细胞核和细胞质中均有高表达(图3A、B)。
三、GRAP2蛋白互作网络
String的数据显示,GRAP2前10的互作蛋白包括跟T细胞免疫功能相关的分子,如LCP2、LAT、ZAP70、CD28、FYB和CD4,还包括与细胞生长、迁移、信号转导相关的分子,如PLCG1、SHC1、MAP4K1和CBL(图4、表1)。与GRAP2相关的主要通路(表2)也主要集中在跟T细胞免疫调节相关的通路(T cell receptor signaling pathway、TCR signaling、ICos-ICosL pathway in T-helper cell和CD28 co-stimulation)及与细胞增殖分化、血管新生相关的通路(RET signaling)。
四、GRAP2基因突变对转录本及蛋白结构的影响
UCSC的数据显示,GRAP2的转录本NM_004810(ENST00000344138.9)总的外显子为8个,编码外显子为7个(图5A)。GeneCards的突变位点数据,有4个落在外显子区域(图5B),分别是:c.834G>A(p.Ala278=)、c.739G>A(p.Gly247Ser)、c.466C>T(p.Arg156Trp)和c.801C>G(p.Leu267=)。其中,c.834G>A(p.Ala278=)位于蛋白结构域SH3中(图5C)。GRAP2的蛋白三级结构见图5D。
varSEAK和Mutation Taster的数据显示,GRAP2的上述突变不会影响转录本的剪切(图6),但c.834G>A(p.Ala278=)、c.466C>T(p.Arg156Trp)和c.801C>G(p.Leu267=)很可能会引起蛋白结构改变,并导致疾病的发生(表3)。

A:GRAP2在不同组织中的蛋白表达水平;B~D:GRAP2在绒毛组织、蜕膜组织及内膜组织中的定位表达;E:GRAP2在不同组织及血液细胞中的RNA表达水平;F:GRAP2在胎盘细胞中的RNA表达水平;G:GRAP2在正常蜕膜组织(NP-D)、自然流产蜕膜组织(SM-D)及复发性流产蜕膜组织(RM-D)中的RNA表达水平;H:GRAP2在正常绒毛组织(NP-F)、自然流产绒毛组织(SM-F)及复发性流产绒毛组织(RM-F)中的RNA表达水平。A~F:数据来源Human Protein Atlas。

A:数据来源GeneCards(大数据预测模式图);B:数据来源Human Protein Atlas(免疫荧光实验;3种肿瘤细胞系分别为:A-431、HEL和U-251-MG)。

图4 GRAP2蛋白互作网络

表1 GRAP2互作蛋白的功能介绍

表2 GRAP2蛋白主要相关通路
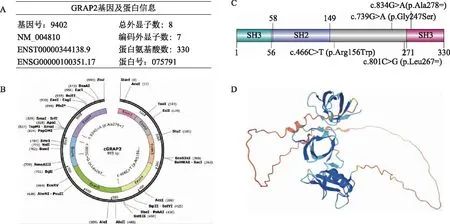
A:GRAP2基因及蛋白信息表;B:GRAP2外显子展示及相应的突变位点(采用SnapGene软件绘制);C:GRAP2蛋白二级结构及突变位点展示(采用DOG软件绘制);D:GRAP2蛋白三级结构展示(数据来源PDB)。

图6 GRAP2基因突变对转录本剪切的影响(varSEAK网站预测结果)
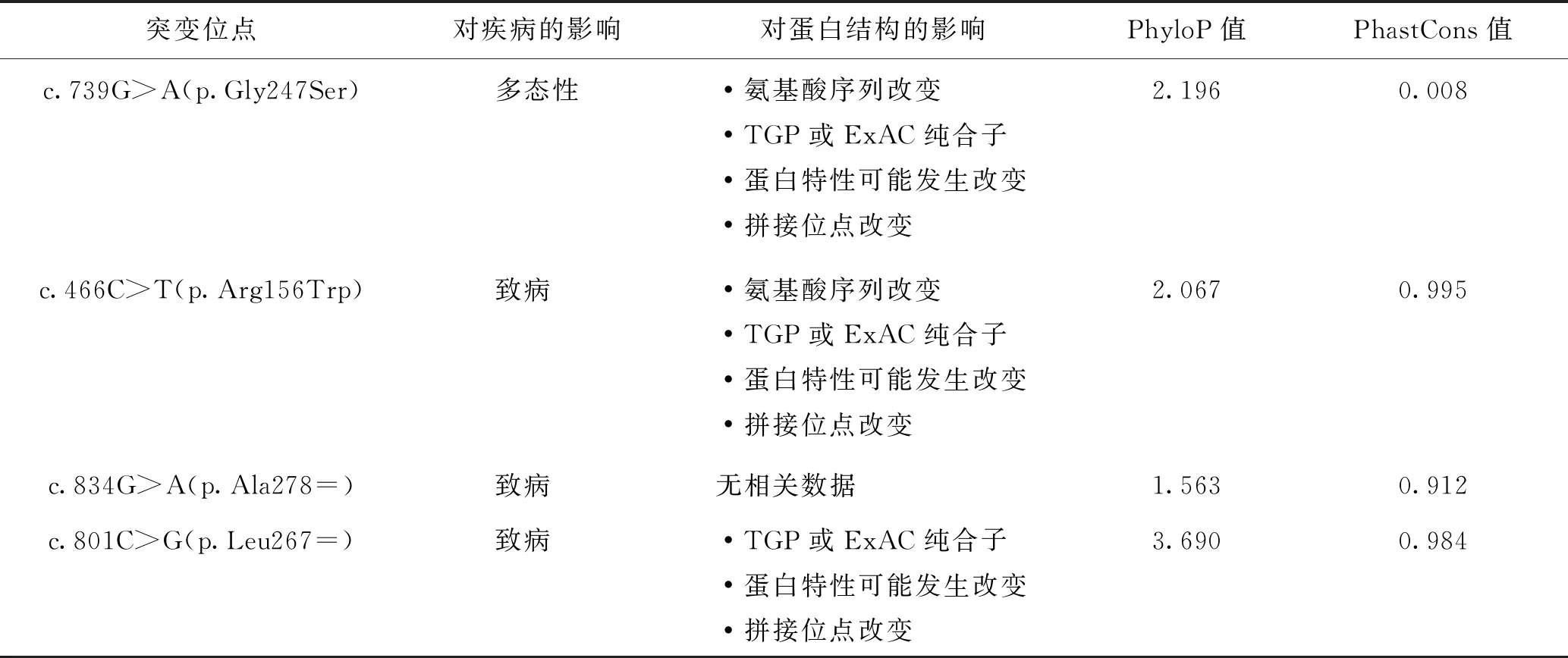
表3 GRAP2基因突变对蛋白结构的影响及对疾病的预测(Mutation Taster网站预测结果)
讨 论
本研究通过NCBI数据库,检索得到与复发性流产早孕期绒毛标本相关的3个GSE数据集,通过生物信息学分析筛选到关键分子GRAP2。GRAP2调控细胞的增殖分化,介导肿瘤的发生发展过程[9],并且GRAP2作为一种衔接蛋白,参与白细胞特异性蛋白质酪氨酸激酶信号传导[10],介导免疫细胞包括T、B、NK细胞等的免疫应答[11]。GRAP2包含一个SH2结构域,两侧是SH3结构域[12],该蛋白质通过其SH3结构域与其他蛋白质相互作用。因此,c.834G>A(p.Ala278=)位于蛋白结构域SH3中,该突变对蛋白结构及功能影响的可能性较高。但是,GRAP2的突变位点(c.466C>T(p.Arg156Trp)和c.801C>G(p.Leu267=))即使不在蛋白质结构域中,也可能影响蛋白结构,导致疾病的发生;并且即使GRAP2的突变位点不影响转录本的剪切位点,但由于翻译过程中氨基酸的改变,也会导致蛋白结构发生改变,最终影响疾病的发生发展。GRAP2基因突变对疾病的影响,提示GRAP2在生命过程中发挥的重要作用。
GRAP2的表达水平与其甲基化水平呈负相关[13]。GRAP2在复发性流产女性的绒毛组织中呈现高甲基化水平,且其上游miRNA(miR-4667-3p)高表达,均提示其在复发性流产患者绒毛中低表达。我们的PCR数据也显示,GRAP2基因在复发性流产患者的绒毛中有表达下降的趋势,而自然流产组GRAP2表达显著上升,可能是自然流产与复发性流产的疾病差异导致的。此外,组学数据中复发性流产患者胎盘组织GRAP2的表达水平升高,提示蜕膜组织可能高表达GRAP2,我们的数据也显示GRAP2在自然流产及复发性流产患者的蜕膜中均有升高的趋势。GRAP2与复发性流产相关的研究鲜见报道,但在其他领域,有报道显示,子痫前期患者与正常妊娠女性相比,产后血液中GRAP2高甲基化,并且与T细胞免疫紊乱相关[14]。孕期高NO2暴露也被报道与产后新生儿血液中GRAP2高甲基化水平相关[15]。Lin等[16]的报道显示,妊娠期糖尿病小鼠的后代心脏组织中GRAP2低表达,并且与T细胞功能紊乱相关。原发性免疫血小板减少症患者外周血Treg细胞中miR-4667-3p表达上调[17]。GRAP2在血液中主要表达于T细胞,并且其许多生物学功能也与T细胞的免疫应答相关。但是,GRAP2在母胎界面主要表达于纤维细胞及巨噬细胞,这可能与GRAP2在细胞生长、迁移、信号转导等方面发挥作用相关,同时也提示GRAP2可能通过调控绒毛组织中巨噬细胞的免疫功能来发挥作用。
本研究提示,早孕期绒毛组织中GRAP2基因的高甲基化水平或者其上游miR-4667-3p的上调,均可能下调绒毛GRAP2的表达,并且蜕膜组织中GRAP2的异常高表达,均可能干扰免疫应答或抑制胎儿细胞的增殖、分化、迁移等过程,导致复发性流产的发生。另外,GRAP2基因的突变可能通过影响蛋白的结构与功能,进而导致疾病的发生。GRAP2有望作为复发性流产诊疗的潜在靶点,但相关机制有待开展深入的分子生物学实验来验证。

