大肠杆菌醛醇脱氢酶的纯化、分析及其在乙酰辅酶A测定中的应用
孙梅好, 刘 杰, 袁 熹, 蒲首丞, 巩菊芳
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
从古细菌到哺乳动物,乙酰辅酶A(acetyl coenzyme A,Ac-CoA)在多种细胞过程中具有重要功能[1],作为一种中枢代谢中间体和第二信使,可调节细胞分解和合成代谢之间的平衡[2].乙酸是由单甲基和一个末端羧基组成的短链脂肪酸[3],属于一元羧酸[4].乙酰辅酶A合成酶(acetyl-CoA synthetase,ACS)是具有一定底物特异性的大型酶超家族的成员,催化辅酶A与羧酸之间形成硫酯键,同时将ATP水解为AMP和焦磷酸盐[5-6].ACS活性测定包括2种反应终止法:PPi[7]或14C标记Ac-CoA[8-10]的定量分析法,以及基于肌激酶、丙酮酸激酶和乳酸脱氢酶3种偶联酶的AMP连续测定体系[7,11].目前尚缺乏直接连续测定Ac-CoA的反应体系.
醛醇脱氢酶(aldehyde/alcohol dehydrogenase,AdhE)是一种参与革兰氏阴性细菌无氧代谢的双功能酶[12].在许多乙醇发酵微生物中,乙醇生产的最后两步是醛脱氢酶催化的Ac-CoA生成乙醛和醇脱氢酶催化乙醛生成乙醇.虽然许多醇脱氢酶可以催化醇脱氢反应,但能够催化醛脱氢反应的唯一已知酶是AdhE,且该酶具有醛脱氢酶和醇脱氢酶双结构域[13].AdhE氨基端的结构域与醛脱氢酶高度同源,而羧基端的结构域与Fe2+依赖的醇脱氢酶家族同源,其分别催化Ac-CoA生成乙醛、乙醛生成乙醇[14].该反应在发酵细菌的厌氧氧化还原平衡中具有关键性作用[15],对于细菌在厌氧状态下生产乙醇极为重要[16].
AdhE直接催化Ac-CoA生成乙醇,且在此过程中消耗NADH(ε339=6.22 L·mmol-1·cm-1),使得以AdhE为偶联酶直接连续测定Ac-CoA成为可能[17].本研究表达、纯化了大肠杆菌AdhE,分析了其酶学动力学常数,并以AdhE为偶联酶,对ACS酶活进行分析.结果表明,AdhE可以作为偶联酶测定ACS酶活,并建立了直接连续测定Ac-CoA的反应体系.
1 材料与方法
1.1 菌株与载体
大肠杆菌DH5α及BL21(DE3),原核表达载体His9(源自pGEX-6P-1双标签表达载体,在PreScission Protease编码区和BamH I识别位点之间加入NdeI识别位点,且融合蛋白GST的N端具有6×Histine)等,均保存于浙江师范大学化学与生命科学学院蛋白质结构与功能实验室.
1.2 酶与生化试剂
ATP、辅酶A、还原型辅酶I(NADH)购自上海生工生物工程股份有限公司;镍柱亲和层析树脂购自伯乐生命医学公司;rTaq聚合酶、XhoI、BamH I、ScaI等购自宝日医生物技术有限公司;无机焦磷酸酶(PPase)来自大肠杆菌的原核表达、纯化[18];乙酰辅酶A合成酶购自湖北新德晟材料科技有限公司;其他常规生化试剂为国产分析纯.
1.3 方 法
1.3.1AdhE基因克隆、表达与蛋白纯化
参照细菌基因组提取试剂盒的使用说明,提取大肠杆菌DH5α基因组DNA.以所提取的基因组DNA为模板,利用PCR技术(AdhE-F:GGATCCATGGCTGTTACTAATGTCGCTGAAC;AdhE-R:CTCGAGTTAAGCGGATTTTTTCGCTTTTTTC)扩增AdhE基因.在AdhE基因的5′端和3′端分别添加限制性酶切位点BamH I和XhoI.所得PCR产物连接入表达载体His9,获得载体His9-AdhE,经双酶切验证和测序验证序列正确,通过热激法转化His9-AdhE载体入E.coliBL21(DE3)感受态细胞,获得AdhE的表达菌株.将表达菌株接种到LB培养基中,培养至指数生长期(OD600=0.6),加0.5 mmol·L-1IPTG诱导蛋白表达(37 ℃,220 r/min,3 h);离心收集菌体,加入裂解液裂解45 min后,超声波破碎菌体至澄清,高速离心后收集上清液.原核表达的AdhE氨基端有多聚组氨酸标签,采用镍柱亲和层析法进行AdhE的分离纯化[19].经咪唑梯度(25,50,100,150,250 mmol·L-1)洗脱得到AdhE,进一步透析并经Bradford法测定蛋白浓度后,存于-80 ℃保存备用.
1.3.2 醛醇脱氢酶(AdhE)活性测定
利用分光光度法(瓦里安UV 4000,安捷伦)测定AdhE酶活.因AdhE催化的2步反应中均有NADH参与,通过测定反应体系中NADH(ε339=6.22 L·mmol-1·cm-1)在适当条件下(pH、温度)[20-21]光吸度的变化速率[22],可计算NADH的氧化速率,从而计算出AdhE的活性.AdhE的酶活测定体系为:1 μmol·L-1AdhE,1 mmol·L-1DTT,20 μmol·L-1FeSO4,100 mmol·L-1Tris-HCl(pH7.6),反应温度为25 ℃.在测定酶的动力学常数时,改变其中一个底物浓度,固定另一个底物浓度为10倍Km[23].利用230 μmol·L-1Ac-CoA,分别以不同浓度的NADH(25,75,125,175,225,275,325,375和425 μmol·L-1)起始反应并测定NADH的氧化速率.利用0.4 mmol·L-1NADH,分别以不同浓度的Ac-CoA(5,20,40,80,120,160,200和230 μmol·L-1)起始反应并测定NADH的氧化速率.利用米氏方程进行数据拟合,分别获得NADH和Ac-CoA的Km及Vmax.
1.3.3 乙酰辅酶A合成酶(ACS)活性测定
ACS催化乙酸与辅酶A合成Ac-CoA,Ac-CoA经由足量AdhE催化产生乙醇,同时氧化NADH.通过直接测量OD339随时间的变化速率,可反映Ac-CoA合成速率,进而反映ACS的催化活性.ACS的酶活测定体系为:20 μmol·L-1AdhE,0.02 mmol·L-1ACS,5 μmol·L-1PPase,1 mmol·L-1DTT,20 μmol·L-1FeSO4,0.32 mmol·L-1CoA,0.4 mmol·L-1NADH,100 mmol·L-1Tris-HCl(pH7.6),反应温度为35 ℃.根据前期预实验得到的数据,利用1 mmol·L-1ATP与0.4 mmol·L-1MgCl2,分别以不同浓度的乙酸(0.2,0.5,0.8,1.0,1.5,2.0,2.5,3.5,4.5,5.3和7.0 mmol·L-1)起始反应并测定反应体系中NADH的氧化速率.利用7.0 mmol·L-1乙酸与适当浓度的MgCl2,分别以不同浓度的ATP(0.04,0.08,0.14,0.21,0.28,0.35,0.42,0.48,0.66,0.84,0.91和1.11 mmol·L-1)起始反应并测定NADH的氧化速率.利用米氏方程进行数据拟合,分别获得乙酸和ATP的Km及Vmax.
2 结 果
2.1 大肠杆菌AdhE基因的克隆以及蛋白质的表达纯化
AdhE基因的PCR扩增产物连接入载体His9(BamH I和XhoI),构建原核表达载体His9-AdhE.经双酶切和琼脂糖凝胶电泳验证,各DNA片段大小与预期结果一致(AdhE基因为2 676 bp,His9载体为4 200 bp)(见图1).AdhE基因序列进一步经过测序验证,经大肠杆菌BL21(DE3)表达、亲和层析纯化获得分子量为96 kD的AdhE(见图2).
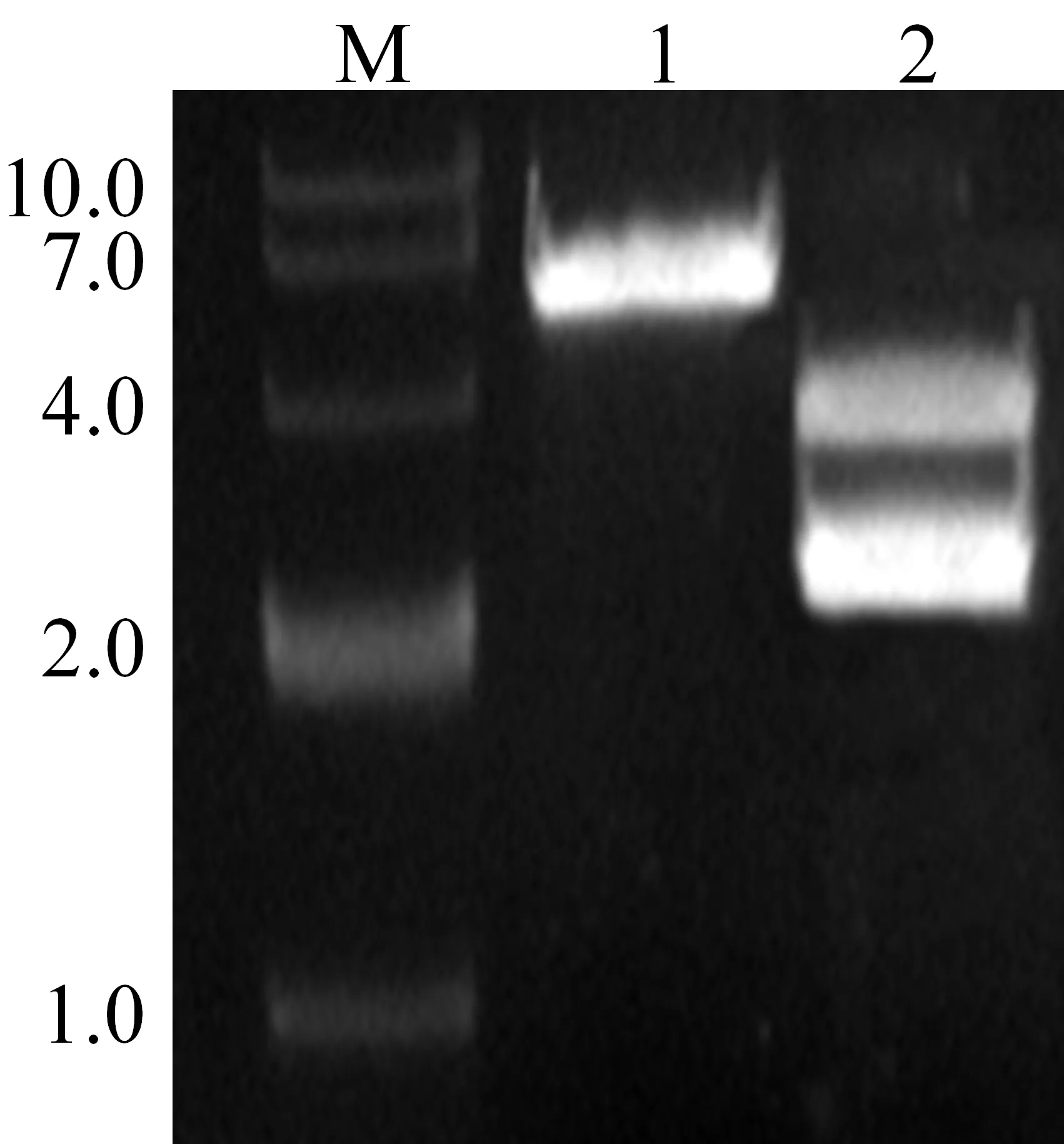
M:DNA分子量标准(kb);1:未经酶切的His 9-AdhE质粒; M:蛋白质分子量标准;1:诱导前菌体;2:诱导后菌体;2:双酶切验证各条带 3:裂解后上清;4:纯化后目的蛋白
2.2 AdhE的动力学常数测定
为了分析AdhE的酶学动力学常数,分别测定在不同NADH和Ac-CoA浓度条件下的反应速率,利用米氏方程进行拟合(见图3),获得由AdhE催化的依赖NADH的Ac-CoA还原反应kcat为13.8 min-1,NADH和Ac-CoA的Km值分别为(73.4±6.5)和(52.8±6.0) μmol·L-1(见表1).
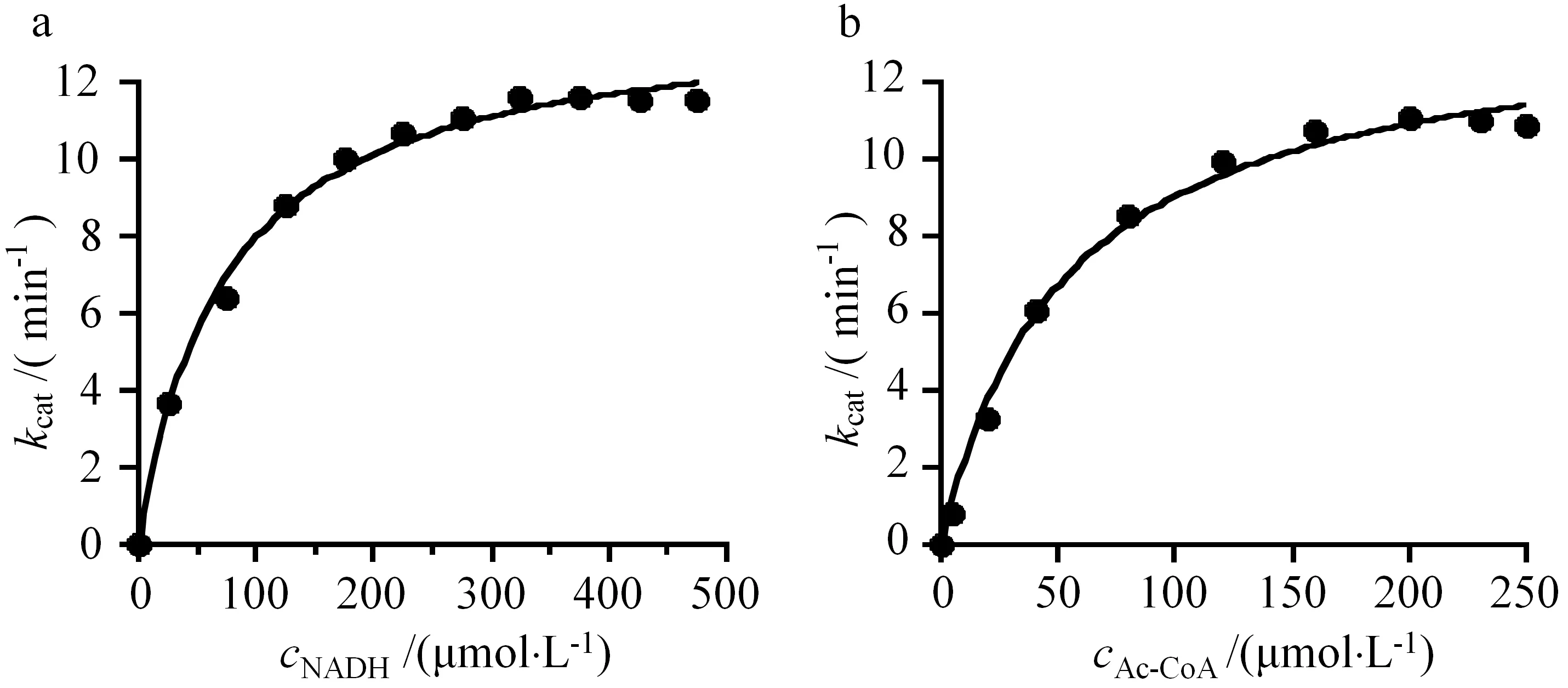
a:不同NADH底物浓度对反应速率的影响;b:不同Ac-CoA底物浓度对反应速率的影响

表1 AdhE的动力学常数
2.3 ACS的动力学常数测定
为了分析ACS的酶学动力学常数,以AdhE为偶联酶,分别测定在不同乙酸和ATP浓度条件下的反应速率,利用米氏方程进行拟合(见图4),获得由ACS催化的Ac-CoA合成反应kcat为10.5 min-1,乙酸和ATP的Km值分别为(1.31±0.17) mmol·L-1和(150.1±14.70) μmol·L-1(见表2).
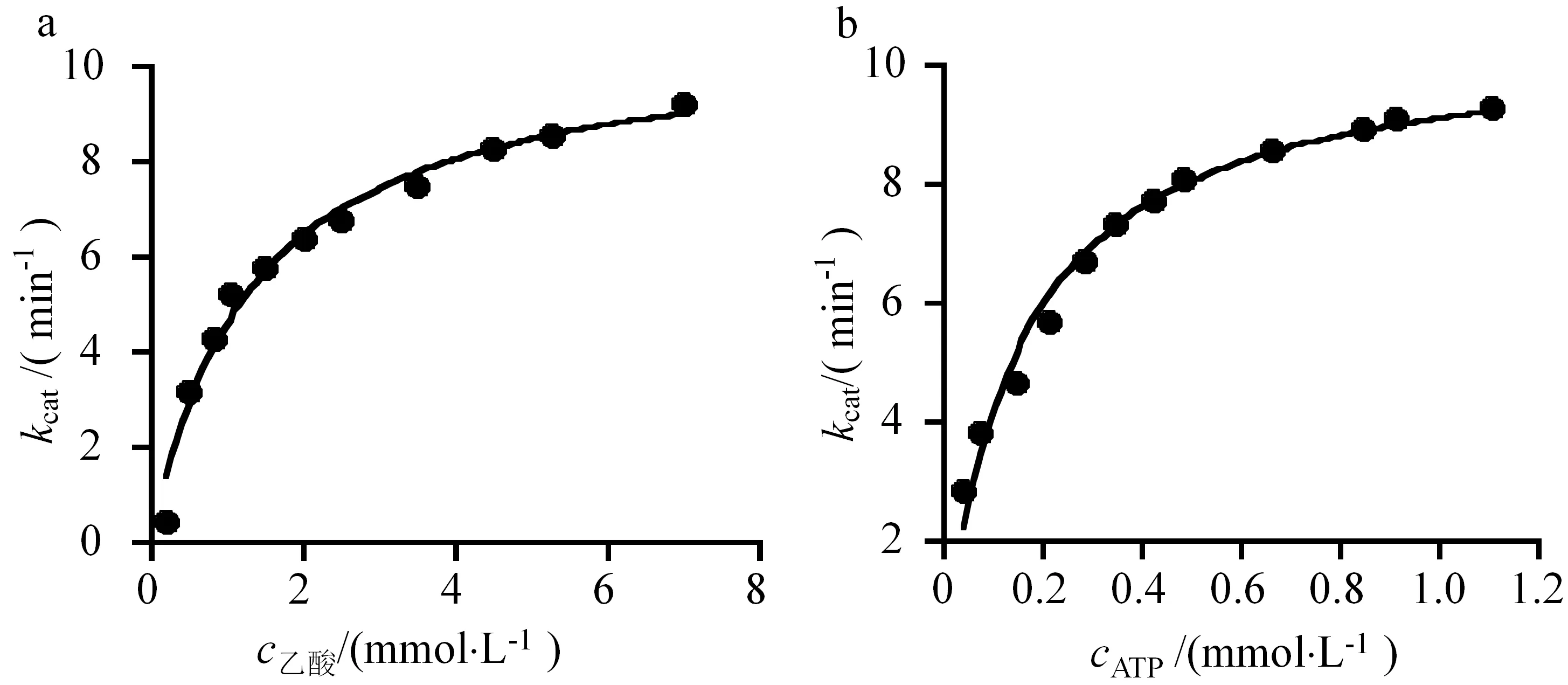
a:不同乙酸底物浓度对反应速率的影响;b:不同ATP底物浓度对反应速率的影响
3 讨 论
AdhE具有醛脱氢酶和醇脱氢酶双功能域,其醛脱氢酶结构域催化Ac-CoA还原生成乙醛,而醇脱氢酶结构域催化乙醛还原生成乙醇.本工作成功表达、纯化了大肠杆菌AdhE,并分析了该酶在有氧状态下的酶学活性为0.15 U/mg,此结果与文献[14]等报道的大肠杆菌AdhE(0.08 U/mg)、Peng等[24]报道的嗜热乙醇杆菌(Thermoanaerobacterethanolicus)AdhE(0.17 U/mg)及Chen等[25]报道的痢疾阿米巴(Entamoebahistolytica)AdhE(0.15 U/mg)的酶学活性一致.Membrillo-Hernandez等[14]报道大肠杆菌AdhE在无氧状态下的酶活为有氧状态下的10倍,而醛脱氢酶结构域内2个氨基酸残基突变(A267T,E568K)显著提高有氧状态下的AdhE酶活.在氧气存在条件下,醛脱氢酶结构域的酶活性降低成为限速步骤,致使整个AdhE的活性在有氧状态下降低.此结果与Extance等[26]报道的嗜热葡糖苷酶芽孢杆菌(Geobacillusthermoglucosidasius)AdhE的活性测定结果一致.醛醇脱氢酶在许多发酵细菌的厌氧氧化还原平衡中起关键作用,不同的发酵细菌由于不同的生命活动需要,其AdhE活性具有较大差别,并且同一种AdhE的活性在有氧与无氧状态下也有较大差距,科学家们认为这是由细菌的代谢需求和长期进化所决定的[14,22,24-28].

表2 ACS的动力学常数
ACS活性的测定方法有2种终止法和1种连续测定法.基于偶联酶的连续测定法作为酶活的测定方法被广泛运用[29],ACS的连续测定需要肌激酶、丙酮酸激酶和乳酸脱氢酶3种偶联酶测定AMP的产生速率,具有较大的延迟时间.基于AdhE的酶学特性,本研究通过偶联酶法与分光光度法联用成功连续测定ACS产物Ac-CoA的合成速率.
由于有氧条件下AdhE活性受到一定程度的抑制[30],导致酶活性较低,所以筛选、纯化氧气耐受AdhE,进一步优化基于大肠杆菌AdhE偶联酶测定体系,将为产Ac-CoA的丙酮酸脱氢酶、脂肪酸β氧化酶系、硫解酶等多种酶活测定奠定基础.

