瑞德西韦对狂犬病病毒的体外抑制作用研究
迟瑛琳,刘铮然,谢 渊,刘淑清,朱武洋
狂犬病是由狂犬病病毒(Rabies virus, RABV)引起的一种动物源性传染病,感染后发病主要表现为恐风、恐水、咽肌痉挛、进行性瘫痪等特征。因狂犬病发病而报告的死亡人数,一直位于我国法定传染病报告死亡人数的前列,作为一种可防不可治的烈性传染病,对人类健康安全有着极大的威胁[1]。随着抗病毒药物的不断创新与精进,许多病毒性疾病如乙肝、丙肝、艾滋病已得到有效控制,甚至埃博拉病毒的药物治疗也有积极的效果[2]。目前仍没有有效治疗狂犬病的疗法和抗病毒药物,狂犬病疫苗、免疫球蛋白、密尔沃基疗法[3]均不能百分百阻断病毒的感染,因此找到有效而合理的治疗狂犬病的方法成为狂犬病防治的热点之一。
瑞德西韦是一种RNA依赖的RNA聚合酶(RdRp)竞争性抑制剂,其作为一种有活性的腺苷核苷酸类似物,可在体内代谢活化为三磷酸腺苷,在病毒RNA合成的过程中与RNA聚合酶结合,插入到正在合成的病毒RNA中从而终止病毒RNA的合成,使病毒失去致病毒力[4]。实验证实瑞德西韦对严重急性呼吸综合征及中东呼吸综合征均有显著的抗病毒活性,对新型冠状病毒也具有一定的抗病毒效果[5]。因此,本实验以不同狂犬病病毒CVS-11及SC16体外感染BHK-21及N2a细胞系为实验模型,通过药物与病毒直接作用、预防性用药以及治疗性用药3种给药方式,分析瑞德西韦对不同狂犬病病毒是否具有阻断病毒吸附、抑制病毒复制或直接杀伤的作用,从而为寻找有效的狂犬病治疗药物提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 细胞和病毒 仓鼠肾细胞的克隆细胞BHK-21,小鼠神经瘤母细胞N2a由本实验室保存。细胞营养液:用Dulbecco’s MEM,GIBCO BRL配制,含100 mL/L小牛血清,10 mL/L双抗。细胞维持液:用Dulbecco’s MEM,GIBCO BRL配制,含20 mL/L小牛血清。CVS-11 是一株经典的狂犬病病毒,为CVS毒株经BHK-21 细胞适应后的固定毒株,具有较强的神经毒性,在快速荧光灶抑制试验中被用作标准攻击毒株使用,由本实验室保存;狂犬病毒街毒株SC16分离于2016年四川1只狂犬病病死犬脑内,经过鼠脑传代、适应N2a细胞生长并获得较高的滴度,由本实验室保存。
1.1.2 主要试剂和仪器 瑞德西韦购买自MCE公司,批号HY-104077。瑞德西韦储存液:将瑞德西韦用DMSO(二硝基亚砜)配成100 mmol/L的储备液,-80 ℃保存备用。DMEM 高糖培养液、胰酶、双抗、胎牛血清均购自GIBCO公司;抗狂犬病病毒核蛋白荧光抗体,购自美国Fujirebio Diagnostics公司;GoTaq probe-1-Step RT-qPCR mix 购自promega公司。细胞增殖检测试剂盒(Counting Kit,CCK8)购自东仁化学科(上海)技有限公司。倒置显微镜为日本奥林巴斯CXX4I型;荧光显微镜为日本奥林巴斯IX51型,Realtime-PCR 仪器为ABI QuantStudio 5,酶标仪为FLUOstar Omega 415-2683,细胞计数仪,购自美国ORFLO Technologies公司。
1.2 方 法
1.2.1 药物对细胞活力的毒性测定 在BHK-21和N2a细胞上加入终浓度为0(DMSO对照组)、100 μmol/L、200 μmol/L、500 μmol/L、1 000 μmol/L、2 000 μmol/L的瑞德西韦处理细胞4 h,同时设置CCK-8的对照,按照 CCK-8检测试剂盒说明书操作,用酶标仪测定在450 nm波长处的吸光度值即为OD值,通过运用OD值计算细胞存活率从而表示药物对细胞活力的影响,公式为:[(实验孔-空白孔)/(对照孔-空白孔)]×100%。
1.2.2 病毒滴度测定 将BHK-21或N2a细胞按细胞计数板计数所得的按一定比例铺在96孔板中在37 ℃、5% CO2培养箱中培养至长满单层细胞。依次将待测病毒液CVS-11及SC16分别进行10倍稀释,从10-1到10-12,将稀释好的病毒液依次加入铺好细胞的96孔板内,每孔100 μL病毒液,每个稀释度设8个重复孔。将病毒液与细胞均匀混合后放置在37 ℃、5% CO2培养箱,培养48 h后采用直接免疫荧光法进行荧光灶读数[6],最后用Reed-Muench方法计算病毒滴度[7]。
1.2.3 TaqMan实时荧光定量PCR对RABV滴度的测定 使用不同剂量的瑞德西韦按照上述要求处理不同狂犬病病毒感染的N2a细胞,收集病毒感染48 h的细胞,按照TaKaRa MiniBEST Viral RNA/DNA Extraction Kit试剂盒要求提取总RNA,测定RNA 浓度。根据GenBank上公布RV的N蛋白基因序列,利用Premiers 5.0设计一对特异性引物和TaqMan探针,引物和探针由擎科生物科技有限公司合成,引物探针序列标准品制备方法等见参考文献[8]。参照GoTaq○RProbe 1-Step RT-qPCR System试剂盒说明书反应体系和反应条件,利用狂犬病病毒TaqMan实时荧光定量PCR法检测N2a细胞中狂犬病病毒 mRNA水平。
1.2.4 瑞德西韦对狂犬病病毒吸附的阻断作用 将N2a细胞和BHK-21细胞按照 5×105/孔密度接种于 12 孔细胞培养板,Agostini ML等人研究发现瑞德西韦在非典型肺炎病毒和中东呼吸综合症病毒感染前及感染后2 h之间有最佳抑制病毒效果[9],故在N2a细胞和BHK-21细胞中分别加入终浓度为100 μmol/L、200 μmol/L、500 μmol/L、1 000 μmol/L瑞德西韦预孵育细胞2 h,加入MOI(Multiplicity of Infection)=5的CVS-11在细胞上吸附1 h,去除未吸附的病毒和药物,加入培养液,37 ℃培养48 h。采用直接免疫荧光法进行荧光灶读数,确定瑞德西韦的有效抑制浓度。由于之前已有文献报道法匹拉韦有一定的抗狂犬病病毒的效果[10],因此本实验中加入相应浓度的法匹拉韦做为阳性对照药物,并设病毒单独感染的DMSO对照组,每组3次重复实验。为探索瑞德西韦阻断狂犬病病毒吸附的效果,将N2a细胞和BHK-21细胞按照5×105/孔密度接种于 12 孔细胞培养板,使用最佳抑制浓度的瑞德西韦分别预孵育N2a细胞和BHK-21细胞2、4、6 h,加入MOI=5的CVS-11在细胞上吸附1 h,去除未吸附的病毒和药物,加入培养液,37 ℃培养48 h。采用直接免疫荧光法进行荧光灶读数,确定瑞德西韦阻断狂犬病病毒吸附的最佳时间,每组3次重复实验。为探索瑞德西韦对不同狂犬病病毒的预防性作用,本实验使用最佳抑制浓度的瑞德西韦采用最佳时间预孵育N2a细胞,加入MOI=5的街毒株SC16感染N2a细胞上吸附1 h,去除未吸附的病毒和药物,加入培养液,37 ℃培养48 h。采用直接免疫荧光法进行荧光灶读数。设病毒单独感染的DMSO对照组;同时采用TaqMan实时荧光定量PCR分别检测瑞德西韦对CVS-11及SC16 mRNA 水平的影响,确定瑞德西韦对不同狂犬病病毒的预防性作用,每组3次重复实验。
1.2.5 瑞德西韦对狂犬病毒复制的抑制作用 将N2a细胞和BHK-21细胞按照 5×105/孔密度接种于 12 孔细胞培养板,以MOI=5的CVS-11分别吸附N2a细胞和BHK-21细胞1 h后,弃去上清用DMEM洗涤3次,分别加入终浓度为100 μmol/L、200 μmol/L、500 μmol/L、1 000 μmol/L瑞德西韦处理细胞48 h后,采用直接免疫荧光法进行荧光灶读数,确定瑞德西韦的有效抑制浓度。并加入相应浓度的法匹拉韦做阳性对照药物,并设病毒单独感染的DMSO对照组,每组3次重复实验实验。为探索瑞德西韦对狂犬病毒抑制的有效时间,分别在CVS-11感染N2a细胞和BHK-21细胞1、2、3、4、6 h后,加入最适抑制浓度的瑞德西韦培养48 h后,采用直接免疫荧光法进行荧光灶读数,每组3次重复实验。为探索瑞德西韦对不同狂犬病病毒的抑制作用,将街毒株SC16感染N2a细胞,加入相应浓度的瑞德西韦培养48 h后,采用直接免疫荧光法进行荧光灶读数;同时采用TaqMan实时荧光定量PCR分别检测瑞德西韦对CVS-11及SC16 mRNA 水平的影响,确定瑞德西韦对不同狂犬病病毒的抑制作用,每组3次重复实验。
1.2.6 瑞德西韦对病毒的直接杀伤作用 将N2a细胞和BHK-21细胞按照 5×105/孔密度接种于 12 孔细胞培养板,将500 μmol/L的瑞德西韦与MOI=5的CVS-11和SC16毒株混合孵育1 h[9],将药物与病毒的混合液分别处理N2a和BHK-21细胞1 h,去除未吸附的病毒和药物,加入培养液,37 ℃培养48 h后,采用直接免疫荧光法进行荧光灶读数,确定瑞德西韦直接杀灭狂犬病病毒的浓度。
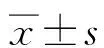
2 结 果
2.1 瑞德西韦对BHK-21及N2a细胞的毒性作用 根据CCK-8实验的细胞存活率计算公式所得出的实验结果(图1)表明,瑞德西韦在100 μmol/L、200 μmol/L、500 μmol/L内未见明显的细胞毒性作用,但在1 000 μmol/L和2 000 μmol/L的作用后,细胞折光性变差,细胞变圆,脱落,有显著的细胞毒性作用。药物对细胞的毒性作用在500 μmol/L之后随着药物浓度的增加,细胞存活率降低。故本实验选择的安全作用浓度为500 μmol/L。
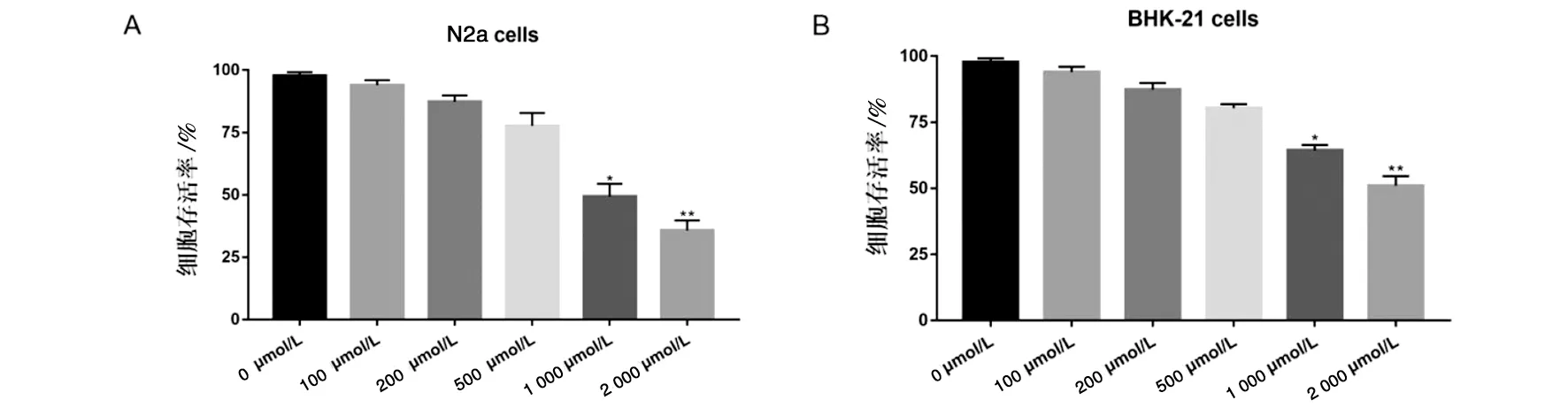
注:*为1 000 μmol/L瑞德西韦与0 μmol/L瑞德西韦相比,对N2a细胞(A)或BHK-21细胞(B)存活率差异有统计学意义(P<0.05),**为2 000 μmol/L瑞德西韦与0 μmol/L瑞德西韦相比,对N2a细胞(A)或BHK-21细胞(B)存活率差异有统计学意义(P<0.01)。图1 不同浓度瑞德西韦对N2a细胞(A)BHK-21细胞(B)存活率的影响Fig.1 Effects of different concentrations of remdesivir on cell viability in N2a(A)and BHK-21(B)
2.2 病毒的滴度测定 按Reed-Muench法计算半数感染量(TCID50),经Reed-Muench方法计算,在BHK-21细胞系感染中CVS-11的TCID50为106.56/0.1 mL,SC16的TCID50为104.19/0.1 mL,在N2a细胞系感染中CVS-11的TCID50为105.87/0.1 mL,SC16的TCID50为105.69/0.1 mL 并用细胞计数仪测定细胞数量根据MOI=病毒滴度/细胞数量计算。本实验确立CVS-11及SC16感染两种细胞系的MOI值为5。
2.3 瑞德西韦抑制狂犬病病毒的吸附作用 通过不同浓度100 μmol/L、200 μmol/L、500 μmol/L、1 000 μmol/L的瑞德西韦预处理N2a细胞后,与CVS-11病毒感染组相比,500 μmol/L和1 000 μmol/L的瑞德西韦处理组N2a细胞绿色荧光标记的病毒粒子减少(t500=43.30,t1000=60.98,均P<0.01),表明500 μmol/L及以上浓度瑞德西韦能够抑制CVS-11的感染;与相应浓度的T705阳性对照组相比,瑞德西韦处理N2a细胞中CVS-11病毒粒子的荧光强度降低(t=41.86,P<0.01)(图2);不同浓度100 μmol/L、200 μmol/L、500 μmol/L、1 000 μmol/L的瑞德西韦预处理BHK-21细胞后与上述结果基本趋于一致(图3)。介于1 000 μmol/L的瑞德西韦有明显的细胞毒性,因此后续实验使用500 μmol/L为最适药物浓度。
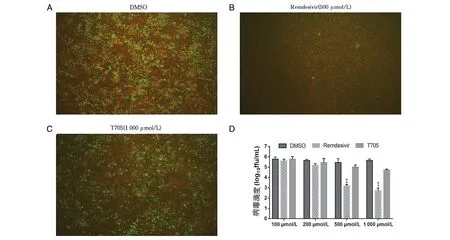
注:A. DMSO(CVS-11单独感染)组, B. 500 μmol/L瑞德西韦处理组,C. 1 000 μmol/L T705处理组,D为不同浓度瑞德西韦预处理N2a细胞对CVS-11病毒滴度的影响,500 μmol/L瑞德西韦与DMSO组相比,对CVS-11病毒感染N2a细胞的滴度差异有统计学意义,*P<0.05;1 000 μmol/L瑞德西韦与DMSO组相比,对CVS-11病毒感染N2a细胞的水平极差异有统计学意义,**P<0.01。A、B、C放大倍数:100×图2 不同浓度瑞德西韦预处理N2a细胞对CVS-11病毒吸附的影响Fig.2 Effects of remdesivir at different concentrations on CVS-11 in N2a cells

注:A. DMSO(CVS-11单独感染)组, B. 500 μmol/L瑞德西韦处理组,C. 1 000 μmol/L T705处理组,D为不同浓度瑞德西韦预处理BHK-21细胞对CVS-11病毒滴度的影响,500 μmol/L瑞德西韦与DMSO组相比,对CVS-11病毒感染BHK-21细胞的滴度差异有统计学意义,*P<0.05;1 000 μmol/L瑞德西韦与DMSO组相比,对CVS-11病毒感染BHK-21细胞的水平极差异,**P<0.01。A、B、C放大倍数:100×图3 不同浓度瑞德西韦预处理BHK-21细胞对CVS-11病毒滴度的影响Fig.3 Effects of pretreatment with remdesivir at different concentrations on CVS-11 titer in BHK-21 cells
通过500 μmol/L瑞德西韦在不同时间2、4、6 h预处理N2a细胞后,与CVS-11病毒感染组相比,瑞德西韦预孵育N2a细胞2 h后绿色荧光标记的CVS-11病毒粒子减少(t=96.38,P<0.01),随着预加药时间的延长,4 h和6 h预处理组相较之2 h预处理组对病毒滴度抑制作用无统计学差异(t4 h=1.08,t6 h=7.62,均P>0.05)(图4),瑞德西韦在不同时间预处理BHK-21细胞后与上述结果基本趋于一致(图5),因此后续实验预处理N2a细胞选择最短预处理时间2 h。
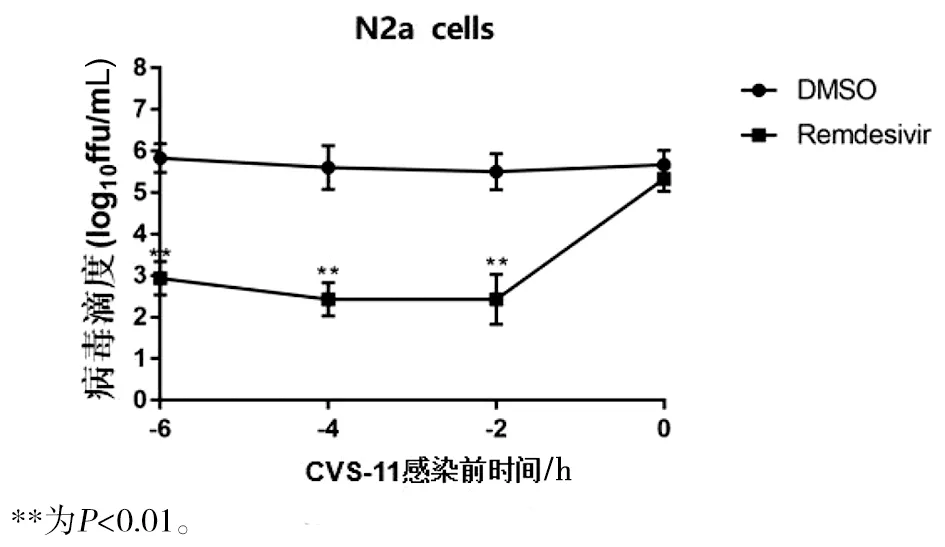
图4 瑞德西韦预处理N2a细胞不同处理时间对CVS-11病毒滴度的影响Fig.4 Effects of remdesivir with different treatment times on CVS-11 in N2a cells
通过与CVS-11和街毒株SC16病毒感染组相比,500 μmol/L瑞德西韦预处理N2a细胞2 h后病毒滴度降低(tcos-11=75.48,tsc16=47.83,均P<0.01)(图6);通过Real-time PCR检测结果显示:与CVS-11病毒感染组或SC16病毒感染组相比,500 μmol/L瑞德西韦预处理N2a细胞2 h后病毒mRNA拷贝数均降低(tcvs-11=183.82,tsc16=82.60,均P<0.01)(图7),提示瑞德西韦可以在体外有效抑制狂犬病病毒mRNA水平的表达。
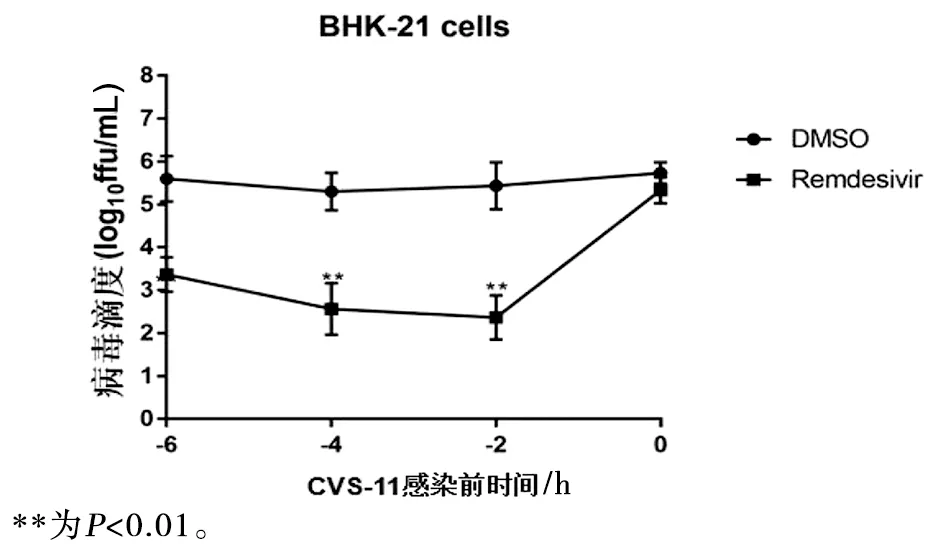
图5 瑞德西韦预处理BHK-21细胞不同处理时间对CVS-11病毒滴度的影响Fig.5 Effects of remdesivir with different times on CVS-11 in BHK-21 cells

图6 瑞德西韦预处理N2a细胞对CVS-11/SC16毒株的影响Fig.6 Effects of remdesivir on CVS-11 or SC16 in N2a cells
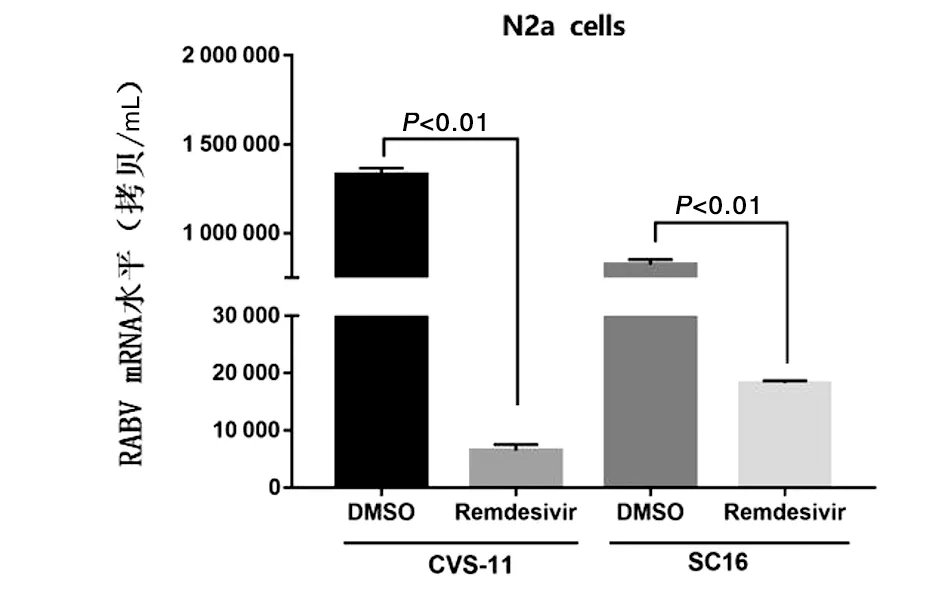
图7 瑞德西韦预加药对不同毒株mRNA水平的影响Fig.7 Effects of remdesivir on CVS-11/SC16 mRNA levels in N2a cells
2.4 瑞德西韦体外抑制狂犬病病毒的复制 与CVS-11病毒感染组相比,不同浓度100 μmol/L、200 μmol/L、500 μmol/L、1 000 μmol/L的瑞德西韦处理N2a细胞后,500 μmol/L和1 000 μmol/L的瑞德西韦处理组病毒滴度降低(t500=85.11,t1000=100.52,均P<0.01),与相应浓度的T705阳性对照组相比,瑞德西韦处理N2a细胞中CVS-11病毒粒子的荧光强度也降低(t=61.15,P<0.01)(图8),表明500 μmol/L及以上浓度瑞德西韦能够有效抑制CVS-11的复制;不同浓度100 μmol/L、200 μmol/L、500 μmol/L、1 000 μmol/L的瑞德西韦处理BHK-21细胞后与上述结果基本一致(图9)。因此后续实验使用500 μmol/L为最适药物浓度。
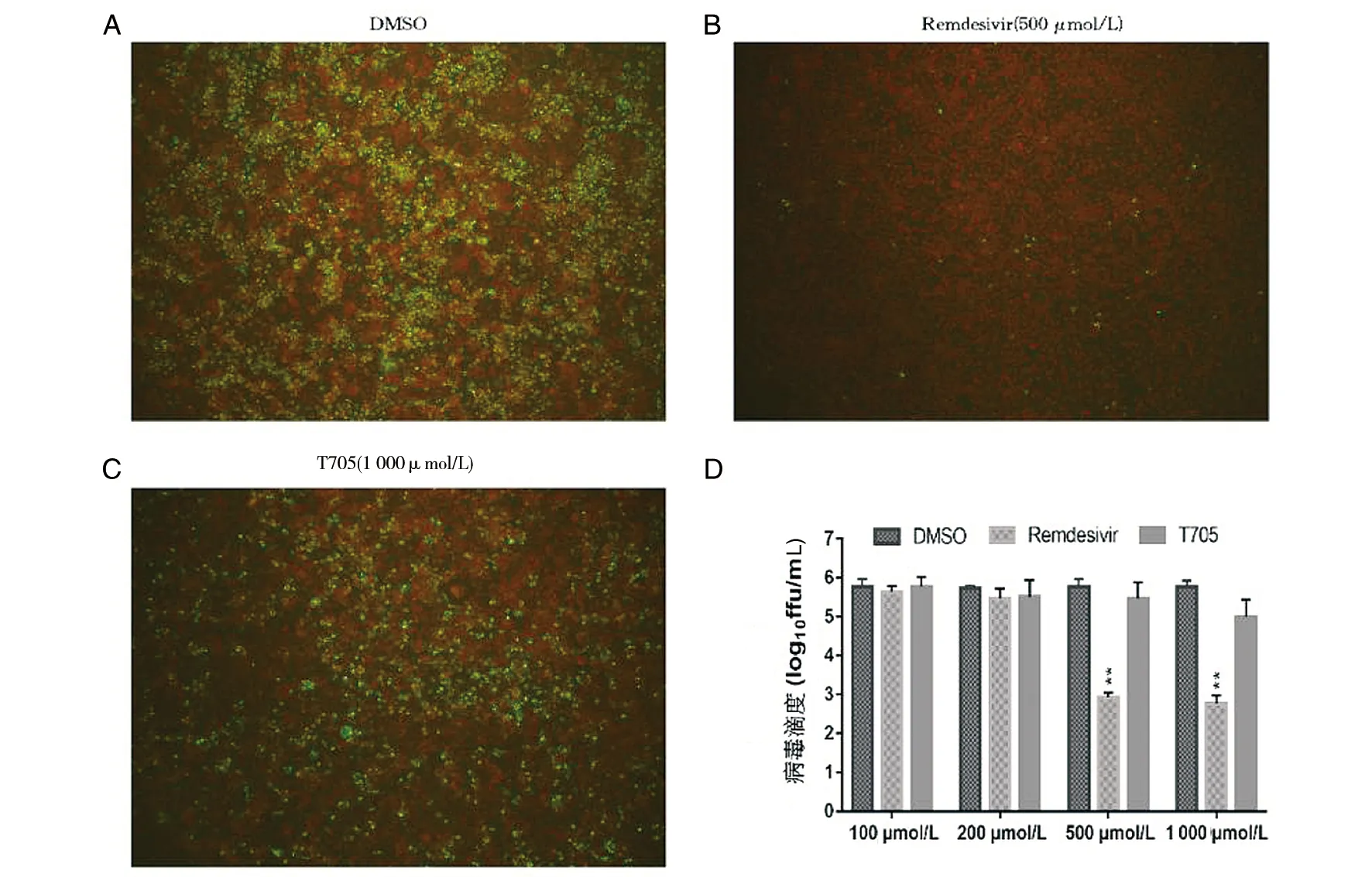
注:A. DMSO(CVS-11单独感染)组, B. 500 μmol/L瑞德西韦处理组,C. 1000 μmol/L T705处理组,D为CVS-11感染后不同浓度瑞德西韦处理N2a细胞对病毒滴度的影响。*P<0.05,**P<0.01。A、B、C放大倍数:100×图8 CVS-11感染后不同浓度瑞德西韦处理N2a细胞对病毒滴度的影响Fig.8 Effects of remdesivir at different concentrations in N2a cells after CVS-11 infection
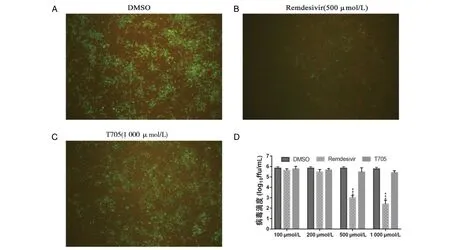
注:A. DMSO(CVS-11单独感染)组, B. 500 μmol/L瑞德西韦处理组,C. 1 000 μmol/L T705处理组,D为CVS-11感染后不同浓度瑞德西韦处理N2a细胞对病毒滴度的影响。500 μmol/L瑞德西韦与DMSO组相比,对CVS-11病毒感染BHK-21细胞的影响差异无统计学意义,*P<0.05;1 000 μmol/L瑞德西韦与DMSO组相比,对CVS-11病毒感染BHK-21细胞的影响极差异无统计学意义,**P<0.01。A、B、C放大倍数:100×图9 CVS-11感染后不同浓度瑞德西韦处理BHK-21细胞对病毒滴度的影响Fig.9 Effects of remdesivir at different concentrations in BHK-21 cells after CVS-11 infection
CVS-11病毒感染后分别在1、2、3、4、6 h加入瑞德西韦处理N2a细胞,与CVS-11病毒感染组相比,瑞德西韦在感染1、2、3、4 h后病毒滴度均下降(t1 h=44.89,t2 h=90.66,t3 h=68.07,t4 h=69.88,均P<0.01),CVS-11感染6h后加入瑞德西韦后病毒滴度有一定程度回升(t=5.09,P<0.05)(图10),CVS-11病毒感染后分别在1~4 h加入瑞德西韦处理BHK-21细胞后与上述结果趋于一致(图11)。提示CVS-11感染1~4 h内加入瑞德西韦即有较好的抑制病毒复制的效果,因此后续实验选择狂犬病毒感染1 h后加入瑞德西韦处理细胞。
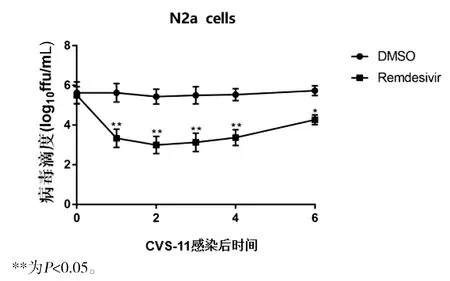
图10 CVS-11感染后不同时间瑞德西韦处理N2a细胞对病毒滴度的影响Fig.10 Effects of remdesivir treatment for different times in N2a cells after CVS-11 infection
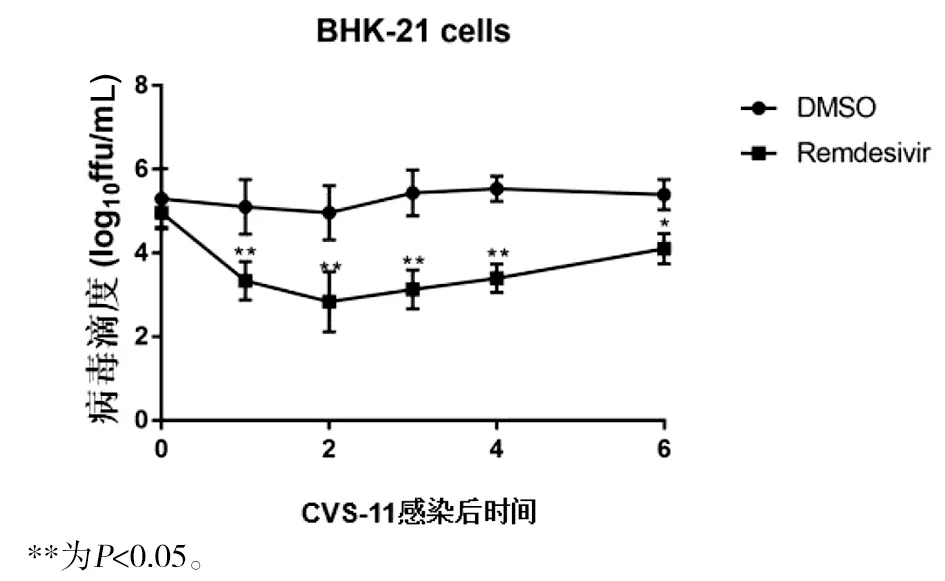
图11 CVS-11感染后不同时间瑞德西韦处理BHK-21细胞对病毒滴度的影响Fig.11 Effects of remdesivir treatment for different times in BHK-21 cells after CVS-11 infection
通过与CVS-11和街毒株SC16病毒感染组相比,500 μmol/L瑞德西韦处理N2a细胞后病毒滴度降低(tcvs-11=76.16,tsc16=90.12,均P<0.01)(图12);通过Real-time PCR检测结果显示:与CVS-11病毒感染组或SC16病毒感染组相比,500 μmol/L瑞德西韦处理N2a细胞后病毒mRNA拷贝数均降低(tcvs-11=32.55,tsc16=45.30,均P<0.01)(图13)提示瑞德西韦可以在体外有效抑制狂犬病病毒mRNA水平的复制。

图12 CVS-11/SC16感染后瑞德西韦处理N2a细胞对病毒滴度的影响Fig.12 Effects of remdesivir in N2a cells after SC16 or CVS-11 infection
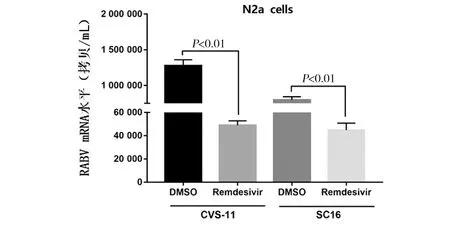
图13 不同毒株感染后瑞德西韦处理细胞对RABV mRNA水平的影响Fig.13 Effects of remdesivir on RABV mRNA levels in N2a cells after CVS-11/SC16 infection
2.5 瑞德西韦体外直接杀伤狂犬病病毒的作用 通过免疫荧光染色检测瑞德西韦对狂犬病病毒毒株CVS-11和SC16的影响,结果显示:与CVS-11单独感染组和SC16单独感染组相比, 500 μmol/L瑞德西韦处理N2a细胞后CVS-11或SC16病毒含量均无明显降低作用(图14),表明瑞德西韦对不同狂犬病病毒均无直接杀伤作用。
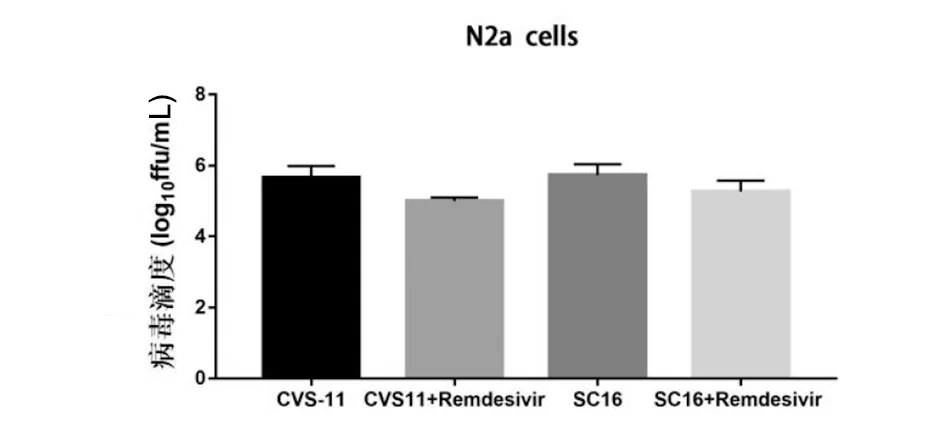
图14 瑞德西韦和不同毒株直接作用后对病毒滴度的影响Fig.14 Direct killing effect of remdesivir on CVS-11/SC16
3 讨 论
目前狂犬病在全球广泛分布,除南极洲外,所有大陆均有人间狂犬病报告。进入21世纪以后,每年约造成59 000人死亡[12],是致死人数最多的动物源性传染病。我国也是世界范围内疫情最为严重的疫区之一。由于抗病毒药物的研制起步较晚,临床上能有效地治疗病毒性疾病的药物十分匮乏,长期以来,无特异性的狂犬病病毒感染的治疗方案。广谱抗病毒药物利巴韦林是一种鸟嘌呤核苷酸类似物,在体外实验中利巴韦林浓度在6.3~50 μmol/L时有良好的抑制狂犬病病毒复制的效果[13]。但临床研究表明,长期服用利巴韦林会使白细胞水平降低,产生骨髓抑制等不良反应[14]。法匹拉韦(T705)也是一种核苷类似物的广谱抗病毒药物,它经口服后会形成嘌呤类似物会竞争病毒的RNA聚合酶。T705的核苷三磷酸化合物还会插入病毒的RNA链中导致病毒的突变,从而发挥抑制病毒的效果[15]。但是T705用量较大,毒副作用较大,在临床试验中发现肝功能障碍的患者会出现血药浓度增加和尿酸升高的情况[10],因此筛选高效低毒的抗病毒药物是今后抗病毒研究热点之一。
瑞德西韦(remdesivir,GS-5734)是Gilead Sciences公司正在研发中的一个广谱抗病毒药物[16],作为核苷类RNA 依赖的RNA 聚合酶(RdRp)竞争性抑制剂[17-18],瑞德西韦在细胞水平上能有效抑制新型冠状病毒[17-18]、冠状病毒、丙肝病毒、人类免疫缺陷病毒和埃博拉病毒等[13,16]。2020年Wit RD等人,也建立了恒河猴动物模型进一步研究发现瑞德西韦能有效抑制中东呼吸综合征冠状病毒的增殖[19]。可见瑞德西韦在抗病毒的治疗中具有极大的潜力,但目前为止,瑞德西韦在体外抑制狂犬病病毒的效果尚未明确。本实验通过使用BHK-21和N2a两种细胞系研究发现,3种不同的给药方式(方式一:预防给药;方式二:治疗给药;方式三:直接杀伤)下瑞德西韦对不同狂犬病病毒的抑制作用存在着一定差异,预防性用药及治疗性用药方式比药物与病毒直接作用的方式更好;在这两种抗病毒细胞模型中,瑞德西韦的体外抑制效果均优于T705,并在使用剂量达到500 μmol/L的情况下,未发现明显细胞损伤加重的情况。瑞德西韦通过进入宿主细胞后代谢为具有药理活性的三磷酸核苷(nucleoside triphosphate,NTP)[10,17],并通过掺入新生的病毒RNA转录物中导致其过早终止,进而抑制了RdRp 催化的RNA合成,从而抑制了病毒的复制过程,最终实现抑制病毒的繁殖[5,18],因此我们推测瑞德西韦可能主要通过影响病毒吸附细胞表面或直接杀伤细胞, 以阻断病毒的穿入,达到预防病毒感染的作用,也可以通过治疗性用药达到抑制病毒复制的效果。后续为了观察瑞德西韦对不同狂犬病病毒的体外抑制效果,模拟更接近自然感染状态下的真实情况,我们选择了街毒株SC16在神经元细胞系N2a上进行进一步的研究,结果显示瑞德西韦能够在街毒株感染时具有显著的抑制效果,在一定程度上阻断病毒吸附,抑制病毒的复制增殖,保护细胞不受病毒侵害;结果进一步表明瑞德西韦应用于狂犬病病毒体外抑制时有较好的预期效果。与此同时,瑞德西韦的临床前安全性试验显示,瑞德西韦对中枢神经系统、呼吸系统和心血管系统的风险很低,而且是非遗传毒性[20-21]。其安全性高、毒副作用小,值得临床进一步推广应用。
狂犬病作为一种可防不可治的烈性传染病,目前仍没有有效的发病后治疗药物,本研究结果表明瑞德西韦对不同毒株的狂犬病病毒均有较为理想的抑制作用,是一种潜在的抗狂犬病病毒的备选药物,为进一步的研究使用抗病毒药物对狂犬病病毒的治疗研究提供了参考价值。
利益冲突:无

