新型冠状病毒肺炎康复者恢复期血浆中多重病原体检测方法的验证
王月,张金,喻剑虹,刘莹,罗艳,张林林,郭佳茹,向阳,张雪,赵传波,彭干,陈鄂湘,何彦林,李策生,杨晓明
1.国药集团武汉血液制品有限公司,湖北 武汉 430207;2.北京天坛生物制品股份有限公司,北京 100024;3.中国生物技术股份有限公司,北京 100024
新型冠状病毒肺炎(Coronavirus Disease 2019,COVID-19)是一种由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARSCoV-2)感染引起的急性传染性疾病[1],基本传播指数 2.2 ~ 3.9[2]。COVID-19 康复者恢复期血浆治疗能够显著改善重症患者的临床症状并降低病毒载量,且安全性良好[3]。新型冠状病毒肺炎诊疗方案(试行第七版)推荐康复者血浆用于重症或危重症患者[4]。制备以康复者血浆为原料的血液制品时,必须严格检测康复者血浆的SARS-CoV-2 和各种其他感染原情况,因此,需要一种快速高效能在体外检测血浆中SARS-CoV-2和其他病原菌的质控方法。
根据《新冠肺炎康复者恢复期血浆实验室检测质量控制要求》[5],本研究对 COVID-19 康复者恢复期血浆中多种病原体的分子生物学检测方法进行系统验证,以期为COVID-19康复者恢复期血浆成功应用于临床重症患者治疗提供质量保证。
1 材料与方法
1.1 样本及菌毒株 COVID-19 康复者恢复期血浆主要由湖北省COVID-19康复者捐献;病原体阴性的人类血液样本和病原体阴性的正常人血浆样本(已知阴性样本)由国药集团武汉血液制品有限公司提供;Coriell Institute 人类基因组购自北京孚博生物科技有限公司;22 种病原体菌株、金黄色葡萄球菌、肺炎链球菌、乙型溶血性链球菌、肺炎克雷伯菌、单纯疱疹病毒、柯萨奇病毒A 型、柯萨奇病毒B 型及已知阳性样本(分别为甲型流感、百日咳鲍特菌、副流感病毒2 及冠状病毒C229E 菌液)均由上海捷诺生物科技有限公司惠赠。
1.2 主要试剂及仪器 人纤连蛋白购自赛默飞世尔科技有限公司;盐水喷鼻剂购自湖北普爱药业有限公司;保存液购自武汉瑞新昌生物科技有限公司;GN-96S 型GNCycler 多重病原微生物核酸检测系统购自上海宏石医疗科技有限公司;QIAamp®Min Elute®Virus Spin Kit 核酸提取试剂盒(批号:163052734)购自德国QIAGEN 公司;单管多重呼吸道病原体检测试剂盒(批号:RFV2020001)购自上海捷诺生物科技有限公司。
1.3 COVID-19康复者恢复期血浆中病原体检测方法
1.3.1 血浆核酸样本提取 采用核酸提取试剂盒提取血浆核酸样本,由于相比呼吸道样本,血浆样本较黏稠,将蛋白酶K 使用量增至30 μL,洗脱试剂的使用量增至 600 μL,同时取200 μL 稀释液作为阴性对照,再向血浆样本和阴性对照中分别加入5 μL RespiFinder内部质控(internal control,IC)。
1.3.2 多重病原体核酸检测 试验原理:单管多重PCR 技术结合熔解曲线,可同时检测22 种病原体。共分为两步PCR 反应:第1 步逆转录,进行多重PCR反应,该步骤的目的是富集样本中存在的靶标核酸;取第1步PCR 产物,分别进行两个独立的第2步PCR反应,该步骤扩增病原体特异引物区域,与病原体探针结合,通过熔解曲线熔解温度(melting temperature,Tm)值鉴定不同病原体。
扩增反应:第1步PCR反应:50 ℃逆转录10 min;95 ℃预变性 2 min;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 35 s,共45个循环。取第1步扩增产物5 μL,分别加入第2步两个PCR 扩增体系,95 ℃预变性2 min;94 ℃ 15 s,55 ℃ 15 s,72 ℃ 15 s,共 10 个循环;94 ℃ 15 s,50 ℃15 s,72 ℃ 15 s,共 10 个循环;95 ℃变性 2 min,40 ℃90 s熔解准备阶段,40 ~90 ℃熔解程序。
结果判读:选择正确的荧光通道(FAM/ROX/Cy5),以阴性对照作为荧光信号背景,比对不同加样孔是否出现特异峰型。
1.4 COVID-19 康复者恢复期血浆中病原体检测方法的验证
1.4.1 专属性
1.4.1.1 交叉试验 为确定本试剂盒检测多重病原体的特异性,分别向已知阳性样本和已知阴性样本混合加入其他病原体物质。使用以下7 种常见病原体进行特异性验证:金黄色葡萄球菌、肺炎链球菌、乙型溶血性链球菌、肺炎克雷伯菌、单纯疱疹病毒、柯萨奇病毒A型、柯萨奇病毒B型。
1.4.1.2 干扰试验 为了研究可能在样本处理过程中引入的或其他可能存在的干扰物质对检测的干扰性,向已知阳性样本和已知阴性样本分别加入以下物质进行干扰测试:人纤连蛋白(1%,v/v)、人类基因组DNA(300 ng)、人类血液(1%,v/v)、盐水喷鼻剂(含防腐剂)(1%,v/v)、保存液(主要为Tricine缓冲液)。
1.4.2 重复性 对该试剂盒自带的阳性对照及阴性对照,由同一检测人员进行6 次独立重复检测,确认该方法在相同检测条件下,阳性对照4 种病原体、阴性对照IC以及扩增质控(amplification quality control,AC)1和2 的Tm 值,连续多次检测所得结果之间的一致性是否符合要求。检测要求:阳性对照4种病原体Tm的相对标准偏差(relativestandard deviation,RSD)应 ≤15%,阴性对照IC及AC1、AC2 Tm值的RSD应≤15%。
1.4.3 中间精密度 确认不同检测人员、不同时间,在相同检测条件下,阳性对照4 种病原体、阴性对照IC以及AC1和AC2的Tm值,连续多次检测所得结果之间的一致性是否符合要求。检测要求:阳性对照Tm 的RSD应 ≤ 20%,阴性对照IC 及AC1、AC2 Tm 的RSD应≤20%。
1.4.4 检测限 将病原体标准菌株进行高、中、低梯度系列稀释,qRT-PCR 进行检测,每个浓度梯度重复5 次,每个浓度梯度样本阳性率需符合80%,如阳性率不符合要求,重新稀释再次进行检测,反复摸索出最低浓度水平。确定目标浓度范围后,qRT-PCR 检测重复20 次,阳性率需≥90%,最终确定目标浓度,再在此浓度水平通过数字PCR 进行滴度测试,确定最低检测限。具体流程见图1。

图1 检测限流程图Fig.1 Flow chart of LOD
1.5 方法的适用性检测 采用验证后的方法检测50份COVID-19康复者恢复期血浆样本,评估该方法用于COVID-19 康复者血浆中多重病原体核酸检测的适用性。
1.6 结果判读 不同病原体熔解温度Tm 值恒定且可预测,根据单管多重呼吸道病原体核酸检测试剂盒说明书及《新型冠状病毒肺炎康复者恢复期血浆实验室检测质量控制要求》进行判读,见表1。
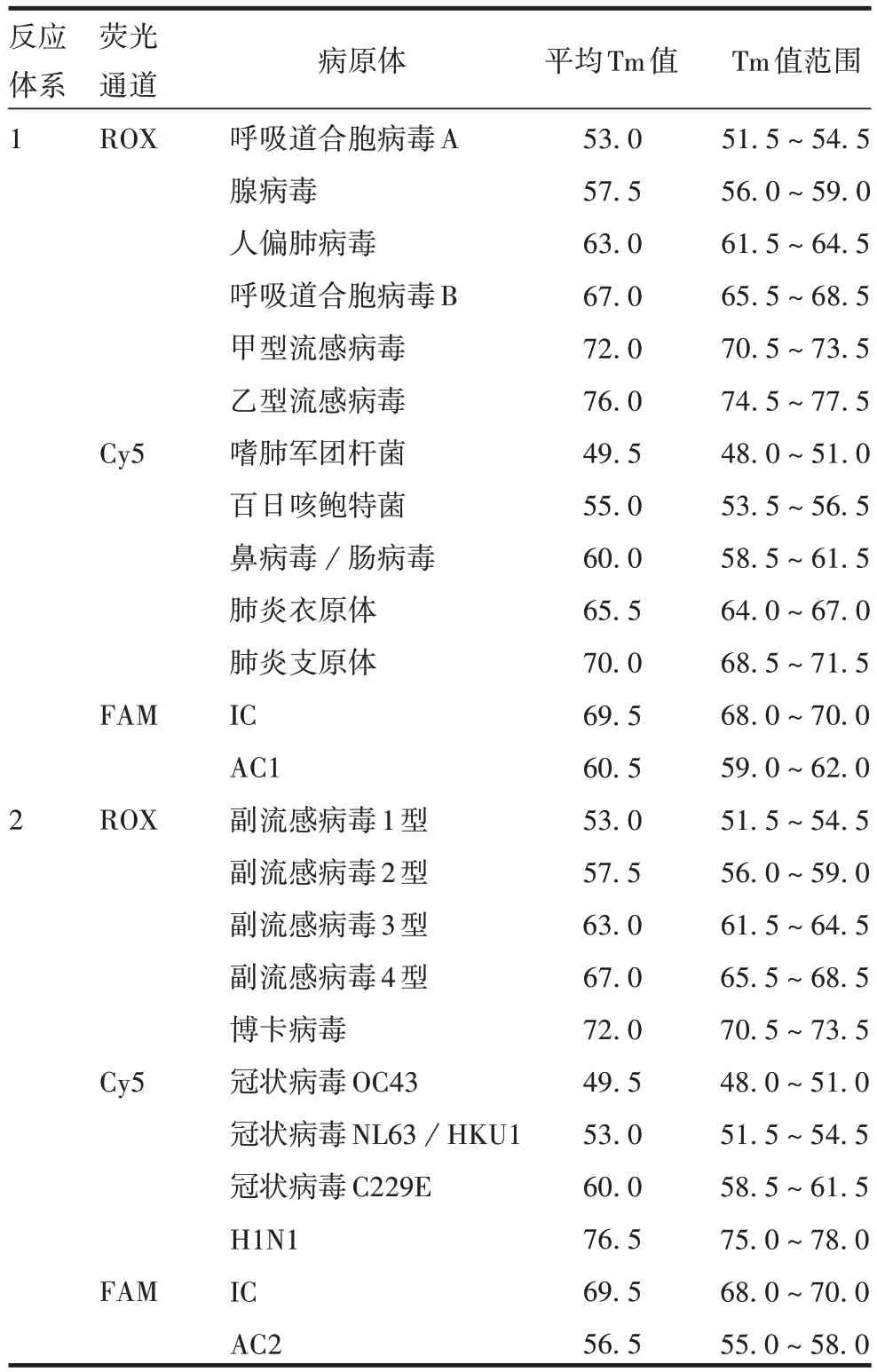
表1 病原体Tm值(℃)Tab.1 Tm values of pathogens(℃)
2 结果
2.1 方法的验证
2.1.1 专属性
2.1.1.1 交叉试验 已知阳性样本检测结果均为阳性,已知阴性样本检测结果为阴性,阳性样本和阴性样本均未检测到金黄色葡萄球菌、肺炎链球菌、乙型溶血性链球菌、肺炎克雷伯菌、单纯疱疹病毒、柯萨奇病毒A 型和柯萨奇病毒B 型,以上7种病原体均不在检测范围内,对检测无影响。
2.1.1.2 干扰试验 已知阳性样本检测结果均为阳性,已知阴性样本检测结果为阴性,人纤连蛋白(1%,v/v)、人类基因组DNA(300 ng)、人类血液(1%,v/v)、盐水喷鼻剂(含防腐剂)(1%,v/v)、保存液对检测无干扰。
2.1.2 重复性 阳性对照4 种病原体在反应体系1和反应体系 2 ROX 通道及 Cy5 通道 Tm 值的RSD分别为0.07%、0.14%、0.07%、0.14%,均 ≤15%,符合检测要求,见表2;阴性对照IC 在反应体系1 和反应体系 2 FAM 通道 Tm 值的RSD均为 0.07%,AC1 和AC2 Tm 值 的RSD分 别 为 0.01% 和 0.14%,均 ≤15%,符合检测要求,且在ROX 通道和Cy5 通道无阳性峰出现,见表3,系统对照均符合要求。

表2 阳性对照重复性试验的退火温度(℃)Tab.2 Annealing temperatures of positive control reproducibility test(℃)

表3 阴性对照重复性试验的退火温度(℃)Tab.3 Annealing temperatures of negative control reproducibility test(℃)
2.1.3 中间精密度 实验员A 和B 于不同时间进行检测,阳性对照4种病原体在反应体系1和2 ROX 通道及Cy5 通道Tm 值的RSD分别为0.20%和0.22%,阴性对照在Cy5 通道Ct的RSD为1.9%,均 ≤20%,见表4;阴性对照IC 在反应体系1 和2 FAM 通道Tm值的RSD分别为 0.11% 和 0.10%,AC1 和 AC2 Tm 值的RSD分别为0.10%和0.22%,均≤20%,见表5,以上系统对照均符合要求。
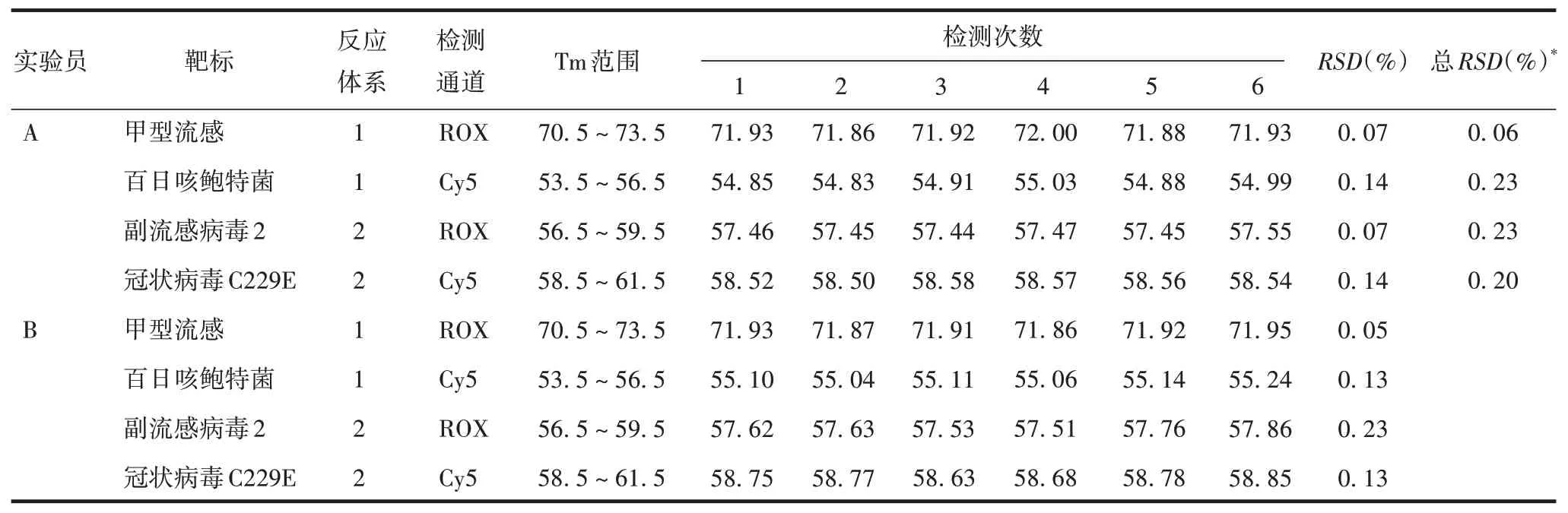
表4 阳性对照中间精密度试验的退火温度(℃)Tab.4 Annealing temperatures of positive control intermediate precision test(℃)

表5 阴性对照中间精密度试验的退火温度(℃)Tab.5 Annealing temperatures of negative control intermediate precision test(℃)
2.1.4 检测限 本方法可检测22 种病原体,各病原体的最低检测限见表6。
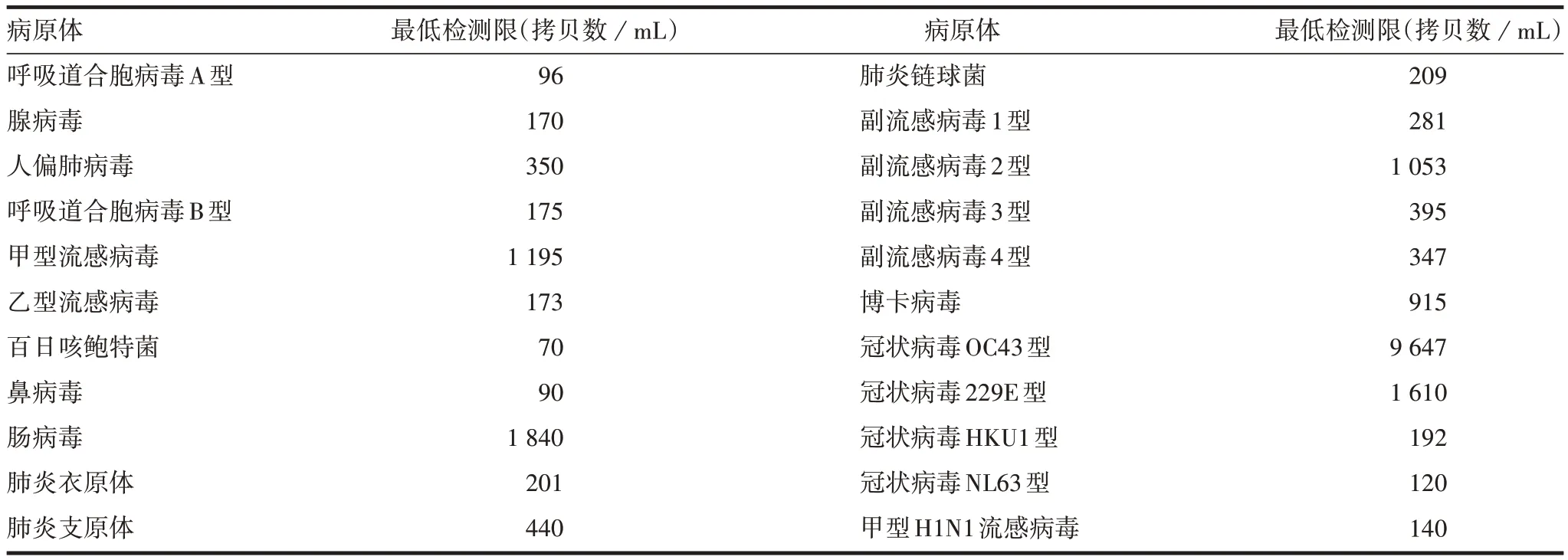
表6 22种病原体的最低检测限Tab.6 Minimum LOD of 22 pathogens
2.2 方法的适用性 50 份COVID-19 康复者恢复期血浆样本检测结果均为阴性,未出现特异峰形,未检出病原体,见图2。

图2 COVID-19康复者恢复期血浆病原体检测性能确认Fig.2 Detection performance of plasma pathogen of CPs with COVID-19
3 讨论
呼吸道感染大多由病毒感染引起[6],如常见呼吸道合胞病毒、腺病毒、流感病毒、副流感病毒、鼻病毒,此外肺炎支原体等也是常见的引起呼吸道疾病的病原体[7]。大多呼吸道病原体临床指症类似,仅根据临床症状很难做出准确的诊断,必须进行病原学诊断以明确病原体。针对呼吸道病原体有多种检测手段,包括病原体培养、酶联免疫法和血清中和试验等[8-10]。病原体培养虽有“金标准”之称,但其技术复杂、费时长,不适合用于早期诊断;酶联免疫法虽然操作简便,但其灵敏度和特异性变化较大,易出现假阳性和假阴性,以上检测手段耗时、操作难度大、无法标准化,不易广泛开展[9-10]。多重 PCR 作为一种新型的分子生物学检测技术,具有高效、快捷、特异性和灵敏度高等优点,能够同时扩增出多个核酸片段,克服了普通PCR 只能扩增一种病原体的缺点,可实现多种病原微生物同时检测[11-12]。
本研究采用多重PCR 结合熔解曲线分析不同病原体,首先第1 步PCR 富集样本中靶标核酸,第2 步PCR 扩增病原体特异引物区域,与病原体探针结合,通过熔解曲线熔解温度Tm 值鉴定不同病原体。由于血浆样本较黏稠不易提取核酸,本研究将蛋白酶K 使用量增至 30 μL,洗脱试剂增至600 μL,并结合试剂盒要求,在核酸提取阶段加入IC,可准确监控提取和PCR 抑制,当存在强感染或多重感染时,可能无IC 溶解曲线,因为大多数试剂优先与样品中核酸提取物反应。第2 步扩增反应缓冲液1 和2 中带有特异扩增质控AC1 和AC2,可有效监控第2 步PCR 反应。同时设有阳性质控、阴性质控及空白质控,可监测整个扩增过程,空白质控可检查扩增反应是否存在交叉污染及环境污染。本研究结果证实,该方法专属性强、稳定可靠、重复性好,适用于COVID-19康复者恢复期血浆中多重病原体检测。
目前临床用血或血液制品生产用原料血浆实行检疫期管理,在酶联免疫吸咐法基础上增加病毒核酸扩增法检测血浆样本HIV、HBV 和HCV,时限为自血浆采集之日起不少于60 d,核酸检测(nucleic acid testing,NAT)比ELISA 检测平均缩短9 d(20%)、59 d(80%)、11 d(50%),可显著缩短HIV、HBV和HCV的血清学检测窗口期[13],同时能有效检出病毒抗体或抗原检测阴性的慢性或隐匿携带者,免疫静默以及变异株病毒感染者,从而降低血液制品病毒污染的风险[14]。血液和血液制品常作为药物来拯救生命,除了血液常规筛查的4种病原体(HIV、HBV、HCV 和梅毒)外,在合格的血浆中仍可能存在其他病原体残余威胁血液安全,并可能通过输血传播疾病,如细小病毒 B19[15]、HAV[16]、HEV[17]、人巨细胞病毒[18]、单纯性疱疹病毒[19]以及登革热病毒[20]等,目前,《中国药典》三部(2020 版)未将以上病原体纳入生产用人血浆常规筛查项目[21],《欧洲药典》规定合并血浆需进行HAV 及细小病毒B19 检测,且细小病毒含量不得高于10.0 IU/μL[22]。基于我国献血浆者与血液制品安全性的系统研究,鼓励相关企业及科研机构尽快开发B19 DNA 检测的商业化血源性筛查试剂,在此基础上参照国外的风险控制策略,逐步建立和完善我国相关技术要求,以最大限度地降低和消除血液制品B19以及其他相关病毒污染及传播风险。
本研究中COVID-19 康复者恢复期血浆在常规血浆筛查酶联免疫吸附法和核酸检测的基础上,同时进行新冠病毒核酸检测[23-24]以及22种呼吸道病原体筛查,可有效排除常规血液传播疾病的感染,以及新冠病毒和呼吸道病原体感染的风险,充分保证COVID-19 康复者恢复期血浆的安全性,为COVID-19康复者恢复期血浆用于临床重症或危重症患者治疗提供质量保证。多重PCR 结合熔解曲线分析病原体,具有较高的检测特异性及灵敏度,检测通量高,可充分满足COVID-19 康复者恢复期血浆的质控要求[15]。多重PCR 技术与环介导等温扩增技术(loopmediated isothermal amplification,LAMP)[25]、基因芯片[26]等实验技术结合,可进一步提高病原体检测的灵敏性、可重复性,实现高通量病原体检测、混合感染多种微生物的准确检测,可为临床病原体鉴别诊断、基因分型、血液筛查及血液制品质量监控等领域的研究提供新的思路,具有较大发展前景。
志谢诚挚感谢上海捷诺生物科技有限公司提供技术指导

