鲍曼不动杆菌致病机制及相应疫苗的研究现状
马源 综述,宋磊,罗招庆 审校
吉林大学第一医院呼吸内科与感染与免疫中心,吉林 长春 130021
鲍曼不动杆菌是一种革兰阴性菌,是引起医院内感染的重要条件致病菌之一[1-2],主要感染肺等多种人体器官[3],最终引起菌血症、肺炎等疾病,严重威胁患者生命,免疫力较弱的人群,尤其患有严重呼吸道疾病需气管插管及肿瘤化疗的患者,更易感染该菌[4]。目前,鲍曼不动杆菌对抗生素已产生广泛耐受性,普通抗生素难以清除临床流行的菌株,迄今为止,全球仅有南极洲未分离出多重耐药的鲍曼不动杆菌。在已分离获得的鲍曼不动杆菌菌株中,碳氢霉烯类药物耐受菌株位列世界卫生组织“新型抗生素研发重点病原体清单”的首位[5],疫苗接种是预防该菌感染的主要措施。本文就鲍曼不动杆菌的致病机制和相应疫苗的研究现状作一综述,以期为该菌及新型疫苗的研究提供参考。
1 鲍曼不动杆菌的致病机制
鲍曼不动杆菌的致病过程主要包括菌体与宿主细胞黏附、生物膜的形成及菌体定殖。与许多病原体相似,鲍曼不动杆菌能产生大量包围外膜的荚膜多糖(capsular polysaccharide,CPS)[6],并形成黏液,对该菌的黏附起关键作用。有研究在鲍曼不动杆菌中发现,双组分离调节系统BfmRS 可影响CPS 的形成[7-9],还可控制 CPS 产生基因的 K 位点及菌毛产生csuA/BABCDE 操纵子的表达[10]。BfmRS 突变体(ΔbfmR)可过量产生CPS,具有更强毒性[11]。CPS 输出蛋白(Wza)与耐碳青霉烯类抗生素鲍曼不动杆菌的毒力及荚膜的形成密切相关。研究表明,wza基因敲除可影响荚膜聚合酶Wzy 依赖的CPS 合成途径,导致CPS 的组装、输出和胞外固定受阻,从而产生协同效应,降低该菌的毒性[12-13]。
生物膜是微生物细胞在多种生理环境因素影响下黏附于生物或非生物表面形成的三维结构[14],其形成导致细菌的耐药性、致病性升高,慢性感染、反复感染率增加[15]。临床上65%~80%的细菌感染性疾病与生物膜形成有关,但形成生物膜的细菌对抗菌药物耐药性通常是游离菌的10~1 000倍,这也是抗菌药物治疗细菌感染失效的主要原因[16]。生物膜的形成和发展包括4 个主要步骤:细菌可逆性黏附定殖、细菌不可逆性黏附集聚、生物膜成熟及细菌的脱落与再定殖。当浮游细菌与惰性物体表面或活性实体的表面接触后,会黏附至物体表面,启动形成生物膜过程,在该阶段,单个附着细胞仅由少量胞外聚合物包裹,未进入生物膜的形成过程,多数菌体还可重新进入浮游状态,因此,此时细菌的黏附是可逆的。细菌经过初步定殖黏附后,激活与形成生物膜相关的基因,细菌在生长繁殖的同时分泌大量胞外聚合物黏结细菌,在该阶段,细菌对物体表面的黏附更牢固,是不可逆的。随后生物膜的形成逐渐进入成熟期,形成高度有组织的结构,由类似蘑菇状或堆状的微菌落组成,在这些微菌落之间存在大量通道,可运送养料、酶、代谢产物等。成熟的生物膜通过蔓延、部分脱落或释放出浮游细菌进行扩展,脱落或释放出来的细菌重新变为浮游菌,在物体表面形成新的生物膜[17]。
与其他菌种比较,鲍曼不动杆菌的生物膜形成率为80%~91%,其他菌种为5%~24%[18]。生物膜保护鲍曼不动杆菌免受抗生素、噬菌体的作用,协助其在恶劣条件下存活[19-20],该菌借助生物膜黏附于医疗设施上,使其在医院环境中持续存在,导致院内感染[21]。鲍曼不动杆菌分离株的生物膜由菌体、细菌分泌的黏性物质和CPS 组成,其形成通常与金属离子、质粒、转座子、整合子和外膜蛋白等表达基因的上调有关[22],相关基因作用见表1[23-31]。黏附性是形成生物膜的第一步,菌毛有助于鲍曼不动杆菌在任何非生物表面形成生物膜[32],有研究表明,鲍曼不动杆菌相关的多聚β-1,6-乙酰葡萄糖胺(polymerization β-1,6-acetylglucosamine,PNAG)、分子伴侣/分子引导分泌(molecular chaperone system,CUS)系统和群体感应(quorum sensing,QS)等也与生物膜的形成密切相关[33-35]。

表1 生物膜相关基因及其功能Tab.1 Biofilm related genes and their functions
由于多重耐药鲍曼不动杆菌不断增多[36],抗生素的有效性越来越差,更加凸显开发新型防治手段的重要性。接种疫苗在防治鲍曼不动感染中发挥关键作用。在该菌致病过程中涉及多种物质(如CPS、蛋白质及相关基因)的参与,以这些组分为靶点制备相应疫苗(如OmpA、Bap 疫苗),通过降低细菌黏附和生物膜的形成,进而阻断或减弱鲍曼不动杆菌的感染,以达到预防和治疗的目的。
2 鲍曼不动杆菌疫苗的研发现状
疫苗是预防病原体感染的重要手段,可分为灭活疫苗、减毒活疫苗、亚单位疫苗、活载体疫苗、核酸疫苗、植物疫苗等。目前,鲍曼不动杆菌疫苗集中于灭活全菌体疫苗、DNA疫苗、重组亚单位疫苗及荚膜多糖疫苗等研究,尚无疫苗进入临床试验阶段。且现有疫苗存在周期长、免疫原性弱、安全性低等缺点,急需开发新型疫苗用于防治鲍曼不动杆菌感染。
2.1 灭活全菌体疫苗 鲍曼不动杆菌灭活全菌体(inactivated whole cell,IWC)疫苗是指将培养的鲍曼不动杆菌灭活后,保留具有抗原性的菌体作为主要成分的疫苗,灭活方式主要有加热、辐射、暴露于抗生素等。加热灭菌操作简单、价格便宜;辐射灭菌更彻底,可提高疫苗安全性;暴露于抗生素法更倾向于清除多重耐药菌。IWC 疫苗可预防由不同鲍曼不动杆菌菌株引起的致命脓毒症,如扩展耐药率(extended drug resistance rate,XDR)菌株,其7 d存活率为80%~100%,且IgG、IgG1、IgG2a和IgM水平显著升高,刺激了Th1/Th2 介导的混合反应[37-41]。这些蛋白具有中和、清除病原微生物的作用,从而减少对机体的损伤,增强抵抗作用。滴鼻免疫、皮下注射、腹腔注射同样能起到以上效果,滴鼻免疫起效更快;腹腔注射免疫操作简便;皮下注射免疫机体吸收较快且产生抗体含量高。但IWC 疫苗免疫原性较弱,且灭菌不完全时可能会对机体造成危害,与其他类型疫苗比较,该疫苗免疫效果较差。
2.2 减毒活疫苗 减毒活疫苗是人工诱变或从自然界筛选出毒力降低或无毒的活病原微生物制成的疫苗。免疫力较弱的人群是大多数鲍曼不动杆菌的易感人群,因此使用减毒活疫苗存在潜在的安全风险。目前,已研发出一种具有TrxA黏附素缺陷的减毒多重耐药菌株疫苗,经小鼠腹腔或皮下免疫4周后,存活率≥90%[42]。与灭活疫苗比较,减毒活疫苗诱导免疫反应强,但有可能发生逆行突变,在人体内恢复毒力[43],其安全性有待探索。
2.3 外膜蛋白疫苗 鲍曼不动杆菌外膜蛋白疫苗主要有外膜复合物(outer membrane complex,OMC)疫苗和外膜囊泡(outer membrane vesicles,OMVs)疫苗。从鲍曼不动杆菌ATCC 19606 中提取的OMC 可有效诱导小鼠产生体液和细胞免疫,小鼠感染后的生存率≥80%,可对抗不同鲍曼不动杆菌分离株的感染,且用OMC疫苗免疫的血清可清除鲍曼不动杆菌(恢复率为70%~100%)[44],但血清制剂成分复杂且不明确,安全性较低。自B群脑膜炎球菌疫苗Bexsero®(一种基于OMVs的产品)获得批准以来,OMVs疫苗引起人们的重视[45],其提供了更广泛的抗原,包括OMC和其他膜相关蛋白。通过优化生物工程设计、分离、脂寡糖脱毒,OMVs可发展成安全有效、成本效益高的细菌疫 苗[46-47]。鲍曼不动杆菌 ATCC 19606 产生的天然OMVs免疫小鼠非常有效,在异种菌株感染后,免疫小鼠的存活率为90%,基质辅助激光解吸/电离飞行时间质谱(matrix-assisted laser desorption/ionization timeof-flight mass spectrometry,MALDI-TOF MS)分析确定了OMVs 中具有高免疫原性蛋白质,包括OmpA、OmpW、CarO[45]。HUANG 等[48]将大肠埃希菌衍生的OMVs 包装融合了外源性鲍曼不动杆菌Omp22 蛋白和成孔溶血蛋白ClyA,用其免疫小鼠的存活率≥60%,且无需佐剂;接种未经修饰大肠埃希菌OMVs的小鼠存活率仅为35.0%~63.6%,表明大肠埃希菌衍生的OMVs对鲍曼杆菌感染具有交叉免疫作用。
2.4 重组亚单位疫苗 大分子抗原携带多种特异性抗原决定簇中,仅有少量抗原部位对保护性免疫应答起作用。亚单位疫苗是将致病菌主要保护性免疫原组分进行提纯、组装,筛选出具有免疫活性片段制成的,因此也叫组分疫苗[49]。2010年以来,发现了多种鲍曼不动杆菌新型毒力因子及其分子相互作用,作为黏附素或侵入素的外膜免疫原蛋白是亚单位疫苗开发的主要目标,可阻断细菌与宿主细胞受体的黏附和定植,达到有效预防细菌感染的目的。该疫苗最可能的候选亚单位是OmpA,OmpA 参与了鲍曼不动杆菌黏附、细胞毒性和生物膜形成等过程,在动物模型中具有高度免疫原性。OmpA的氨基酸序列与人类蛋白质组无同源性,但变异较小(≥89%保守),表明鲍曼不动杆菌OmpA不可能与其他含有OmpA的共生细菌相互干扰,从而将潜在副作用降至最低[24]。研究表明,用OmpA疫苗进行主动免疫可对鲍曼不动杆菌产生预防作用。小鼠经鼻内免疫与霍乱毒素结合的重组OmpA(rOmpA)15 d后,存活率为40%~100%,对照组在2 d内全部死亡[50]。LUO等[51]研究发现,抗原剂量会影响免疫应答水平,低剂量(3 μg)rOmpA免疫小鼠表现出平衡的IFNγ和IL-4免疫应答,而接受高剂量(100 μg)免疫的小鼠表现出Th2极化反应。
随着生物信息学发展,不断发现一些新的蛋白亚单位,其理化性质及结构逐渐清晰,在免疫学实验中能起到不同的免疫作用,成为研制蛋白亚单位疫苗的理想抗原。有研究表明,Bap、Ata、DcaP、BfnH、BauA、OmpK/Omp22 重组蛋白疫苗均能引起保护性免疫[52-56]。亚单位疫苗通常仅由几种主要表面蛋白组成,避免产生不需要的抗体,减少疫苗的副反应。与全病毒疫苗比较,亚单位疫苗安全性更高,稳定性更好,免疫更具持久性[57]。亚单位疫苗可以大肠埃希菌、杆状病毒、毕赤酵母为载体,实现规模化生产[58],但其免疫原性较低,需与佐剂联合使用。
2.5 多糖疫苗 CPS在鲍曼不动杆菌的黏附、致病过程中起着重要作用[59-60]。CPS 可通过提取、生物合成、化学合成等方法获得。RUDENKO 等[61]通过高碘酸盐氧化法合成了3 种惰性载体蛋白与鲍曼不动杆菌K9 型CPS 片段的结合物,用不含佐剂的糖结合物免疫BALB/c 和ICR-1 小鼠,发现两种小鼠免疫应答情况有差异,前者激活了IFNγ 途径,后者不产生IL-4,表明刺激产生了Th1 型适应性免疫应答。TNF-α是一种具有广泛活性的促炎细胞因子,与IFNγ结合可显著增强吞噬细胞的杀菌能力。因此,该多糖复合物免疫ICR-1小鼠可诱导Th1型适应性免疫应答,而免疫BALB/c小鼠可能会增强其吞噬细胞的杀菌能力。在RUSSO 等[62]研究中发现,免疫小鼠的血清能够增强巨噬细胞吞噬细菌的能力。CPS 疫苗能增强巨噬细胞的吞噬作用,但抗原性和保守性欠佳,仅适用于特定菌株,随着耐药菌株的增加,以CPS 为靶点的被动免疫可用于治疗耐药菌株的感染[63]。
2.6 核酸疫苗 核酸疫苗又称DNA 疫苗,是将一种或多种目的抗原的编码基因克隆至真核质粒表达载体上,再将重组质粒直接注入体内,在宿主细胞内表达目的蛋白,诱发特异性免疫应答。有研究将重组质粒pBudCE4.1-ompA、pEGFP-C2-nlpA、pVAX1-ompA-pal 免疫小鼠后,其血清中的促炎因子和抗体水平均升高,表明该疫苗能有效触发体液和细胞免疫应答。用不低于5 × 108CFU 感染剂量的细菌免疫小鼠后,各剂量组均有小鼠存活,即该疫苗能引起保护性免疫[64-66]。核酸疫苗构建简单、生产方便、表达稳定、可诱发全面的免疫应答[67-68],在抗感染、抗肿瘤免疫及疾病的预防中具有广阔应用前景。局部注射DNA疫苗可被周围细胞摄取,进入核内转录,在细胞质中翻译成目的蛋白,再通过细胞分泌或细胞破裂的方式进入组织间激活B 淋巴细胞产生抗体。传统免疫所使用的抗原一般是灭活病原体、减毒活病原体或病原体的亚单位蛋白,核酸疫苗仅是病原体某种抗原的基因片段,可提供与天然构象极为接近的目的蛋白给宿主免疫系统,与自然感染过程相似[69]。核酸疫苗兼有良好的安全性和高效力诱导全方位免疫应答,其不仅能预防疾病,还可作为治疗性疫苗治疗病毒性肝炎、癌症等[70]。针对流感、乙型肝炎、艾滋病、疟疾和癌症DNA 疫苗的试验结果表明,核酸疫苗在早期阶段效果较好,在小鼠模型中可诱导出强烈的免疫反应,但在人体内效果不佳[71]。且该疫苗存在一定风险,质粒DNA 可能整合至细胞DNA 中,打开原癌基因,关闭抑癌基因,或诱发染色体不稳定。
鲍曼不动杆菌候选疫苗的主动免疫研究结果见表2和表3。

表2 鲍曼不动杆菌候选疫苗的主动免疫日程Tab.2 Active immunization schedule for candidate vaccine of Acinetobacter baumannii
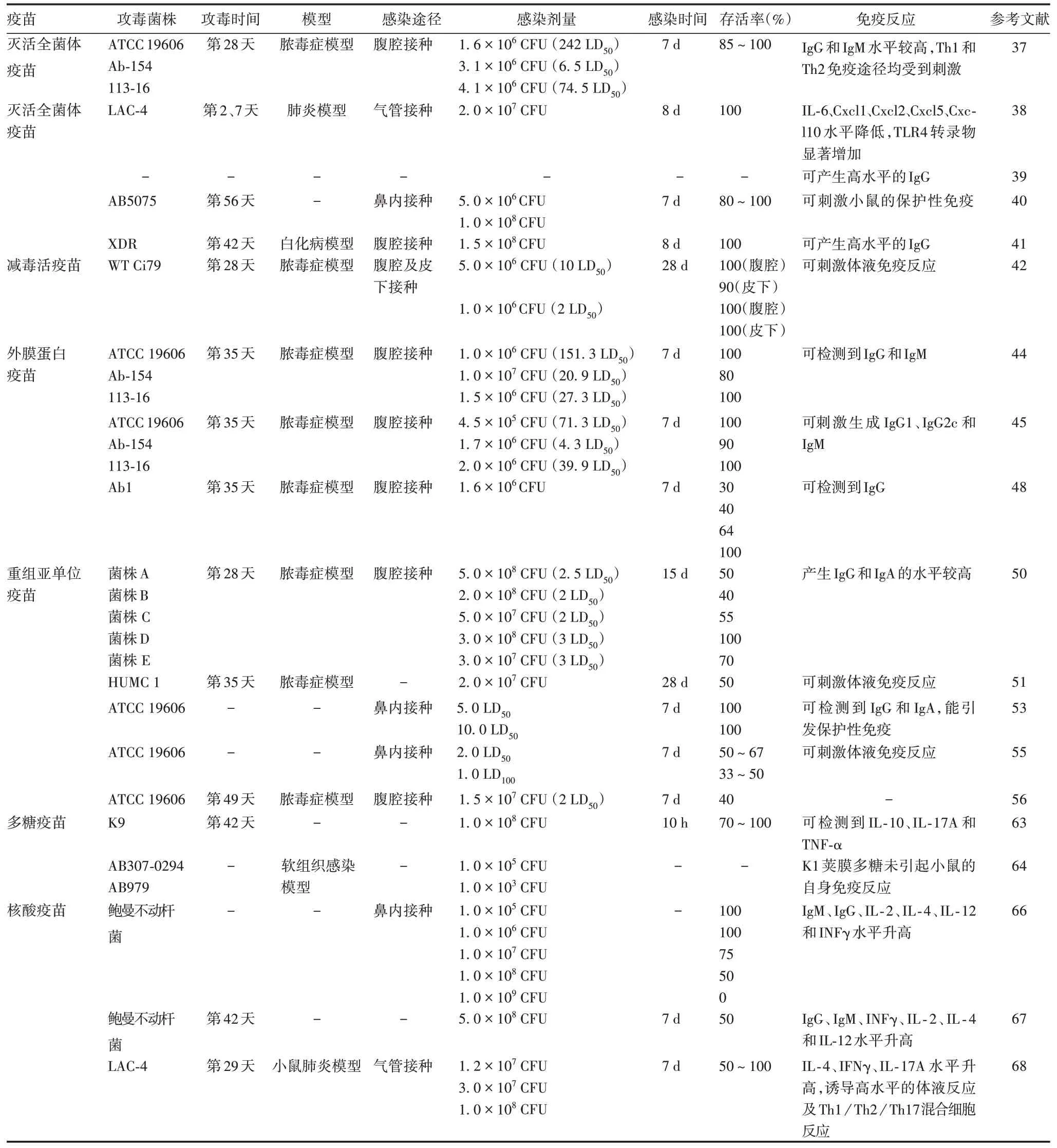
表3 鲍曼不动杆菌候选疫苗的免疫效果Tab.3 Effect of candidate vaccine of Acinetobacter baumannii
3 小结与展望
多重耐药性菌株的不断增多使抗生素的研制越发困难,疫苗研制显得十分重要。疫苗研制主要侧重于病原体致病机理的研究,目前,重组免疫策略针对单个或多个外膜蛋白,这些蛋白易于制备且安全性高,与其他形式的疫苗比较,病原体回复突变的风险较低。在设计重组亚单位疫苗时,只需选择在特定菌株中的已知蛋白,采用PCR 法检验临床分离物中的蛋白,应用在线软件分析基因组和蛋白质组信息。鲍曼不动杆菌菌株经完全和部分测序选出较多保守性蛋白,评估这些候选菌株疫苗的潜力,确定鲍曼不动杆菌感染或免疫诱导的特定宿主免疫途径,将有助于发现潜在的免疫保护候选蛋白。
目前,大多数鲍曼不动杆菌候选疫苗的研制均基于蛋白质技术。考虑到鲍曼不动杆菌是一种侵袭性病原体,Th2极化反应可能不足以提供有效和长期的保护,混合的Th1/Th2 或Th1/Th17 反应可能更有益。佐剂的开发可针对多种抗原,最终将提供覆盖面广、临床疗效好的疫苗[72-74]。另外,反向疫苗接种是一种利用大量生物信息数据预测潜在候选疫苗的便捷方法[75]。鲍曼不动杆菌耐药性、多样性、疫苗接种和动物感染模型的研发这有助于提高各种鲍曼不动菌疫苗的有效性。

