鸭坦布苏病毒E 蛋白及其结构域I、II、III 对DEF 细胞周期与凋亡的影响
汪婷 汪威 徐欢 殷世彬 孙敏华 江心月 徐静 汪招雄

摘要: 【目的】探究鸭坦布苏病毒(Duck Tambusu virus,DTMUV) E 蛋白全长及其结构域I、II 和III (DI、DII 和DIII) 对鸭胚成纤维细胞(Duck embryo fibroblast,DEF) 的细胞周期与凋亡的影响。【方法】本研究设计、合成DTMUV E 蛋白全长及其DI、DII 和DIII 真核表达质粒,并转染至DEF,用流式细胞仪检测不同蛋白引起的DEF 细胞凋亡和细胞周期的变化。【结果】细胞凋亡结果显示:质粒转染细胞24 h 后,E 蛋白全长及DI、DII、DIII 诱导的DEF 早期凋亡率分别是16.4%、15.1%、14.0% 和17.2%;质粒转染细胞36 h 后,E 蛋白全长及DI、DII、DIII 诱导的DEF 早期凋亡率分别是23.4%、18.5%、26.7% 和29.4%。细胞周期检测结果显示:E 蛋白全长及DI、DII、DIII 的质粒转染细胞24、36 h 后,DNA 合成期(S 期) 细胞比例都明显高于pEGFP-N1 空载体转染组。质粒转染24 h 后,E 蛋白及DI、DII、DIII 的S 期细胞比例分别为5.43%、22.58%、12.75% 和12.80%;质粒转染细胞36 h 后,E 蛋白及DI、DII、DIII 的S 期细胞比例分别为9.98%、11.44%、10.44% 和11.00%。【结论】DTMUV E 蛋白全长及其3 个结构域均能诱导早期细胞凋亡,引起细胞S 期的停滞,但是各蛋白片段诱导细胞凋亡和引起细胞周期变化的能力存在一定差异。
关键词: 鸭坦布苏病毒;E 蛋白;结构域;细胞周期;细胞凋亡
中图分类号: S852文献标志码: A 文章编号: 1001-411X(2023)02-0205-07
鸭坦布苏病毒( D u c k T e m b u s u v i r u s ,DTMUV) 是黄病毒科黄病毒属恩塔亚病毒群的一种新型黄病毒,可引起雏鸭腹泻和神经症状,蛋鸭卵巢出血坏死、产蛋量急剧下降,严重者出现死亡[1]。近年来有研究报道,该病的感染宿主已扩大至麻雀、鹅、鸽子等多种禽类[2]。该病毒的开放性阅读框(Open reading frame, ORF) 编码产生1 个3 425 个氨基酸长度的多肽,在宿主和病毒蛋白酶的作用下,可水解为C、prM、E 结构蛋白和NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5 非结构蛋白[3]。
E 蛋白是D T M UV 的外膜蛋白,包含大约501 个氨基酸残基,由1 503 个核苷酸残基构成,相对分子质量为54 200[4]。其参与病毒的细胞膜融合和穿入,能刺激机体产生保护性的中和抗体,是主要的免疫原性蛋白[5]。E 蛋白空间结构多数为β?折叠,并形成3 个不同的空间结构域?Domain I、Domain II 和Domain III,分别简称DI、DII 和DIII[6]。其中,DI 位于包膜蛋白的中部,通过柔性铰链连接DII[ 7 ] ,DI 中的糖基化位点与病毒产生、pH 敏感性和神经侵袭性有关[ 8 ]。DII 由2 个从DI 循环中投射出来的片段组成,折叠成指状结构,含有高度保守的疏水性顶端的融合环,称为融合肽(Fusion peptide,FP)。当融合形成构象时,融合肽负责与靶膜的直接相互作用[ 9 ]。具有免疫球蛋白IgG 样结构的E 蛋白DIII 位于融合E 蛋白羧基端,只有1 个二硫键影响E 蛋白抗原结构正确性,该区包含众多抗原表位,在病毒结合细胞受体并入侵细胞机制中具有重要作用,是临床诊断和亚单位疫苗制备的重要靶候选区域[10]。近年来研究表明,E 蛋白是病毒的主要毒力抗原,它参与病毒的许多复制过程;此外,其所含的大量抗原表位与病毒入侵宿主细胞以及病毒致病性密切相关[ 1 1 ]。而目前对DTMUV E 蛋白DI、DII 和DIII 功能的研究较少。
本研究旨在探讨E 基因DI、DII 和DIII 真核表达产物对鸭胚成纤维细胞(Duck embryo fibroblast,DEF) 细胞周期与细胞凋亡的影响,为E 蛋白DI、DII 和DIII 的功能研究奠定基础。
1 材料与方法
1.1 材料与试剂
pEGFP-N1 真核表达质粒由长江大学动物科学学院禽病实验室保存;DMEM 培养基、Lipo2000 脂质体转染试剂、Opti-MEM 培养基均购于ThermoFisher Scientific 公司;Annexin V-FITC/PI 双染细胞凋亡试剂盒和细胞周期检测试剂盒购于Biosharp公司。
1.2 重组质粒的构建
根据DTMUV E 蛋白基因及其结构域I、II 和III 基因核苷酸序列,设计pEGFP-N1-E、pEGFPN1-DI、pEGFP-N1-DII、pEGFP-N1-DIII 4 种真核表达质粒,并交由生工生物工程(上海) 股份有限公司合成,基因片段及长度见图1 和表1。
1.3 质粒转染
参照Lipo2000 脂质体转染试剂说明将pEGFPN1-E、pEGFP-N1-DI、pEGFP-N1-DII、pEGFP-N1-DIII 和空载体pEGFP-N1 转染DEF 细胞。设置不转染质粒的细胞为阴性对照(CK)。
1.4 倒置荧光显微镜下观察GFP 荧光表达
将质粒转染DEF 24 h 后,将细胞置于倒置荧光显微鏡下,观察GFP 在细胞中的表达并拍照。
1.5 细胞总蛋白的提取
在质粒转染DEF 24 h 后,弃去培养基,用胰酶消化,用D M EM 完全培养基( 含体积分数为10% 的FBS) 吹打细胞,收集于15 mL EP 管中,1 500 r/min 离心5 min,用预冷PBS 洗涤细胞,重复2 次,去上清液。6 孔板每孔加200 μL 裂解液;裂解液用之前1 min 加PMSF(蛋白酶抑制剂),混匀,冰浴30 min。将细胞收集至1.5 mL 离心管中,4 ℃ 条件下于14 000 r/min 离心l0 min。小心吸取上清液,转移至新的15 mL 离心管中,?80 ℃ 保存。
1.6 Western blot 检测DTMUV E 蛋白及其DI、DII 和DIII
将蛋白样品加5× SDS 凝胶上样缓冲液煮沸处理5 min 后,进行SDS-PAGE 鉴定蛋白纯度。纯化蛋白经100 g/L SDS-PAGE 分离后,采用湿法将蛋白质转印至硝酸纤维膜上,采用75 V 电压作用1.5 h。将蛋白条放入封闭液(脱脂乳体积分数为5% 的TBST 溶液) 中,在37 ℃ 条件下作用1.5 h。将蛋白条转移到一抗稀释液中,4 ℃ 慢摇,过夜。次日用TBST 清洗3 次后转移至二抗稀释液中,37 ℃ 慢摇,孵育1 h。用TBST 清洗3 次后按照Super ECLPLus 超敏发光液显色试剂盒说明书显色。
1.7 流式细胞术检测细胞凋亡
在质粒转染细胞24、36 h 后,用不含EDTA 的胰酶消化收集细胞,1 500 r/min 离心5 min,去上清液。用预冷的PBS 重悬细胞,1 500 r/min 离心5 min,去上清液,在用PBS 重悬1 次细胞、小心吸除上清液后,加入250 μL Binding buffer 重悬细胞,吸取100 μL 的细胞悬液于5 mL 流式管中,加5 μLAnnexin V-FITC,避光孵育10 min,上机前5 min 加入10 μL 碘化丙啶(PI) 溶液,轻轻混匀。上机前在反应管中补加400 μL PBS 重悬细胞,避光保存,随即进行流式细胞仪检测。
1.8 流式细胞术检测细胞周期
在质粒转染24、36 h 后,小心吸除细胞培养液,用胰酶消化细胞,加入1 mL 完全培养基收集细胞,1 500 r/min 离心5 min,去上清液。用1 mL 预冷P B S 重悬细胞,去上清液。用1 mL 预冷的70%(φ) 乙醇溶液固定细胞,过夜。然后1 500 r/min离心5 min,去上清液。加入预冷的PBS 重悬细胞,1 500 r/min 离心5 min,去上清液。配制碘化丙啶染色液:对于1 个样品,在0.5 mL 染色缓冲液中加入25 μL 碘化丙啶染色液(20 ×) 和10 μL RNaseA(50 ×),混匀待用。染色:每管细胞样品中加入0.5 mL碘化丙啶染色液,轻轻混匀重悬细胞沉淀,37 ℃ 避光孵育30 min,就可以进行流式检测,流式检测最好在5 h 内完成。流式检测和分析:用流式细胞仪在微发波长488 nm 处检测红色荧光,同时检测光散射情况。采用F l o w J o 分析软件进行细胞DNA 含量和光散射分析。
2 结果与分析
2.1 质粒转染DEF 后GFP 表达
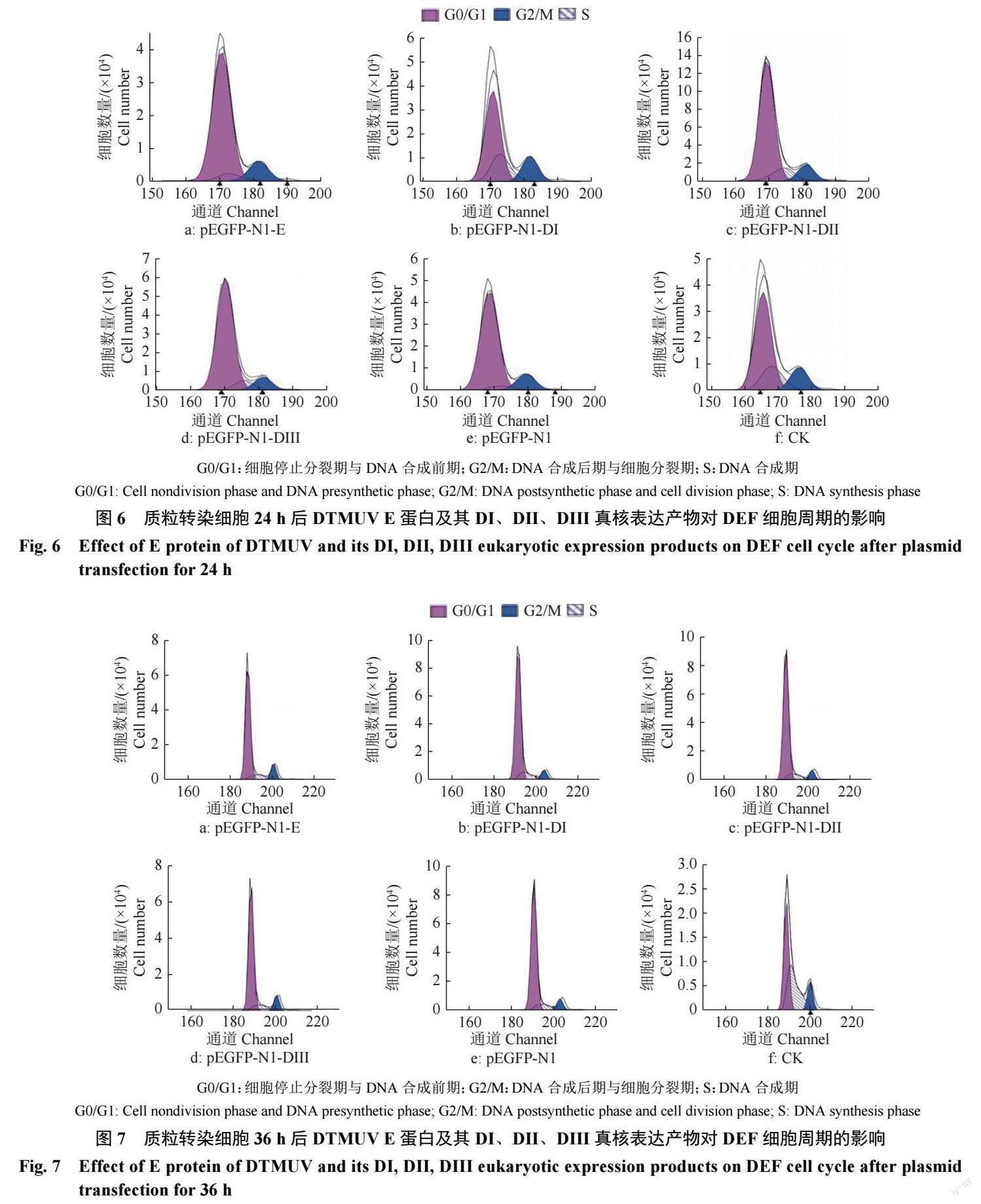
利用倒置荧光显微镜对各组转染细胞进行观察, 见图2 。结果显示, 在转染2 4 h 后, 可见pEGFP-N1-E、pEGFP-N1-DI、pEGFP-N1-DII 和pEGFP-N1-DIII 重组质粒及pEGFP-N1 空载体转染的DEF 细胞出现明显的绿色荧光,GFP 在DEF 中有明显的表达。随着时间的推移,各组细胞荧光强度均有所增强。
2.2 E 蛋白及其DI、DII 和DIII 在DEF 中的表达
如图3 所示, 纯化后E 蛋白及D I 、D I I 和DIII 均有单一条带,与目的片段大小相符,相对分子质量约为82 000、44 000、47 000、40 000,pEGFP-N1 空载体与目的片段大小相符,相对分子质量约为27 000,证明重组质粒E 蛋白及其DI、DII 和DIII 蛋白具有良好的表达。
2.3 质粒表达的蛋白对细胞凋亡的影响
pEGFP-N1-E、pEGFP-N1-DI、pEGFP-N1-DII 和pEGFP-N1-DIII 重组质粒及pEGFP-N1 空载体分别转染DEF 24、36 h 后,收集各组细胞,用流式细胞仪检测。早期凋亡以Annexin V-FITC (AFITC)染色为主,在流式细胞分析图(图4、5) 中为右下区(Q3、Q7) 细胞簇。晚期凋亡为Annexin VFITC/PI (A-FITC/PI) 双染色,在流式细胞分析图(图4、5) 中为右上区(Q2、Q6) 细胞簇。
检测结果表明,在質粒转染24 h 后,与pEGFPN1 空载体转染组1 4 . 8% 的早期凋亡率相比,pEGFP-N1-DII 转染组细胞凋亡率略低,为14.0%;pEGFP-N1-E、pEGFP-N1-DI 和pEGFP-N1-DIII 真核表达产物诱导DEF 的早期凋亡率分别是16.4%、15.1% 和17.2%,略高于空载体转染组。不同蛋白引起DEF 晚期凋亡率的数据正好相反,相对于pEGFP-N1 空载体转染组47.2% 的晚期凋亡率,pEGFP-N1-DII 转染组凋亡率略高,为49.4%,pEGFP-N1-E、pEGFP-N1-DI 和pEGFP-N1-DIII 真核表达产物诱导DEF 的细胞凋亡率分别是45.6%、42.9% 和40.6%,略低于空载体转染组。质粒转染36 h 后,pEGFP-N1-E、pEGFP-N1-DI、pEGFP-N1-DII 和pEGFP-N1-DIII 真核表达产物诱导DEF 的早期凋亡率分别是23.4%、18.5%、26.7% 和29.4%,均明显高于pEGFP-N1 空载体转染组15.2% 的凋亡率。
通过分析各组细胞凋亡数据,结合细胞本身的凋亡背景,可以看出,pEGFP-N1-E、pEGFP-N1-DI、pEGFP-N1-DII 和pEGFP-N1-DIII 重组质粒在转染DEF 24 h 后,各组细胞早期凋亡率差异不明显;质粒转染细胞36 h 后,相对于空载体组,pEGFP-N1-E、pEGFP-N1-DI、pEGFP-N1-DII 和pEGFP-N1-DIII 重组质粒均能明显诱导细胞早期凋亡,但是各组诱导细胞凋亡能力存在一定差异。
2.4 质粒表达蛋白对细胞周期的影响
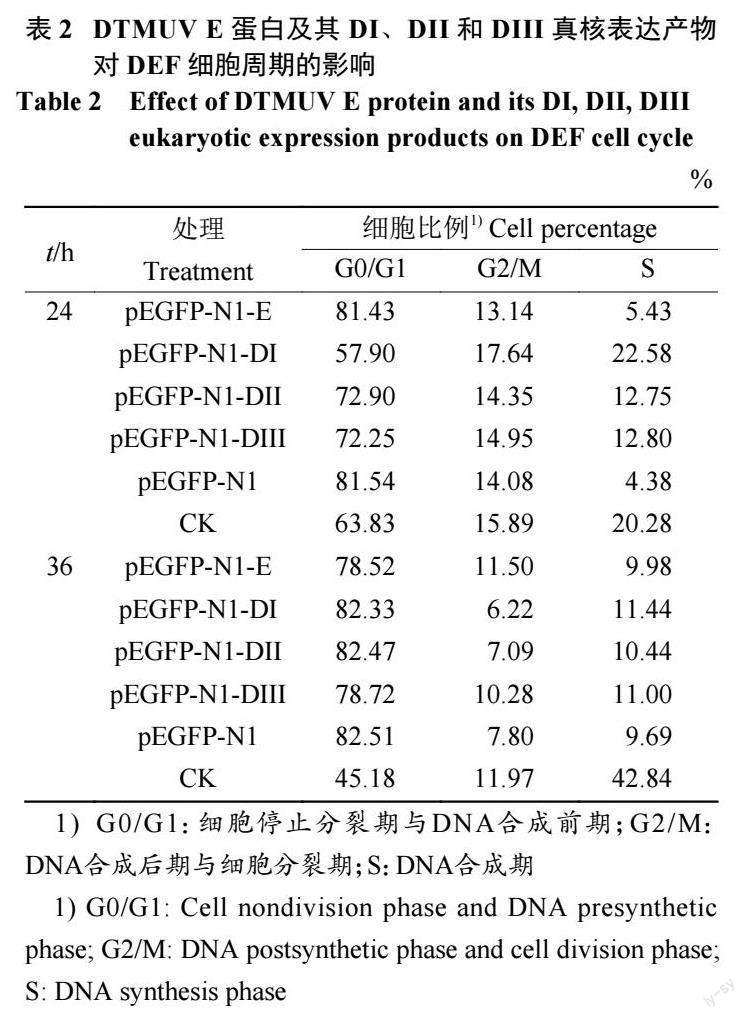
pEGFP-N1-E、pEGFP-N1-DI、pEGFP-N1-DII 和pEGFP-N1-DIII 重组质粒及pEGFP-N1 空载体分别转染DEF 24、36 h 后,收集各组细胞,用流式细胞仪检测各质粒表达的蛋白对细胞周期的影响。质粒转染24 h 后,pEGFP-N1-E、pEGFP-N1-DI、pEGFP-N1-DII 和pEGFP-N1-DIII 試验组的DNA 合成期(S 期) 细胞比例分别为5.43%、22.58%、12.75% 和12.80%,都明显高于pEGFPN1空载体转染组的4.38%;DNA 合成后期与细胞分裂期(G2/M 期) 除了pEGFP-N1-E 低于pEGFPN1空载体转染组的14.08% 外,pEGFP-N1-DI、p E G F P - N 1 - D I I 和p E G F P - N 1 - D I I I 组都高于p E G F P - N 1 空载体转染组, 分别为1 7 . 6 4 % 、14.35% 和14.95%。质粒转染36 h 后,pEGFP-N1-E、pEGFP-N1-DI、pEGFP-N1-DII 和pEGFP-N1-DIII S 期细胞比例相较于pEGFP-N1 空载体转染组的9.69% 明显上升;G2/M 期pEGFP-N1-E、pEGFPN1-DIII 明显高于pEGFP-N1 空载体转染组,而相较于24 h 的pEGFP-N1-E、pEGFP-N1-DI、pEGFPN1-DII 和pEGFP-N1-DIII G2/M 期,细胞比例明显下降,分别下降了1 . 6 4 % 、1 1 . 4 2 % 、7 . 2 6% 和4.67%。具体见表2、图6 和图7。
3 讨论与结论
DTMUV E 蛋白是诱导机体产生免疫保护性抗体的主要抗原,含有3 个抗原表位区,分为DI、DII 和DIII, DI 主要包含3 个区段? 第1—51 个aa、第137—196 个aa、第293—311 个aa,是糖基化位点和生物活性富集区;DII 包含2 个区段?第52—136 个aa、第197—292 个aa,为血凝活性及中和活性的富集区;DIII 只含1 个区段?第312—411 个aa,主要参与受体结合过程[12]。为探讨DTMUV E 基因DI、DII 和DIII 真核表达产物对DEF 细胞周期与细胞凋亡的影响,本研究设计、合成了E 蛋白及其3 个结构域的真核表达质粒,并转染到DEF,用流式细胞仪检测了细胞凋亡与细胞周期。
近年来,有许多学者对DTMUV 诱导的细胞凋亡进行了广泛的研究。李秀丽等[ 1 3 ] 研究表明DTMUV 能够显著引起细胞凋亡,导致脾脏淋巴细胞减少,严重影响脾脏的免疫功能。提金凤等[14] 研究发现感染坦布苏病毒(Tambursu virus,TMUV)24 h 昆明鼠的脾细胞中,细胞凋亡比例为27.9%,对照组为16.1%,感染TMUV 48 h 昆明鼠的脾细胞中,细胞凋亡比例为32.22%,对照组为25.26%,试验组和对照组相比差异显著;证明TMUV 可诱导昆明鼠发生显著的脾细胞凋亡,感染病毒时间越长, 脾细胞凋亡越明显。P a n 等[ 1 5 ] 研究发现DTMUV 感染后DEF 中细胞凋亡比例与这些细胞获得的病毒滴度呈正相关,DTMUV 可能通过诱导细胞凋亡来促进病毒体的复制和传播。在本研究中,DTMUV E 蛋白及其DI、DII 和DIII 重组质粒均能诱导细胞早期凋亡,且凋亡比例随时间延长逐渐增加,36 h 的凋亡率(18.5%~29.4%) 明显高于24 h的(14.0%~17.2%),这与前人研究结果一致。但不同的结构域在病毒复制的过程中如何诱导细胞凋亡,凋亡过程与病毒的复制、毒力之间的关系值得进一步探讨。
于观留[ 1 6 ] 研究发现T M UV 感染1 2 、2 4 h后,BCL2A1 (B 淋巴细胞瘤2A1 抗凋亡蛋白) 干扰组(siRNA-BCL2A1) 的S 期细胞比例与其对照组(siRNA-NC) 相比显著增加(P<0.01),即siRNABCL2A1可以诱导病毒感染后DEF 在S 期停滞,证明BCL2A1 在调节病毒感染后的DEF 细胞周期中发挥着重要作用。林昀[17] 发现在感染后12、24 h,TMUV 感染组中处于S 期和G2/M 期的细胞比例显著升高,说明TMUV 的感染可以诱导DEF 在S 期和G2/M 期停滞。在本研究中,质粒转染24、36 h后,DTMUV E 全长及其DI、DII 和DIII 均可以诱导S 期的停滞, 这与前人研究结果基本一致。DTMUV E 蛋白全长及其DI、DII 和DIII 通过什么途径造成DEF 凋亡,尚需进一步研究。
E 蛋白是DTMUV 的主要结构蛋白,在膜融合和介导病毒与细胞受体结合过程中起至关重要的作用,可直接影响病毒的宿主范围、组织嗜性和毒力[ 1 8 ]。在本研究中,E 蛋白及其3 个结构域DI、DII 和DIII 不仅均可以诱导DEF 早期凋亡,也可以引起DEF 在S 期的停滞,这可能为研究DTMUVE 蛋白的功能以及致病机制提供了新的切入点。
参考文献:
张帆帆, 曾艳兵, 方绍培, 等. 鸭坦布苏病毒病的研究进展[J]. 畜牧兽医学报, 2021, 52(6): 1489-1497.
陈仕龙, 陈少莺, 王劭, 等. 一种引起蛋鸡产蛋下降的新型黄病毒的分离与初步鉴定[J]. 福建农业学报, 2011,26(2): 170-174.
章丽娇. 坦布苏病毒细胞适应毒免疫原性及致弱分子基础研究[D]. 北京: 中国农业大学, 2017.
姜胜男. 鸭DDX3X 基因的克隆表达及其抗鸭坦布苏病毒活性研究[D]. 泰安: 山东农业大学, 2020.
董嘉文, 李林林, 孙敏华, 等. 鸭坦布苏病毒JM 株E 蛋白的截断表达及间接ELISA 方法的建立[J]. 中国动物传染病学报, 2017, 25(1): 12-18.
LIU M, LIU C, LI G, et al. Complete genomic sequenceof duck flavivirus from China[J]. Journal of Virology,2012, 86(6): 3398-3399.
YU K, SHENG Z Z, HUANG B, et al. Structural, antigenic,and evolutionary characterizations of the envelopeprotein of newly emerging Duck Tembusu Virus[J].PLoS One, 2013, 8(8): e71319.
ZHANG X, JIA R, SHEN H, et al. Structures and functionsof the envelope glycoprotein in flavivirus infections[J]. Viruses, 2017, 9(11): 338. doi: 10.3390/v9110338.
ZHAO D, HUANG X, LIU Y, et al. Domain I and IIfrom newly emerging goose tembusu virus envelope proteinfunctions as a dominant-negative inhibitor of virusinfectivity[J]. Research in Veterinary Science, 2015, 98:121-126.
王若潔. 鸭坦布苏病毒E 蛋白Domain III 的原核表达及其免疫原性的初步研究[D]. 合肥: 安徽农业大学, 2020.
张琳. 鸭坦布苏病毒E 蛋白抗原表位的鉴定[D]. 泰安:山东农业大学, 2013.
KOLASKAR A S, KULKARNI-KALE U. Prediction ofthree-dimensional structure and mapping of conformationalepitopes of envelope glycoprotein of Japanese encephalitisvirus[J]. Virology, 1999, 261(1): 31-42.
李秀丽, 提金凤, 路云建, 等. 鸭坦布苏病毒对雏鸭免疫系统的影响[J]. 中国兽医学报, 2017, 37(2): 211-217.
提金凤, 李志杰, 刁有祥, 等. 坦布苏病毒诱导昆明鼠脾细胞凋亡[J]. 中国兽医学报, 2021, 41(4): 640-645.
PAN Y, CHENG A, ZHANG X, et al. Transcriptomeanalysis of duck embryo fibroblasts for the dynamic responseto duck tembusu virus infection and dual regulationof apoptosis genes[J]. Aging, 2020, 12(17): 17503-17527.
于观留. 坦布苏病毒感染对鸭胚成纤维细胞生物学功能的影响及其机制研究[D]. 泰安: 山东农业大学, 2019.
林昀. 坦布苏病毒感染的鸭胚成纤维中长链非编码RNA 的表达谱变化及其功能初步研究[D]. 泰安: 山东农业大学, 2020.
林委卫, 陈雪明, 李晨曦, 等. 鸭坦布苏病毒E 蛋白具有独特交叉反应性中和表位的鉴定[J]. 中国兽医学报,2021, 41(1): 26-32.
【责任编辑 李庆玲】

