PLGA导管复合骨髓间充质干细胞与细胞外基质凝胶移植修复大鼠坐骨神经缺损的生物力学分析
王怀程,李鹏,汪标文,杜纯宇,于涛*
(1.吉林大学中日联谊医院骨关节科,吉林 长春 130031;2.吉林大学机械工程与航空学院工程力学系,吉林 长春 130022)
周围神经损伤主要是由于牵拉伤、切割伤、火器伤、压迫性损伤、缺血等原因导致的短暂或终生的神经功能障碍,它的病理[1]变化包括轴浆运输受损、轴突变性、施万细胞损伤、节段性脱髓鞘和完全瓦勒氏变性[2]。美国2009—2018年间,单上肢周围神经损伤发生率显著上升,年平均发病率为36.9%,2018年发病率为51.9%[3]。损伤程度较重时,自发周围神经再生、感觉和运动功能的恢复并不完全[4]。随着组织工程研究的发展,近期研究表明[5]:将细胞和生物材料复合支架[6]植入受损的组织进行修复治疗已成为现实[7]。聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]是目前组织工程研究和应用最为广泛的一类材料[8]。学者们对PLGA导管对周围神经的生物学特性进行了大量的研究。 Gattermeye等[9]和Quirk等[10]研究结果表明,采用离子表面处理方法在PLGA材料表面引入功能基团或功能链,可提高支架材料表面的黏附性。Shen等[11]以引入阳离子化的凝胶抗基,离子处理PLGA膜,有效地改善了细胞对PLGA降解支架材料的亲和性,得出了通过等离子处理的PLGA支架提高了碱性成纤维细胞生长因子(basic fibrobast growth factor,BFGF)的固化效率的结论。骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)是目前细胞治疗及组织工程修复的重要细胞来源[12]。学者们对以BMSCs移植干预治疗神经损伤进行了大量的研究。张学磊等[13]以脱细胞异体神经导管联合BMSCs和富血小板凝胶移植动物股神经损伤,对比分析脱细胞神经支架联合BMSCs和富血小板凝胶移植治疗兔股神经损伤的效果,得出了脱细胞神经支架联合BMSCs和富血小板凝胶修复股神经损伤效果较好的结论。张威等[14]研究了BMSCs来源的外泌体对大鼠坐骨神经损伤的修复效果,随机将24只SD大鼠分为三组,暴露出大鼠右侧坐骨神经后,建立鼠钳夹伤模型,Control组在相同部位注射等量磷酸盐缓冲盐溶液(phosphate buffered saline,PBS),Sham组仅分离出神经,Exosome组在钳夹伤附近的神经外膜下注射5 μL外泌体。术后4周检测大鼠运动功能的恢复情况;检测各组大鼠电生理神经传导功能的恢复情况;以马松染色的方法检测各组大鼠手术侧腓肠肌的纤维面积;以透射电镜观察神经纤维直径结构变化;免疫荧光染色方法对坐骨神经损伤的相应脊髓节段染色后观察星形胶质细胞、小胶质细胞的活化数量。结果得出了坐骨神经损伤后BMSCs来源的外泌体有利于运动功能的恢复[15],其机制和缓解疼痛与促进轴突再生有关的结论。以往的研究[13-15]均未涉及坐骨神经损伤动物模型以PLGA导管复合BMSCs与ECM凝胶移植修复后坐骨神经生物力学特性分析。PLGA导管复合BMSCs与ECM凝胶移植修复坐骨神经缺损生物力学分析罕见报道,鉴于此,作者对以PLGA导管复合BMSCs、PLGA导管复合BMSCs与ECM凝胶移植坐骨神经缺损动物模型后的动物模型大鼠,进行大体行为学观察、坐骨神经功能指数测量、坐骨神经拉伸力学实验,观察PLGA导管复合BMSCs、PLGA导管复合BMSCs与ECM凝胶移植修复坐骨神经损伤动物模型的效果。
1 材料与方法
1.1 材料与试剂 6个月龄健康SD雄性大鼠36只,体质量300~308 g,购于长春高新医学动物实验中心[(许可证CXK(吉)2003—2004)]。ECM凝胶(BD公司,美国)、大鼠BMSCs(上海一研生物科技有限公司,中国)、PLGA(长春圣博玛生物材料有限公司,中国)。9-0无创缝合线(青岛耐克医材有限公司,中国)。
1.2 实验设备 MODEL55100型自动控制电子万能试验机(长春试验机研究所集团公司,中国)、CGA-5型读数显微镜(长春市第三光学仪器厂,中国)。Leica手术显微镜(德国)。
1.3 PLGA导管制作 按于涛等[16]方法将PLGA溶于二氯甲烷(7∶3)中,加入200~300 μm粒径的NaCl做致孔剂(PLGA与NaCl质量比1∶9)混合搅拌均匀。将混合物注入内径1.6 mm、外径1.8 mm、长40 mm的预制模具中,室温下使模具中的混合物在通风橱中自然挥发,96 h后脱模,取出PLGA与NaCl柱状导管,将导管移到真空干燥箱内。在37 ℃环境温度下真空干燥48 h,将PLGA与NaCl柱状导管浸入装有800 mL离子水的烧杯中,每4 h更换1次去离子水,去离子水洗涤96 h后,将PLGA与NaCl柱状导管取出,置于干燥箱中37 ℃干燥48 h,36 ℃环氧乙烷对PLGA与NaCl柱状导管消毒12 h后备用。实验前取出与NaCl与PLGA导管,使用S-5无菌塑柄手术刀切取NaCl与PLGA导管组试样40个,试样长10 mm。
1.4 实验分组与方法 按Lopes等[17]方法制备动物坐骨神经损伤缺损,36只实验动物随机分为三组:(1)自体神经移植组12只;(2)PLGA导管复合BMSCs移植组12只;(3)PLGA导管复合BMSCs与细胞外基质(extracellular matrix,ECM)凝胶移植组12只。分别将36只实验大鼠固定于动物手术台上,以6%(6 mL/kg)水合氯醛腹腔注射麻醉大鼠,在大鼠左侧股后部做正中切口,切开皮肤、皮下组织,分离半膜肌、半腱肌,使左侧坐骨神经暴露并游离。在梨状肌下缘3 mm处切除10 mm坐骨神经,制备坐骨神经10 mm的缺损模型。
1.5 坐骨神经缺损移植 按于涛等[16]的方法:(1)自体神经移植组:在手术显微镜下,将切除的自体坐骨神经用缝合神经外膜缝合两断端,每端缝合4针。(2)PLGA导管复合BMSCs移植组:取10 mm PLGA导管在手术显微镜下,将神经断端分别套入PLGA神经导管,用9-0无创缝合线一针固定神经外膜和PLGA神经导管管壁,之后两端各缝合4针。用微量注射器将大鼠BMSCs(1×109L)注入PLGA神经导管内。(3)PLGA神经导管复合BMSCs与ECM凝胶移植组:在手术显微镜下取10 mm PLGA导管将神经断端分别套入PLGA神经导管,用9-0无创缝合线一针固定神经外膜和PLGA神经导管管壁,之后两端各缝合4针,用微量注射器将大鼠BMSCs(1×109L)与外基质凝胶(1×109L)注入PLGA神经导管内。各实验组大鼠以庆大霉素冲洗伤口后分层关闭切口,术后大鼠肢体不做外固定。待大鼠清醒后将大鼠分笼喂养,每只实验大鼠每天腹腔注射青霉素1万U/kg×2次,连续注射7 d,以75%酒精对大鼠皮肤切口消毒1次/d,连续消毒7 d。
1.6 坐骨神经功能测试 将大鼠置于平地,观察大鼠术侧下肢运动情况及后蹬力,判断坐骨神经运动功能状态。观察大鼠对疼痛产生的反应(痛缩反应)判断其坐骨神经感觉功能的恢复情况。
1.7 坐骨神经功能指数测定 按Baptista等[18]评价坐骨神经功能的方法,于大鼠术后每6周、12周、18周、24周测定各组大鼠正常侧足(N)、实验侧足(E)的足印长度(podogram length,PL),足印的较长距离,即从足跟到足尖的距离;足趾宽度(width between the first and fifth toes,TW),即趾到第5趾连线距离;中间足趾距离(inter-toes distance,IT),即第2趾到第4趾连线距离。将测量数据代入Bain公式,计算坐骨神经功能指数及其恢复率。坐骨神经功能指数=-38.3(EPL-NPL)/NPL+109.5(ETW-NTW)/NTW+13.3(EIT-NIT)/NIT-8.8,正常大鼠坐骨神经功能指数为0,坐骨神经完全离断指标为-100。
1.8 坐骨神经取样方法 以大鼠坐骨神经吻合处为中点,取各组实验侧(左侧)同一段坐骨神经,长度约10 mm,每组各取12个坐骨神经试样;随机取各组大鼠右侧坐骨神经12个试样为正常对照组。试样取出后置于装有生理盐水的器皿中存放备用。
1.9 坐骨神经试样拉伸实验方法 采用CGA-5型读数显微镜测量各组坐骨神经试样的长度和直径,各组均长10 mm、直径1.52~1.55 mm。按Piao等[19]的方法分别对每个坐骨神经试样进行预调处理后进行实验,温度控制在(36.5±1.0) ℃内,分别将每个试样装夹于试验机的夹具内,之后以5 mm/min的速度对试样施加拉伸载荷,为使试样在实验中保持湿度,实验中不断的向试样喷洒生理盐水。实验结束后,计算机自动输出试样的弹性限度应变、最大应变、弹性限度应力、最大应力、弹性限度载荷、最大载荷等数据和应力-应变曲线。
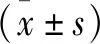
2 结 果
2.1 大鼠大体行为观察结果 各组大鼠均未发现死亡,术后各组大鼠精神状态尚可,伤口无感染,活动良好。PLGA导管复合BMSCs与ECM凝胶移植组大鼠术后14 d伤口愈合,足底皮肤有红肿,无溃疡,21 d后术侧足趾可着地行走,后蹬力较好;自体神经移植组、PLGA导管复合BMSCs移植组大鼠术后2周发现足底皮肤有红肿和溃疡,4周后伤口和皮肤溃疡愈合,术后42 d能着地行走,有跛行。术后168 d针刺患肢足底,各组大鼠均有痛缩反应。各组大鼠神经缝合处与周围组织无黏连,远、近端与正常神经连接处光滑无断裂,均有纤维组织包绕,表面可见丰富的微小血管网形成,外形和正常神经相似。
2.2 坐骨神经功能指数测定 各组大鼠坐骨神经功能指数测定结果表明,术后6周PLGA导管复合BMSCs与ECM凝胶移植组神经功能恢复优于自体神经移植组、PLGA导管复合BMSCs移植组(P<0.05);术后12周、24周各组坐骨神经功能相似(P>0.05,见表1)。
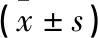
表1 各组大鼠坐骨神经功能指数测定结果
2.3 坐骨神经试样拉伸实验结果 PLGA导管复合BMSCs移植组、PLGA导管复合BMSCs与ECM凝胶移植组,在拉伸弹性限度载荷、弹性限应力、最大载荷、最大应力、最大应变、弹性限度应变均大于自体神经移植组,差异有统计学意义(P<0.05);PLGA导管复合BMSCs与ECM凝胶移植组的拉伸弹性限度载荷、弹性限应力、最大载荷、最大应力、弹性限度应变大于PLGA导管复合BMSCs移植组,差异有统计学意义(P<0.05,见表2)。
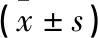
表2 各组大鼠坐骨神经拉伸实验结果
3 讨 论
神经损伤动物模型是研究神经损伤的先决条件。大鼠坐骨神经结构与人类坐骨神经结构具有一定的相似性,因此本实验采取了以下干预措施,由同一具有高级技术职称的显微外科医生以手术刀切取各组用于移植的坐骨神经试样,试样的长度一、直径基本一致。以无菌塑柄手术刀在每个大鼠坐骨神经相同部位切断,形成一个10 mm缺损,复制坐骨神经缺损模型。自体神经移植组以外膜缝合法移植缝合坐骨神经,PLGA导管复合BMSCs、PLGA导管复合BMSCs与ECM凝胶组试样,将神经断端分别套入PLGA神经导管,将套接后缝合离断试样。对每个试样均在相同的部位缝合,缝合的针数相同,对不符合要求的试样予以剔出。由于干预措施得当,实验结果可靠。各组大鼠行为学观察和功能测试结果各移植组大鼠移植24周内均未发生死亡,大鼠移植手术没有导致严重手术损伤、过敏反应、排斥反应,术后对大鼠针刺有痛缩反应,足底皮肤未发生严重溃疡,通过PLGA导管复合BMSCs、PLGA导管复合BMSCs与ECM凝胶修复后大鼠感觉功能得到恢复。术后4周大鼠能正常着地行走,并有一定的后蹬力,说明神经的运动功能得到了明显的恢复。
坐骨神经试样拉伸实验结果表明,PLGA导管复合BMSCs移植组、PLGA导管复合BMSCs与ECM凝胶移植组坐骨神经的弹性限度应变、最大应力、最大应变大于自体神经修复组,说明PLGA导管复合BMSCs与ECM凝胶移植修复动物坐骨神经损伤后起到了提高坐骨神经弹性、强度的效果,其弹性提高有利于坐骨神经抵抗变形和外力,有利于损伤的坐骨神经的修复和再生。由于坐骨神经受到损伤后打乱了神经纤维的排列关系,神经纤维受到损伤,使拉伸力学性能指标降低,拉伸力学特性发生改变,PLGA导管复合BMSCs、PLGA导管复合BMSCs与ECM凝胶移植后坐骨神经的功能得到了修复,所以力学特性也得到了恢复。
本实验坐骨神经损伤动物模型以PLGA导管复合BMSCs、PLGA导管复合BMSCs与ECM凝胶移植干预后,动物坐骨神经的拉伸力学、生理功能等均到了一定的恢复,与所期望的结果相符。PLGA导管复合BMSCs与ECM凝胶移植对动物坐骨神经具有很好的修复效果。Piao等[20]研究化学提取脱细胞神经联合脂肪源性干细胞移植修复坐骨神经,在移植24周时进行了电生理测试和拉伸实验,得出了添加脂肪源性干细胞对神经功能、形态和拉伸力学功能的恢复有显著影响。本实验与Piao等不同,Piao等[20]是以脱细胞联合脂肪间充值干细胞移植修复家兔坐骨神经损伤,本实验是以PLGA导管联合BMSCs与ECM凝胶修复大鼠坐骨神经损伤,Piao等对动物坐骨神经进行了简单拉伸力学实验,本实验是对各组动物坐骨神经进行了长时间的应力松弛、蠕变特性实验,结果更具参考价值。

