柑橘采后青霉病原中寄生病毒的筛选与鉴定
张廷富,文国琴,王守长,宋 波
(西华师范大学生命科学学院,四川 南充 637000)
【研究意义】柑橘作为我国重要的水果,在采后运输储藏过程中易受到病原菌,特别是青绿霉的侵害[1-2]。生产上主要使用化学药剂防护柑橘,不但存在农药残留和环境污染问题,而且化学农药的长期使用还会导致病原菌耐药性的产生。因此,有必要寻找高效无害的柑橘采后真菌病害防治方法[3-4]。生物防治具有绿色环保、不易引起菌株抗药性和价格低廉等优点。【前人研究进展】目前,采用生物防治果蔬采后病害已取得了一定进展,但在柑橘防治方面鲜有报道[5]。研究表明,真菌和细菌均可作为柑橘果实采后病原菌的拮抗菌,如枯草芽孢杆菌(Bacillussubtilis)对青霉病原菌,解淀粉芽孢杆菌(B.amyloliquefaciens)和绿色木霉(Trichodermaviride)对指状青霉具有拮抗作用[6];汉逊德巴利氏酵母(Debaryomyceshanseni)、膜醭毕赤酵母(Pichiamembranaefaciens)对柑橘青绿霉病均有显著的防治效果[6]。此外,板栗疫病菌中的低毒病毒CHV1可降低植物病原真菌的致病力,开启了弱毒性真菌病毒用于真菌病害防治的先例。真菌病毒主要为RNA病毒,少数为DNA病毒,随着研究的不断深入,发现自然界存在着丰富的真菌病毒资源[7-8]。目前发现的RNA真菌病毒包括dsRNA病毒、+ssRNA病毒和-ssRNA病毒。dsRNA病毒有7个科:产黄青霉病毒科(Chrysoviridae)、呼肠孤病毒科(Reoviridae)、内源病毒科(Endornaviridae)、巨大双分核糖核酸病毒科(Megabirnaviridae)、双分病毒科(Paritiviridae)、全病毒科(Totiviridae)及四分病毒科(Quadridae);+ssRNA已发现5个科:甲型线状病毒科(Alphaflexiviridae)、杆菌状核糖核酸病毒科(Barnaviridae)、丙型线形病毒科(Gammaflexiviridae)、裸露核糖核酸病毒科(Narnaviridae)和低病毒科(Hypoviridae);-ssRNA病毒目前仅发现真菌单负链RNA病毒科(Mycomononegaviridae)1个科[9-10]。已知的真菌病毒分类研究显示,真菌病毒与动植物病毒等在进化上有一定亲缘关系,表明它们有共同的祖先或者真菌病毒来源于其它已感染病毒的生物。由于一些病毒感染真菌后,真菌的相关基因表达受到抑制而表现出致病力明显减弱。因此,可以利用真菌病毒弱化真菌对宿主的毒力这一特性进行植物真菌病害的生物防控。目前,运用弱毒病毒成功防治植物真菌病害的2个经典案例为:1978年欧洲利用板栗疫病菌低毒病毒CHV1成功抵抗了板栗疫病,使欧洲濒临灭绝的栗树林重获新生[11]。近几年,华中农业大学姜道宏教授课题组从油菜菌核病菌的致病力衰退菌株中分离鉴定了SsHADV-1病毒,能使核盘菌从典型的坏死性病原菌转变为植物有益的内生真菌,促进油菜生长、增强抗病性和提高产量,有望被开发为“植物疫苗”[12]。因此,发掘新型低毒力相关病毒可为植物真菌病害的绿色防治提供新资源和新思路。【本研究切入点】本研究从腐烂柑橘表皮分离鉴定了柑橘采后25株主要青霉病原(指状青霉和意大利青霉),根据总基因组电泳图谱筛选具有基因组额外核酸片段的病毒菌株,并使用RT-PCR扩增额外片段测序鉴定相应病毒。【拟解决的关键问题】本研究分离鉴定的4株指状青霉病毒为柑橘绿霉病的绿色防治提供更丰富的生防病毒资源。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株 本研究所用青霉菌株分离于四川省中江县柑橘果园成熟期腐烂柑橘样品,并由西华师大微生物实验室保存。
1.1.2 培养基与试剂 PDA培养基、50×TAE (pH 8.0)电泳缓冲液、液氮、CF-11纤维素粉(Sigma)、琼脂糖、引物ITS1和ITS4 (上海生工)、DNA分子标准DS5000和1 kb ladder、10×Loading buffer (东盛生物)、超纯水;真菌基因组提取试剂盒(杭州博日科技)、凝胶回收试剂盒(Omega)、2×PCR mix (东盛生物)、RT-PCR试剂盒(杭州博日科技),其他化学试剂为分析纯(国药集团)。
1.2 实验方法
1.2.1 青霉菌株的分离与纯化 ①病原菌的分离:将采集的柑橘样品分别按DY1、DY2、DY3依次编号,在超净工作台(苏净安泰)中用无菌接种环蘸取霉烂柑橘表皮的青霉孢子,在PDA平板上划线接种后置于霉菌培养箱(上海一恒)中28 ℃培养2~3 d。待有明显菌落长出后,再次挑取形态单一菌落上的分生孢子在PDA平板上划线进一步纯化,经过2~3次纯化培养后获得单菌落培养物[13]。最后将培养5 d的青霉分生孢子悬浮于30%甘油中,冰箱中-20 ℃保存备用。②将保种的青霉纯培养菌株接种在PDA平板上活化培养4~5 d,待菌落表面产生大量分生孢子后,观察并记录菌落的表面、边缘形态和菌落正反面颜色等形态特征。③分子鉴定:将纯培养的青霉菌株分生孢子接种于PDB培养基中,置于恒温培养摇床中28 ℃、180 r/min培养4~5 d,收集菌丝体后液氮中研磨成粉末,按照真菌DNA提取试剂盒说明书提取青霉菌株的基因组DNA,-20 ℃保存备用。基因组DNA经1%琼脂糖凝胶电泳后分析检测后,以代表菌株DY10、DY18的基因组为模板,用ITS1(TCCGTAGGTGAACCTGCGG)和ITS4(TCCTCCGCTTATTGATATGC)引物扩增ITS片段,通过琼脂糖凝胶电泳分离和溴化乙锭染色,对目的条带切胶回收纯化后送昆泰锐(武汉)生物技术有限公司测序。将测序青霉菌株的ITS序列在NCBI网站上进行在线BLAST对比后,根据序列一致性选取并下载GenBank数据库中不同青霉物种的同源性序列与测序代表菌株序列用MEGA7.0进行多序列比对后,使用邻接法(Neighbor joining)构建系统进化树,根据测序青霉菌株与已知青霉菌株在进化树上的亲缘关系,确定2种青霉代表菌株的物种分类地位。
1.2.2 真菌病毒的筛选与鉴定 所有分离的青霉菌株通过PDB培养,收集菌丝体提取总基因组进行琼脂糖凝胶电泳检测,根据电泳图谱识别总基因组中有无真菌基因组额外的核酸条带(病毒基因组RNA),筛选所检测青霉菌株中是否含有真菌病毒。再大量提取含真菌病毒的菌株基因组并用DNase I消化真菌基因组DNA,通过琼脂糖凝胶电泳分离,切胶回收纯化病毒基因组RNA。根据病毒基因组大小推测其可能是维多利亚病毒属(Victorivirus)的PdV1同种的不同病毒株的指状青霉病毒,以病毒PdV1的dsRNA基因组序列设计特异性引物对PdV1 2561F(GTTCACCCATTCAACCCTTCT)和 PdV1 3072R(TGACTCAGCGGCCAAATCG),然后进行特异性引物反转录扩增,操作如下:PCR管中依次加入纯化的dsRNA 6 μL、引物PdV1 2561F /3072R (10 μmol/L)各1 μL和DMSO 2 μL,95 ℃水浴5 min使dsRNA变性后立即置于冰中冰浴5 min;然后依次加入10 × RT-PCR 缓冲液 2.5 μL、RNase 抑制剂 (40 U/μL) 1 μL、dNTP (2.5 mmol/L) 4 μL、AMV 逆转录酶1 μL、Taq DNA聚合酶 0.5 μL、无RNase去离子水6 μL;再按以下RT-PCR反应程序进行反转录和PCR扩增:45 ℃反转录30 min,95 ℃预变性3 min,(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸50 s) × 30个循环,72 ℃延伸5 min,16 ℃保存。最后以PCR产物为模板,用引物对PdV1 2561F/3072R按50 μL体系(模板 2 μL、前后引物各2 μL、2×PCR Mix 25 μL、dH2O 19 μL)扩增目的病毒条带,待反应完成后先取5 μL PCR产物进行琼脂糖凝胶电泳,检测是否有目的条带,再将扩增产物送至昆泰锐(武汉)生物技术有限公司测序。测序序列通过NCBI网站上的在线BLASTx对比分析后,根据比对结果进行病毒株的物种鉴定。
2 结果与分析
2.1 菌株分离与纯化
从柑橘园腐烂柑橘表皮上分离到25株青霉菌,其中DY1、DY2、DY4、DY5、DY8、DY10、DY13、DY14、DY16、DY18、DY19、DY21、DY22、DY23、DY24和DY25共16株青霉菌具有与意大利青霉(俗称柑橘青霉)相似的典型菌落形态特征,菌落表面粉状分生孢子呈灰绿色,菌落松絮状或密毡状,菌丝白色,在PDA培养基上有的菌株产生淡红色或红色色素。另外9株青霉菌(DY3、DY6、DY7、DY9、DY11、DY12、DY15、DY17和DY20)具有指状青霉(又称柑橘绿霉)的典型菌落形态特征,菌落表面粉状分生孢子,呈暗黄绿色,菌丝白色,无色素产生。部分菌株在PDA培养基上的菌落形态如图1所示,所有菌株根据其形态初步分类和菌落形态描述如表1所示。
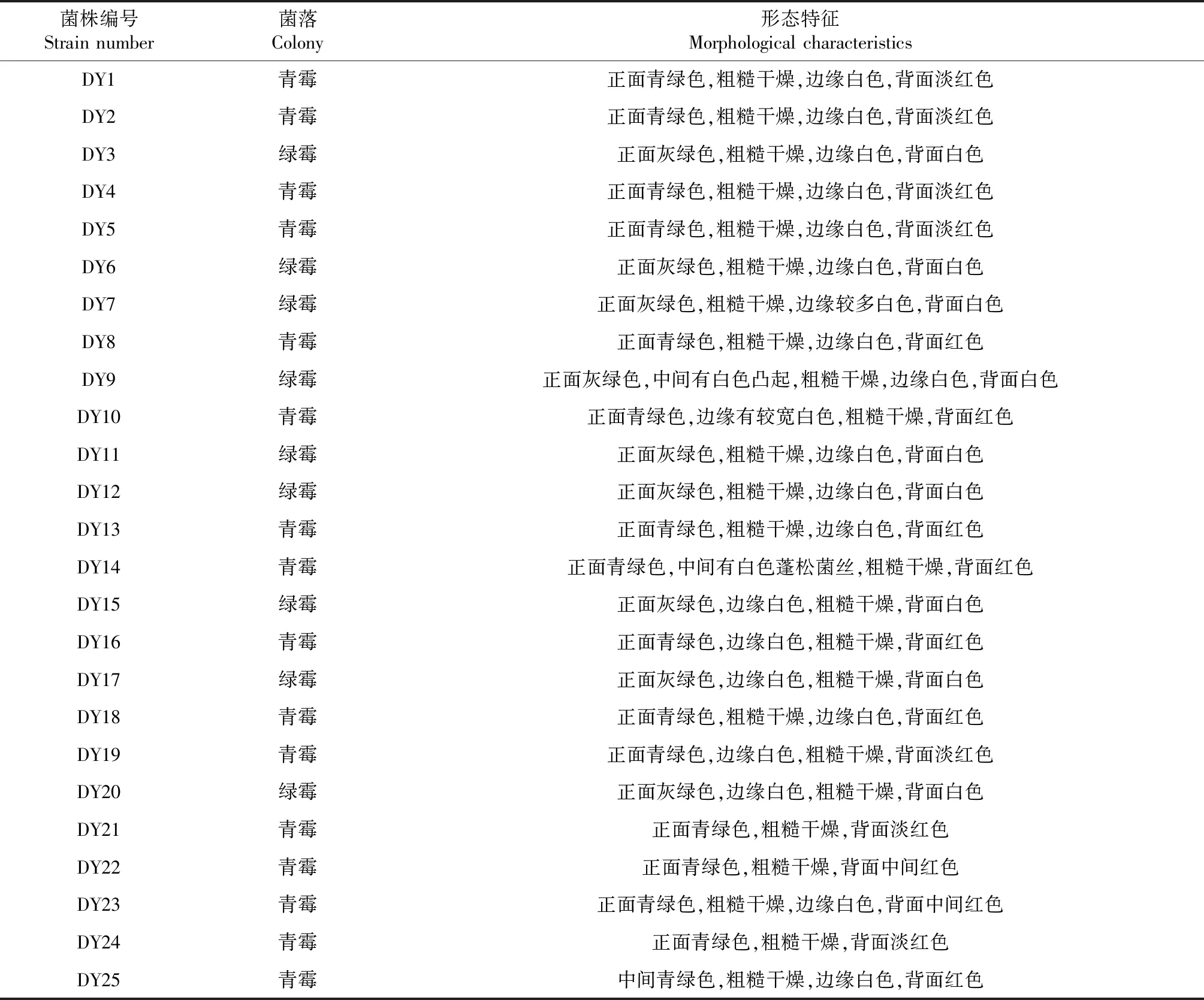
表1 分离菌株的菌落形态描述及其分类Table 1 Descriptions of colony morphology and species taxonomy of isolated strains
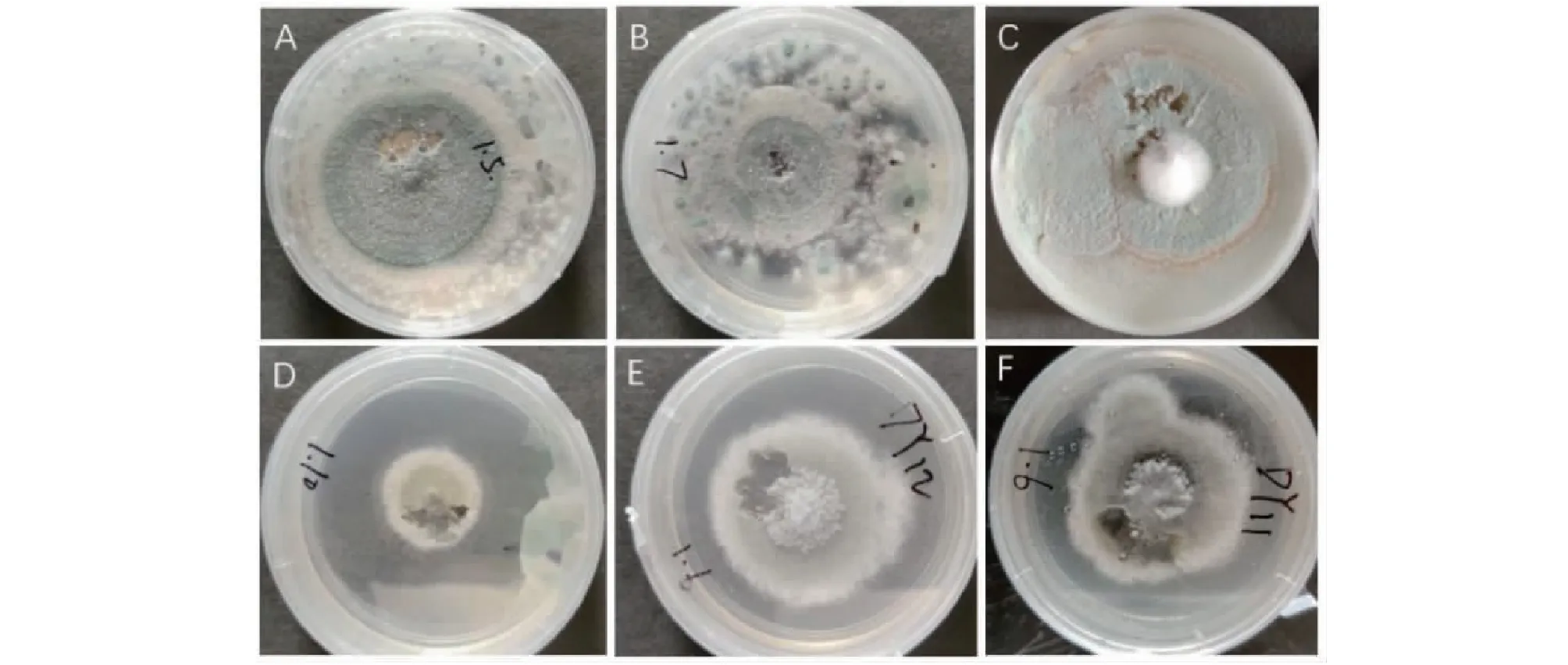
A~C.柑橘青霉落形态;D~F.柑橘绿霉落形态。A-C.Colony morphology of citrus blue mold;D-F.Colony morphology of citrus green mold.图1 部分青霉菌在PDA培养基上菌落形态Fig.1 Colony morphology of partialPenicilliumstrains on PDA medium
2.2 菌株的分子鉴定
用琼脂糖凝胶电泳检测培养青霉菌株的菌丝体基因组 (图2-A),选择2种青霉的代表菌株(DY10、DY18)的基因组为模板,扩增ITS片段PCR产物经琼脂糖凝胶电泳检测显示,DY10、DY18的rDNA-ITS片段大小约500 bp(图2-B)。目的片段切胶回收纯化后测序获得DY10和DY18菌株的ITS序列,长度分别为508和518 bp。BLAST在线比对显示,DY10 ITS序列与GenBank数据库中的意大利青霉 (MH860793.1、MH608346.1、MF568040.1、MG519279.1和MZ008211.1)的一致性达到99.8%,DY18 ITS序列与指状青霉 (MK385635.1、MK793211.1、MH630059.1和MK736912.1)的一致性高达100% (表2~3)。根据ITS序列比对结果,选择GenBank数据库中与本研究检测的ITS序列一致性超过97%的青霉菌株构建系统进化树(图3),DY10与5株意大利青霉聚在一枝;DY18与6株指状青霉聚集在另一分枝。综合菌株的菌落形态特征和rDNA-ITS序列分析,最终鉴定DY10为意大利青霉,DY18为指状青霉。
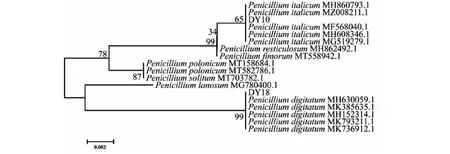
图3 基于ITS序列的青霉菌株系统发育树构建Fig.3 Construction of Penicilliumstrains phylogenetic tree based on ITS sequence
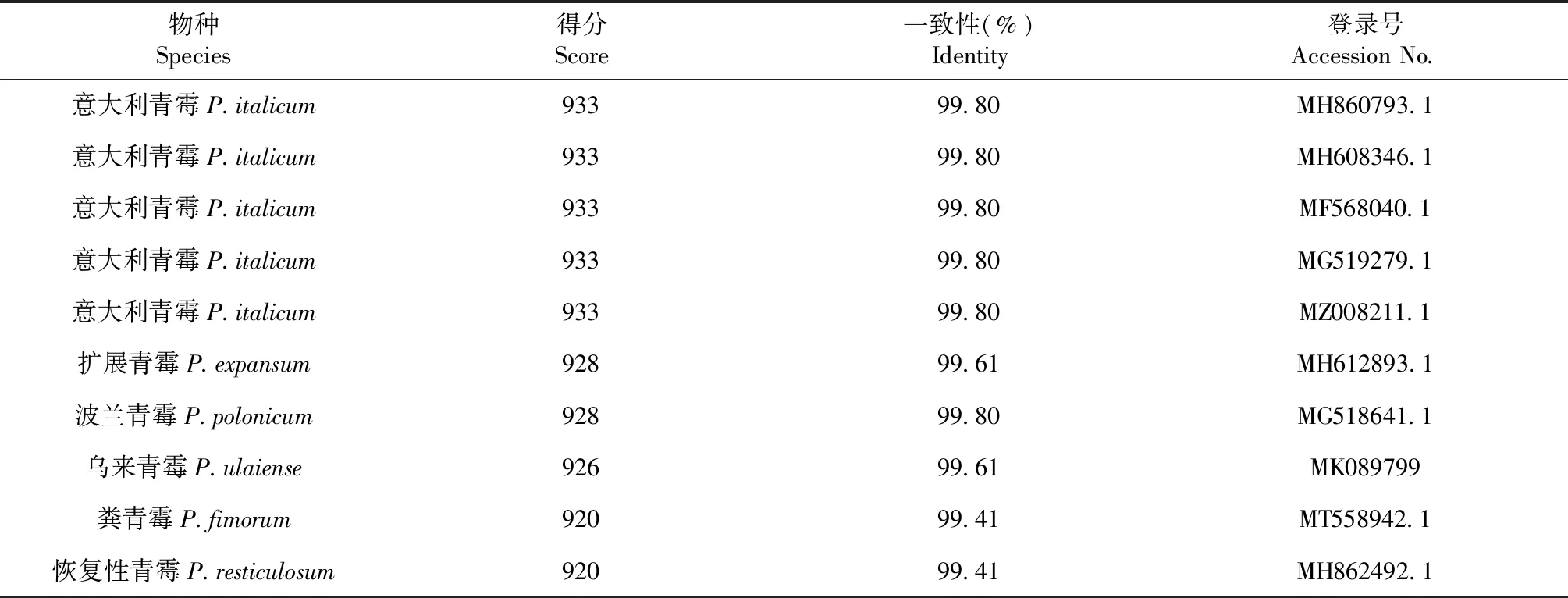
表2 DY10菌株与已知青霉分离物的ITS信息列Table 2 Information of DY10 strains and public Penicilliumisolates ITS
2.3 真菌病毒的筛选与鉴定
提取25株青霉菌株的菌丝体基因组后,使用琼脂糖凝胶电泳检测筛选发现指状青霉DY9、DY11、DY12、DY17总基因组中存在真菌基因组额外的核酸片段(图4-A),再次培养这4株指状青霉提取总基因组,用DNase I消化后检测显示,基因组中额外的核酸片段仍然存在,大小约6000 bp (图4-B)。根据该核酸节段的分子量大小和稳定性推测其属于dsRNA,可能与已报道的PdV1病毒基因组同源。于是按dsRNA回收方案纯化该核酸片段作为模板,以PdV1基因组为参考设计引物进行RT-PCR扩增cDNA,再以cDNA为模板扩增跨越病毒PdV1基因组的CP编码基因3′ 端和RdRp编码基因5′ 端的部分序列,扩增产物片段长度为512 bp,电泳检测显示,扩增产物大小约500 bp (图4-C),初步确定这条6000 bp的核酸片段属于与PdV1同源的病毒基因组。进一步将该扩增产物直接测序,获得序列444 bp,通过BLASTx比对显示,该序列与Victorivirus属中的指状青霉病毒1 (P.digitatumvirus 1,PdV1)基因组序列(KU257669.1、KU933932.1)的一致性高达99.7%。综上研究,柑橘采后病原指状青霉DY9、DY11、DY12、DY17菌株中的病毒隶属维多利亚病毒属(Victorivirus)中PdV1同种的不同病毒株。
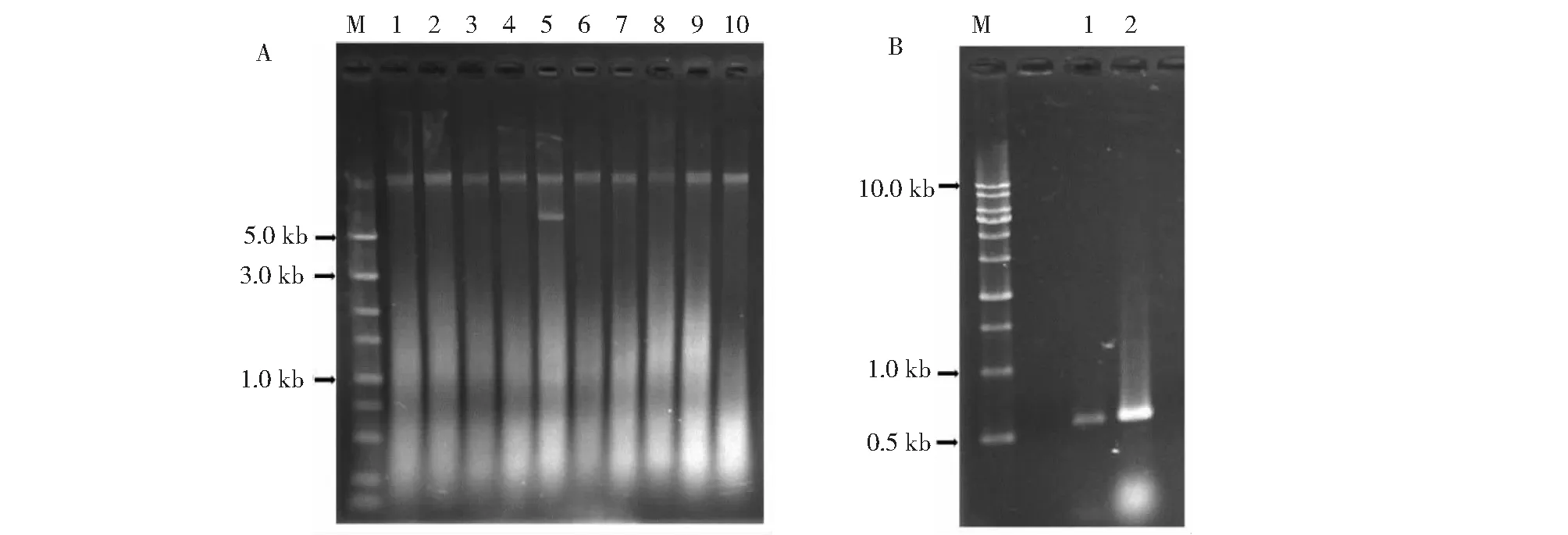
A.青霉菌株的基因组;M.DS5000 DNA marker;1~10.菌株DY2,DY3,DY4,DY7,DY11,DY13,DY15,DY16,DY19和DY20基因组;B.ITS扩增检测;M.1 kb ladder DNA marker;1~2:DY10和DY18的ITS扩增产物。A.Genome of Penicilliumstrains;M.DS5000 DNA marker;1-10.Genome DNA of DY2,DY3,DY4,DY7,DY11,DY13,DY15,DY16,DY19 and DY20 strains;B.The detection of ITS amplification;M.1 kb ladder DNA marker;1-2.ITS PCR products of DY10 and DY18 strains.图2 青霉菌株基因组DNA及ITS扩增产物电泳检测Fig.2 The electrophoresis detection of Penicilliumstrains genomic DNA and ITS PCR product
表3 DY18菌株与已知青霉分离物的ITS信息列Table 3 Information of DY18 strains and public Penicilliumisolates ITS
3 讨 论
柑橘采后的真菌病害多样性丰富,包括绿霉病菌、青霉病菌、酸腐病菌、炭疽病菌、黑腐病菌、褐腐病菌等。其中,青霉菌是柑橘采后的常见真菌病原,尤其是指状青霉和意大利青霉。研究表明,可以侵染柑橘果实的青霉菌还包括乌来青霉、橘青霉、皮落青霉、波兰青霉、扩展青霉、产黄青霉、微紫青霉、杨奇青霉、橘灰青霉、灰黄青霉等[14-17]。不同地区和环境中采样分离的优势病原菌有所不同,闵晓芳等[15]从柑橘储存仓库自然发病柑橘上分离鉴定的波兰青霉分离物比例高达50%(4/8);朱从一[16]从柑橘果园及储存仓库采集腐烂柑橘分离的意大利青霉、皮落青霉和波兰青霉比例分别为38.2%(13/34)、26.5%(9/34)和23.5%(8/34)。本研究从柑橘果园霉烂柑橘上分离的指状青霉和意大利青霉分别为36%(9/25)和64%(16/25),结果显示意大利青霉为柑橘采后优势病原,与朱从一的研究结果较一致[16]。但是,本研究的采样地域单一,样品数量相对较少,系统全面地了解国内不同产地、销售区域柑橘果实霉烂青霉病原种类及其优势病原,需要在进一步扩大采样区域,明确柑橘产地、品种等基础上进行菌株分离鉴定研究。
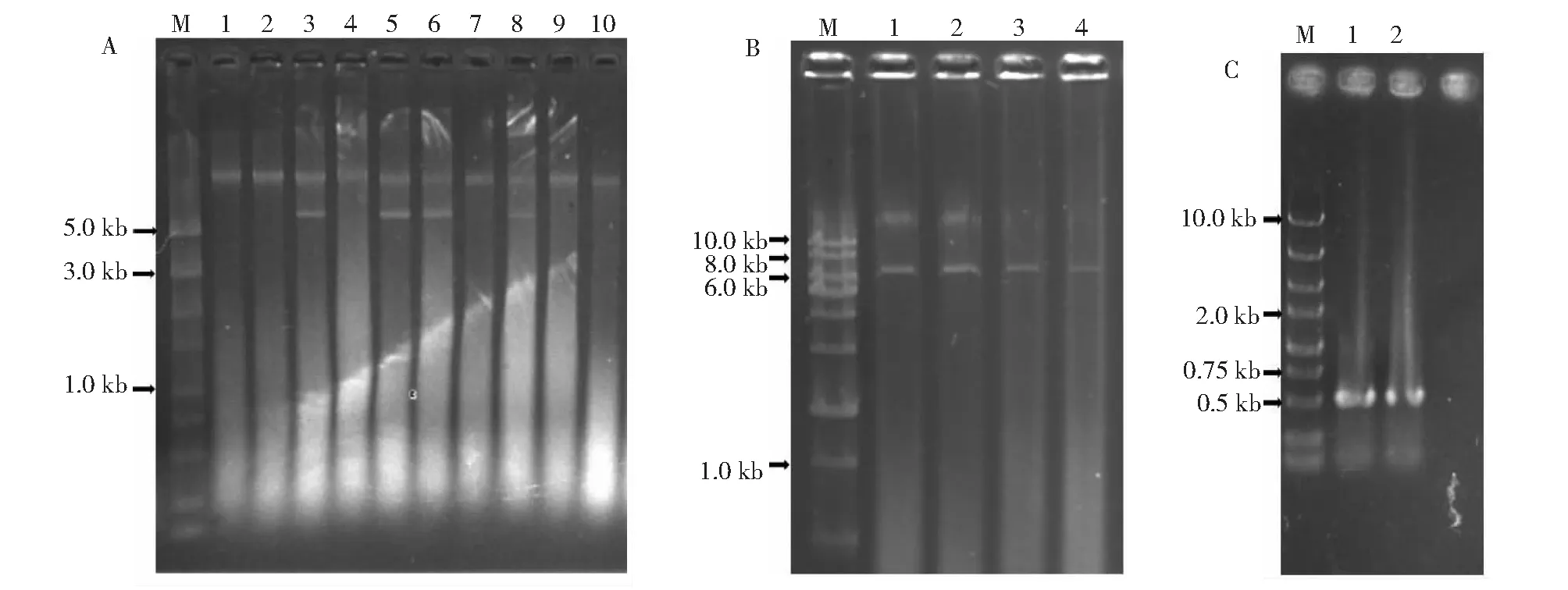
A.青霉菌株总基因组检测;M.DS5000 DNA marker;1~10.DY1,DY5,DY9,DY10,DY11,DY12,DY14,DY17,DY18和DY22菌株总基因组;B.DNase I消化后的菌株总基因组;M.1kb ladder DNA marker;1~4.DNase I消化后的DY9,DY11,DY12和DY17总基因组;C:病毒dsRNA的RT-PCR;M.1 kb ladder DNA marker;1~2.DY9和DY11菌株dsRNA的反转录模板扩增产物。A.Total genome detection of Penicilliumstrains;M:DS5000 DNA marker;1-10.Total genome of DY1,DY5,DY9,DY10,DY11,DY12,DY14,DY17,DY18 and DY22 strains;B.Total genome detection of virus-harboured strains by DNase I digestion;M.1 kb ladder DNA marker;1-4.Total genome detection of DY9,DY11,DY12 and DY17 by DNase I digestion;C.RT-PCR of virus dsRNA;M:1 kb ladder DNA marker;1-2.Amplification products derived from dsRNA cDNA template of DY9 and DY11 strains.图4 指状青霉菌株中病毒筛选及其dsRNA RT-PCR扩增Fig.4 The mycovirus screening in P.digitatumstrains and dsRNA RT-PCR amplification
柑橘青绿霉病侵染引起柑橘采后腐烂是造成柑橘产业经济损失的首要因素。因此,在柑橘采后加工、包装、储运和销售期间使用化学药剂预防柑橘青绿霉病爆发在柑橘产业损失避减中起着重要作用。然而单一靶标化学农药品种的广泛使用,定向诱导了柑橘主要青霉病原指状青霉、意大利青霉和其它可侵染柑橘的青霉菌发生基因突变产生抗药菌株。Wang J L等[18]分离的78株指状青霉中,抗咪鲜胺菌株25株,抗性菌株比例32%,高抗株F6的咪鲜胺EC50约7.5 mg/L。齐婷[19]分离到6株对抑霉唑具有一定抗性的意大利青霉,抗性菌株比列约13%,Zhang等[20]报道的意大利青霉唑类高抗株的咪鲜胺EC50约30 mg/L。朱从一[16]分离到意大利青霉、指状青霉和波兰青霉对咪鲜胺很敏感,EC50均低于3 mg/L,然而大多数的皮落青霉对咪鲜胺有较高的抗性,大多数分离物的咪鲜胺EC50超过1000 mg/L。这些抗药菌株的繁殖和传播产生抗药菌群,严重降低了化学农药的防治效果和增加了柑橘采后青、绿霉病等真菌病害的化学农药防控风险。因此,在柑橘采后真菌病害的防治策略上,除了交叉使用多靶点抑菌剂和开发具有高效、广谱抑菌效果的植物或微生物来源的天然产物,还可以发掘利用具有生物防治潜力的真菌病毒资源,综合利用多种防治手段避免过度使用化学农药引起抗药菌群产生、防治失败、农药残留和食品安全等系列防控风险。
真菌病毒广泛存在于真菌中,多数真菌病毒对宿主影响不大,而一些病毒可减弱宿主真菌的致病能力(弱毒效应),少数病毒可以增加宿主真菌的抗逆水平[21]。板栗疫病菌病毒CHV1和油菜菌核病SsHADV-1病毒等低毒病毒用于防治植物真菌病害的成功[11-12],为弱毒真菌病毒用于真菌病害的绿色防治提供了新的思路。柑橘采后青霉病原中已鉴定的真菌病毒包括指状青霉病毒1[21-22]、指状青霉多重病毒1(P.digitatumpolymycovirus 1)、指状青霉伽玛分病毒1(P.digitatumgammapartitivirus 1)[23]、指状青霉裸露核糖核酸样病毒1(P.digitatumnarna-like virus 1)[24]、皮落青霉产黄青霉病毒1(P.crustosumchrysovirus 1)[25]和意大利青霉产黄青霉病毒1(P.italicumchrysovirus 1)[20]。本研究通过青霉总基因组提取和琼脂糖凝胶电泳检测,筛选发现4株指状青霉基因组中存在病毒dsRNA,采用RT-PCR扩增及其产物测序鉴定了4株指状青霉病毒,与牛玉慧等[21]分离鉴定的PdV1为同种的不同病毒株。PdV1具有较强的弱毒效应,感染指状青霉可显著降低指状青霉对柑橘的致病力。本研究分离鉴定的4株指状青霉病毒为柑橘绿霉病的绿色防治提供了更丰富的生防病毒资源。
4 结 论
本研究从霉烂柑橘表皮分离鉴定意大利青霉16株,指状青霉9株。4株指状青霉寄生有真菌病毒,基因组大小约6 kb,部分核心序列RT-PCR扩增测序将其鉴定为Victorivirus中与PdV1同种的不同病毒株。本研究为柑橘绿霉病的生物防治提供了更丰富的低毒力病毒资源。
——以渤海湾盆地渤海BZ25油田新近系明化镇组下段为例

