施用不同营养液对葡萄果实糖异生途径相关基因表达的影响
沈乐意 王锦阳 陈天池 周伟军 徐 涛 顾一凡 吴月燕,
(1浙江万里学院生物与环境学院,浙江 宁波 315100;2浙江大学紫金港校区农学院,浙江 杭州 310058)
我国是葡萄属(VitisL.)植物基因起源中心之一,全球葡萄属植物种类的60%产于中国[1]。葡萄具有非常高的营养价值,在抗衰老、缓解疲劳以及预防血栓等方面发挥着功效[2]。果实品质一直是葡萄研究的热点,在生产实践中葡萄果实品质评价与成熟期的确定均与果实中糖的含量有关。
糖异生(gluconeogenesis)途径是非糖物质转化为糖的过程[3]。在植物中糖异生的代谢途径主要有两部分(图1)。第一部分有两条平行的代谢通路:第一条代谢途径从草酰乙酸(oxaloacetic acid,OAA)开始在磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)及腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)的作用下生成磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP)及腺嘌呤核苷二磷酸(adenosine diphosphate,ADP)[4-5];第二条代谢途径从丙酮酸(或其脂类及盐类衍生物)开始在丙酮酸磷酸双激酶(pyruvate phosphate dikinase,PPDK)及ATP 的作用下生成PEP 及腺嘌呤核苷单磷酸(adenosine monophosphate,AMP)[6]。由于两条途径生成的产物皆为PEP,所以糖异生在第二部分合并为单一途径,即1,6-二磷酸果糖在1,6-二磷酸果糖酶(fructose-1,6-bisphosphatase,FBP)、葡萄糖-6-磷酸酶(glucose-6-phosphatase,G6P)等作用下生成葡萄糖及其他糖类物质[7-8]。因此,本试验从糖异生途径的相关基因中选择了PEPCK、PPDK、FBP以及G6P四个基因进行研究。
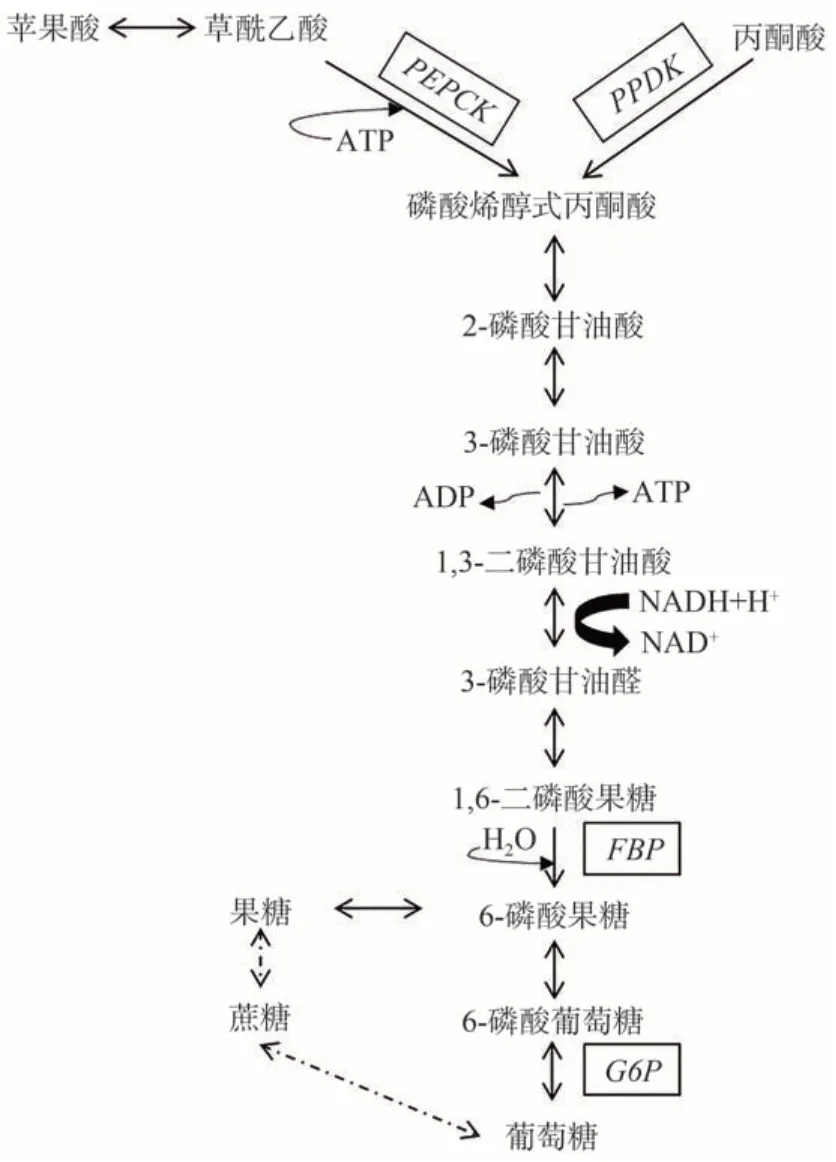
图1 糖异生途径生成糖[7]Fig.1 Sugar production by gluconeogenesis pathway[7]
浇灌营养液是设施葡萄栽培管理中比较常见的提高果实品质的措施,Abo-Ahmedeh等[9]研究发现,营养液的施用可以提高葡萄果实中可溶性固形物的含量。Li 等[10]在番茄中研究发现,温度、湿度等环境因素会影响果实品质,但大量前人研究表明肥料供应是影响果实风味的最重要因素[11-13],且有机肥在改善果实品质方面比无机营养液更有效[14-15]。但近年来在葡萄肥料方面的研究主要集中在N、P、K 肥等单一肥料上,对一些新型的水溶性肥料研究较少[16]。
因此,本研究以鄞红葡萄为试验材料,在葡萄果实第二次膨大期浇灌自主配置的3 种营养液,分别是仅单一含有S、K肥的营养液A,含有Ga、Mg、P、Na等更多无机肥的营养液B,以及有机无机复合的新型水肥营养液C。以浇灌蒸馏水为对照,利用高效液相色谱法(high performance liquid chromatography,HPLC)和实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)技术分别检测葡萄果肉中糖含量和糖异生途径相关基因的表达量,分析果实中糖分形成与糖异生相关基因表达量的关系,以期为进一步深入研究糖异生相关基因调控葡萄果实糖分的形成奠定理论基础。
1 材料与方法
1.1 试验设计
试验材料取自浙江省宁波市镇海区葡萄试验基地(30°N,121°E)。该葡萄园年平均温度16.9 ℃,年均降水量1 374 mm,其中75%的降水量集中在上半年,年均日照时数2 057 h。土层深度102 cm,地下水位55~60 cm,土壤为粘质土,有机质25 g·kg-1,碱性氮202 mg·kg-1,速效磷35 mg·kg-1,速效钾114 mg·kg-1,土壤容重112.3 g·cm-3,pH值6.4。试验所用鄞红葡萄定植于同一连栋式大棚内,大棚面积为6 668 m2左右,4 年生植株。试验期间无裙膜,顶部覆盖无色聚氯乙烯无滴膜,行株距2~3 m,沟深30 cm,宽35 cm,每行定植60株。
试验共设3个处理:T1根系浇灌营养液A、T2根系浇灌营养液B、T3 根系浇灌营养液C,营养液具体成分见表1。5株为一个小区,随机排列,重复3次。于果实第二次膨大期(2020 年5 月24 日)进行第一次处理,之后每隔7 d再进行一次处理(5 月31日、6 月7日),共处理3次。每次处理取不同的营养液10 L对每个小区进行根系浇灌,使用等体积的蒸馏水浇灌作为对照组CK,其他管理保持一致。在营养液浇灌3 次后0、15、25、35 和40 d 分别在处理组与对照组中随机采集形态相近的葡萄果实各9 穗,其中3 穗鲜样用于成熟期判定,剩余样品存于-80 ℃冰箱中用于后续试验。
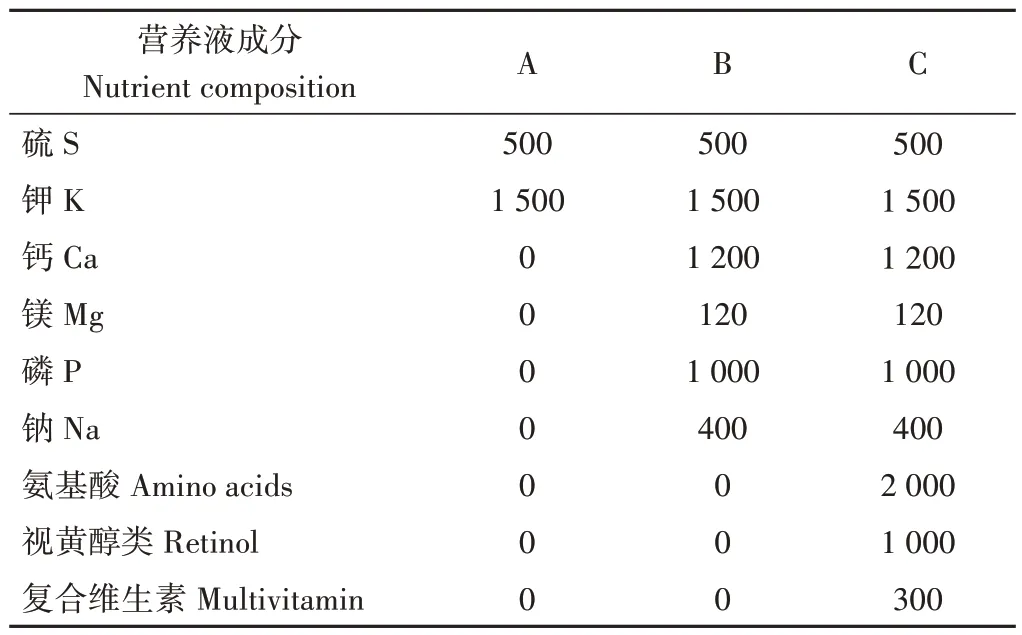
表1 营养液成分表Table1 Nutrient solution composition table /(mg·L-1)
1.2 鄞红葡萄浆果成熟期判定
蔬果的果皮颜色常与果实中可溶性固形物含量相关联,生产实践中常利用直观的表皮颜色变化来判断蔬果的成熟度[17-18]。本研究通过测定葡萄果实的红绿值来判断果实的成熟期。每个时期随机取3 穗果实,每穗果实顶端、中间和底部随机取15 粒浆果,测定部位需涵盖整个果实,包括4 个侧面和底部。参照文献[19]的方法采用CR-400便携式色差仪(日本柯尼卡美能达公司)测定葡萄果实色差,计算每粒葡萄果实的红绿值(a*):当a*≤0时,认定该葡萄果实属于绿色未进行转色,当0<a*<15 时,认定该葡萄果实开始进入转色期。当15≤a*<20 时认定其转色完成,当a*≥20 时认定其成熟过度,达到了过成熟期。在生产实践中,当一穗葡萄中未转色浆果小于5%,成熟与过成熟浆果大于70%时,表示已经成熟,达到了上市标准。
1.3 果实糖含量的测定
处理与对照每组随机选取形态相近的3 穗果,每穗选取9粒果实,进行3次生物学重复试验。糖分的前处理与色谱条件参考文献[20]的方法。预先将离心管、药匙、研钵用液氮进行冷却,水浴锅进行80 ℃预热。从-80 ℃冰箱中取出样品剥皮,取适量果肉放入研钵中加入液氮迅速研磨成粉末后称取3次1 g粉末于3个离心管中,加入5 mL双蒸水后震荡混匀。在80 ℃的水浴锅中水浴加热30 min,冷却至室温后放至离心机中以25 ℃、4 200 r·min-1条件下离心30 min,取5 mL上清液于新的干燥离心管中。在滤渣中加入4 mL 双蒸水重复提取一次,合并上清液,双蒸水定容至10 mL,用0.22 μm的一次性水系滤膜过滤于进样瓶中,做好标记,保存于4 ℃环境下,待测。高效液相色谱条件:ACQUITY UPLC BEH Amide 柱子(100 mm×2.1 mm,1.7 μm,美国沃特世公司);检测波长210 nm;流动相乙腈:水(70:30,v/v),流速1.0 mL·min-1;柱温35 ℃;进样量10 μL。
1.4 总RNA的提取及荧光定量PCR
在NCBI 上搜索并获取PEPCK(登录号:XM_003635619.3)、PPDK(登录号:XM_010651529.2)、FBP(登录号:XM_002269194.3)和G6P(登录号:EC366533.1)基因的序列,用Primer 5.0 设计荧光定量引物,引物由擎科合成(表2)。处理与对照每组随机选取形态相近的3 穗果,每穗随机选取3 粒单果,根据多糖多酚植物总RNA 提取试剂盒(北京天根生化科技有限公司)说明书对剥皮后的葡萄果肉进行总RNA的提取。Spectra Max190 全波长酶标仪(北京龙跃生物科技发展有限公司)上测定RNA 浓度、OD260/280和OD260/230。以总RNA 为模板,利用cDNA 合成试剂盒(苏州近岸蛋白质科技有限公司)进行反转录与纯化,选择葡萄Actin作为内参基因。qRT-PCR 反应体系为20 μL:100 ng·μL-1cDNA 0.4 μL,上游引物和下游引物各0.4 μL,2×NovoStart®SYBR qPCR SuperMix Plus 10 μL,RNase Free Water 8.8 μL。每个模板设3 次技术重复,取平均值。采用2-ΔΔCT法[21]进行定量数据分析。

表2 qRT-PCR引物序列Table 2 Primer sequences of qRT-PCR
1.5 数据统计与分析
通过Excel 2010 进行图表制作,通过SPSS 19 软件进行差异显著性分析,采用Origin 2022 软件进行相关性分析。
2 结果与分析
2.1 营养液施用对葡萄果实成熟期的影响
由图2 可知,对照组和处理组在6 月7 日均开始转色。CK在7月17日基本完成转色。T1在7月12日有超过50%的葡萄完成转色,5 d 后全部转色完成。T2在6月22 日约50%的葡萄完成转色,7 月12 日后的葡萄呈深紫红色。T3 在6 月22 日完成转色的葡萄超过50%,与CK以及其他处理组相比,明显最早完成转色。

图2 不同时期果实的发育状况Fig.2 Fruit development in different periods
结合图3可知,CK在处理后25 d加速成熟,到35 d成熟期浆果占47.06%。T1 处理组葡萄浆果成熟期的变化与CK的趋势基本一致,但处理后35 d,T1的成熟期浆果较CK 增加了8.5个百分点。处理后40 d,T1成熟期浆果占60.87%,多于CK的54.16%。而T2用营养液B处理后35 d,成熟期浆果占比高达61.9%,与CK 和T1相比,T2 成熟期明显提早。T3 在施用营养液C 后,未转色的葡萄占比明显降低。营养液C 处理后25 d,成熟期浆果占比超过70%,在所有处理中早熟效果最为明显。综上,施加营养液能够在一定程度上影响葡萄的成熟期。
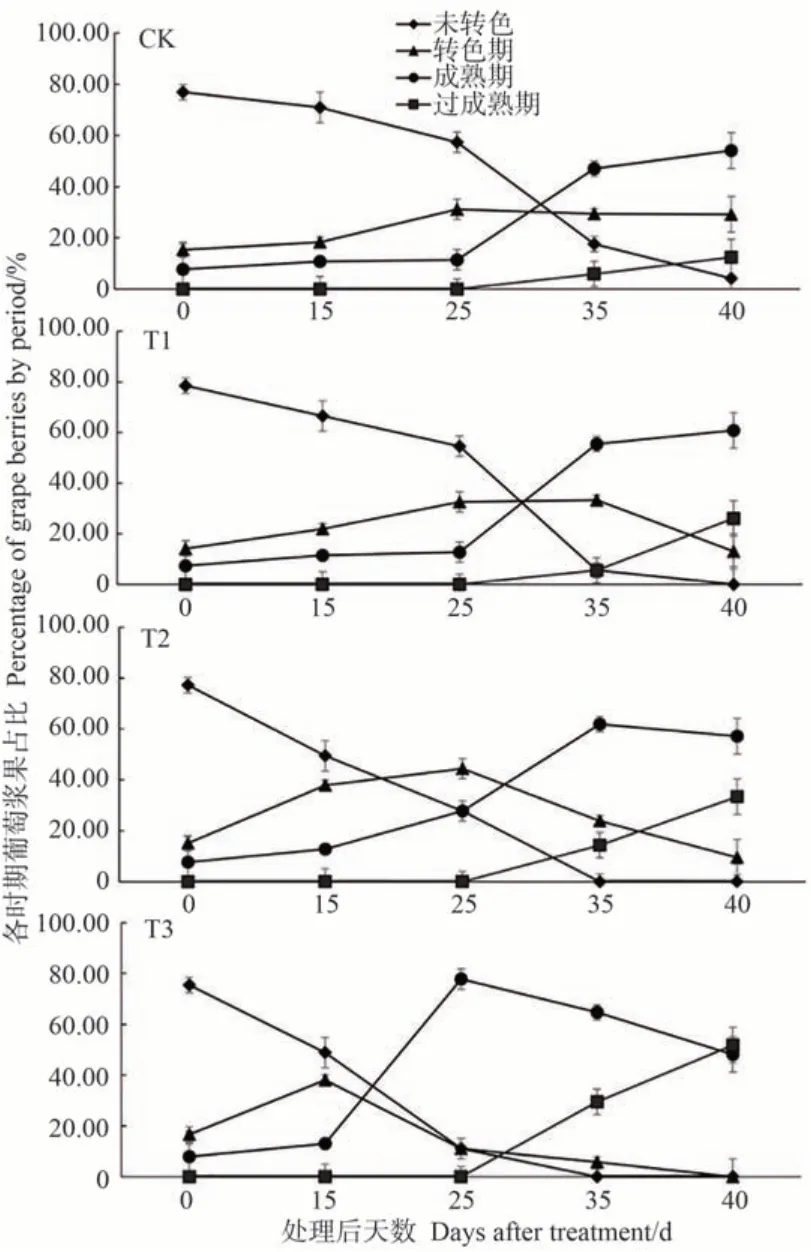
图3 不同营养液处理对葡萄生理周期的影响Fig.3 Effect of different nutrient treatments on the physiological cycle of grapes
2.2 营养液的施用对葡萄果实糖含量的影响
用HPLC 对鄞红葡萄果肉中的葡萄糖(glucose,Glu)、果糖(fructose,Fru)和蔗糖(sucrose,Suc)含量进行测定。图4-A、B为Glu、Fru和Suc的混合标准品溶液的色谱图,其中Glu的保留时间为5.85 min,Fru的保留时间为5.05 min,Suc 的保留时间为8.07 min。图4-C、D为样品色谱图,出现与标品中葡萄糖、果糖保留时间一致的峰,但保留时间8 min 附近未出现峰,说明样品中不存在Suc或者Suc含量低至可以忽略,但能较好地提取并检测到Glu 和Fru。以标准样品浓度为横坐标,对应峰面积为纵坐标,绘制标准曲线,得到Glu 的线性回归方程:y=262.739x-28 577.0,相关系数R2=0.991 4;Fru 的线性回归方程:y=247.025x-29 939.1,相关系数R2=0.991 4,表明标准曲线线性良好,能对样品中的糖含量进行定量分析。
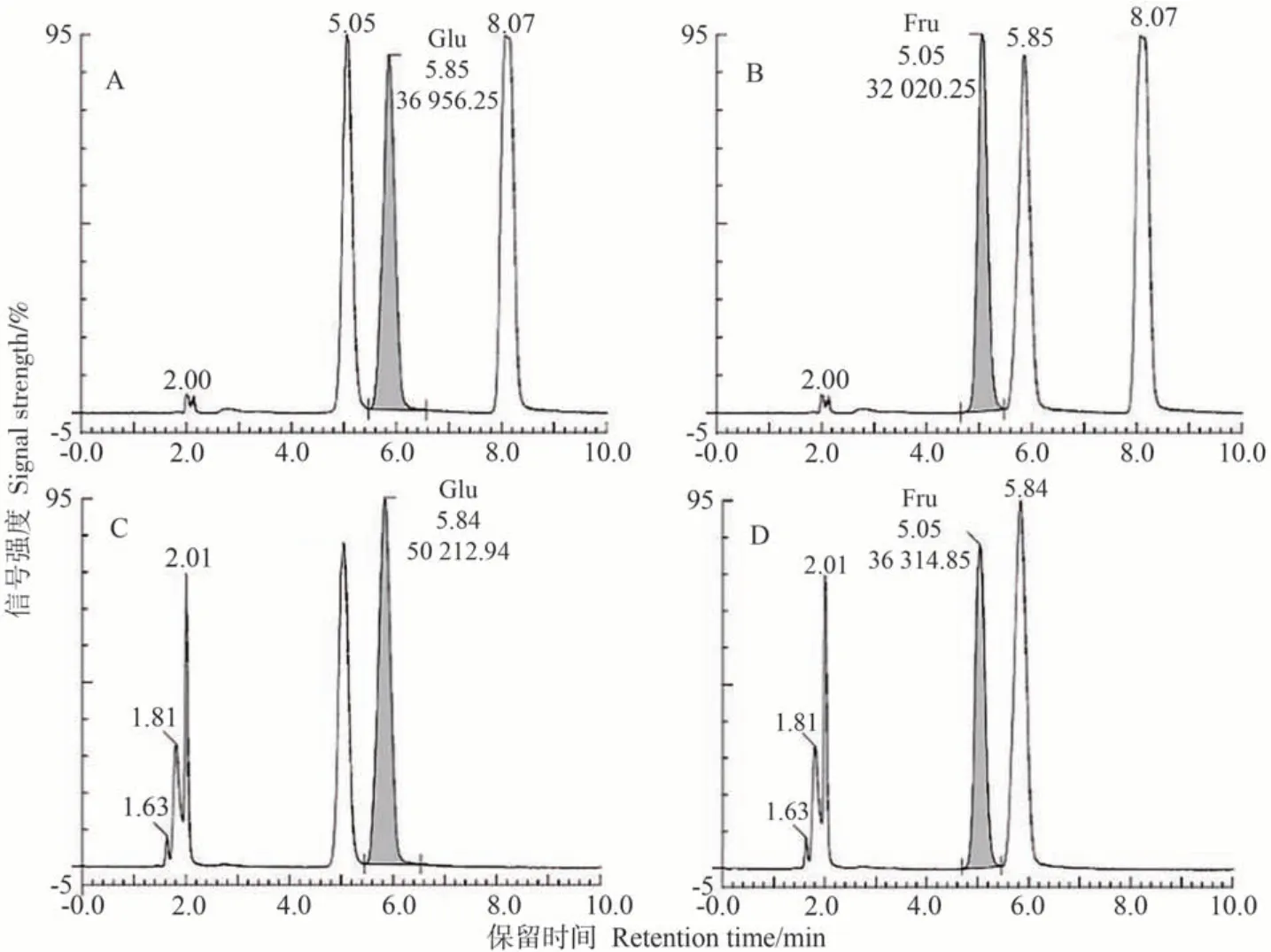
图4 葡萄糖标准品(A)、果糖标准品(B)及试验样品(C、D)色谱图Fig.4 Chromatogram of glucose standard (A),fructose standard (B) and test samples (C,D)
由图5可知,在葡萄果实中,Glu含量大于Fru含量。处理后15 d 内,Glu 和Fru 的含量急剧增长,即随着葡萄果实的成熟而增长。到40 d 前后,果实中的Glu 和Fru 均呈略微下降趋势,但仍比第25 天的糖含量高。不同处理对果实糖含量的影响存在差异,营养液A、B、C的施用均能增加葡萄果实中的糖含量,其中营养液C的效果最佳。在营养液处理后的前15 d,组间Glu含量无显著差异,但Fru含量T3与CK相比差异显著。25 d时,T3 的Glu 含量显著高于CK 和T1,而Fru 含量组间无显著差异。35 d 时,T3 的Glu 和Fru 含量均达到最大,分别为126.477 和108.966 mg·g-1。40 d 后,不同处理的Glu和Fru含量均略有下降。
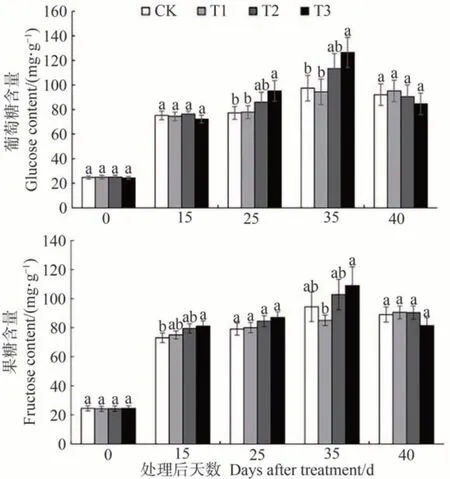
图5 营养液浇灌对果实葡萄糖和果糖含量的影响Fig.5 Effect of nutrient solution watering on glucose and fructose content of fruits
2.3 营养液的施用对糖异生相关基因表达量的影响
由图6 可知,在营养液处理后15 d 内,糖异生相关基因的表达均上调。25 d后,PPDK和G6P的表达开始下调,而PEPCK、FBP在35 d 后才开始下调。营养液处理后15 d,PEPCK和FBP基因的表达明显上调,处理组的基因表达水平显著高于CK。处理后25 d,处理组的PEPCK、FBP和G6P基因表达水平均高于CK,其中T3的糖异生相关基因PEPCK、PPDK、FBP和G6P的表达量均达到营养液处理后40 d 内的最大值。结合图5 分析可知,当T3 的糖异生相关基因表达水平达到峰值后,Glu、Fru 含量开始大幅度增长。35 d 时,T3 的Glu、Fru 含量达到最大,PEPCK、PPDK、FBP和G6P的表达开始下调,糖含量随之降低。但T1、T2 的糖异生相关基因调控Glu、Fru含量无明显规律,推测T1、T2基因表达的峰值可能出现在25~35 d之间。处理后40 d,CK 的PEPCK和FBP的表达水平均高于T2、T3,而PPDK和G6P的表达水平与处理组相比无显著差异。
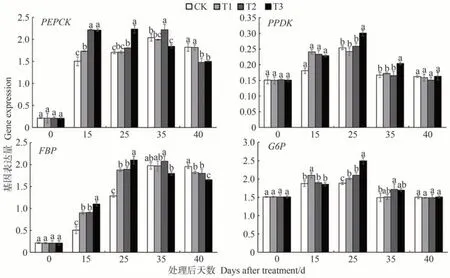
图6 营养液浇灌对果实糖异生相关基因表达量的影响Fig.6 Effect of nutrient solution watering on the expression of glucose xenobiotic-related genes in fruits
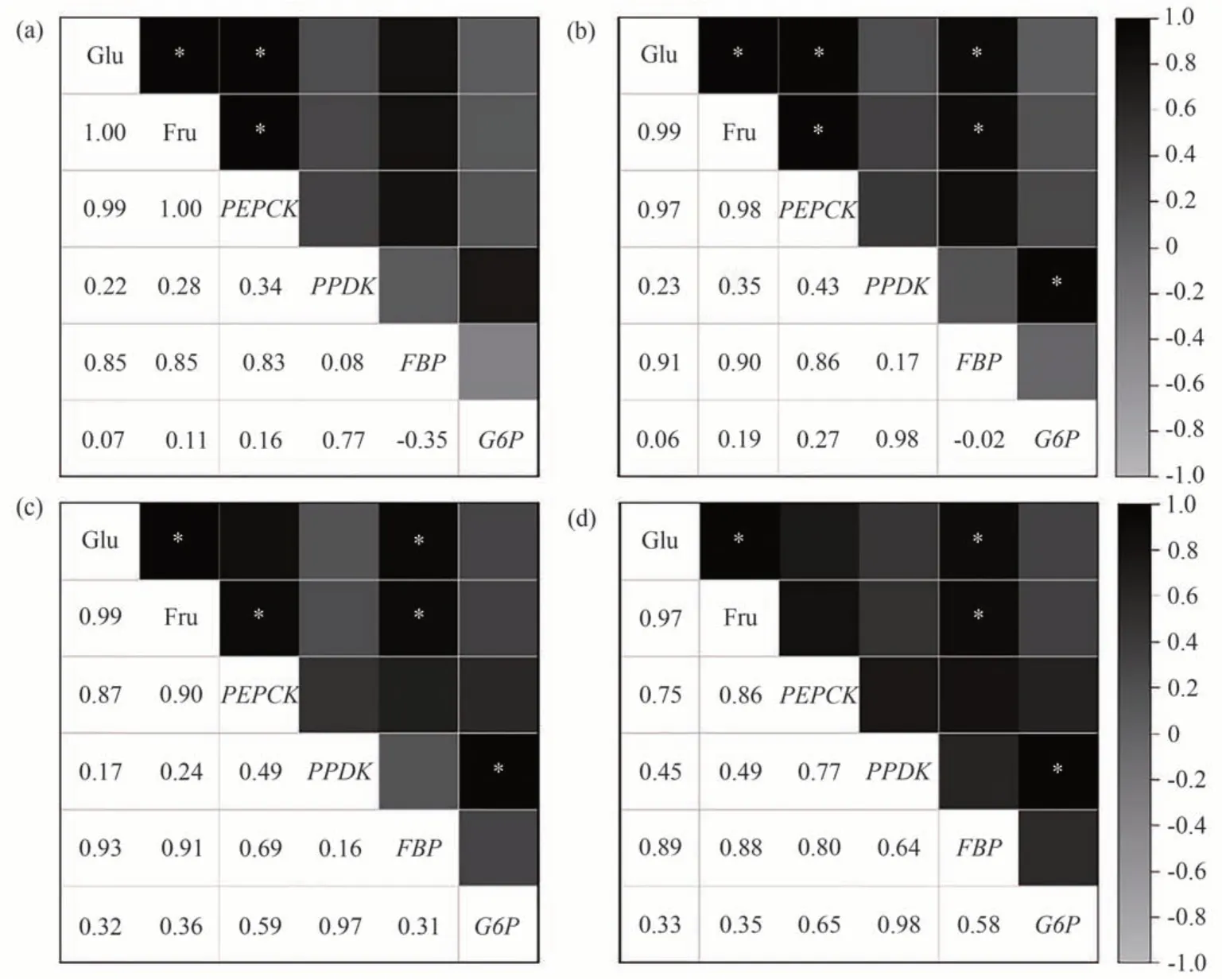
图7 不同处理下果实糖含量与糖异生相关基因表达量的相关性分析Fig.7 Correlation analysis of fruit sugar content and expression of gluconeogenesis-related genes under different treatments
2.4 果肉中糖含量与糖异生相关基因表达量的相关性分析
葡萄果肉糖含量与糖异生相关基因表达量的相关性分析结果表明,在果实成熟过程中,糖分的形成与糖异生相关基因的表达具有一定的相关性。CK 的PEPCK基因表达量与Glu、Fru 含量呈显著正相关,相关系数为0.99和1.00,Glu与Fru含量的相关系数为1.00。T1中PEPCK和FBP基因与Glu含量呈显著正相关,相关系数分别为0.97和0.91,同时与Fru含量呈显著正相关,相关系数分别为0.98和0.90。而PPDK与G6P的表达量之间呈显著正相关,与葡萄糖、果糖含量的相关性均不显著。T2中FBP基因的表达量与Glu、Fru含量呈显著正相关,相关系数分别为0.93和0.91,但PEPCK基因的表达量仅与Fru含量呈显著正相关。T3中仅FBP基因与Glu、Fru含量呈显著正相关,PEPCK基因的表达量与Glu、Fru 含量的相关性不显著。综上,PEPCK、FBP、PPDK和G6P基因表达与糖含量均呈正相关,但PEPCK和FBP与糖含量相关系数更高。其中CK、T1中PEPCK的表达量与葡萄糖、果糖呈显著正相关,T1、T2、T3中FBP的表达量与葡萄糖、果糖呈显著正相关。与CK相比,施用营养液后FBP的表达与Glu、Fru含量的相关性更强。
3 讨论
在多肉水果中,可溶性糖是果实生长发育所必需的成分,其含量是评价果实品质的核心指标[22]。糖分积累是果实品质形成的关键,决定了葡萄的市场价值[23]。目前,外源营养液的灌施是设施葡萄栽培中常见的提高果实糖含量的方式之一。本研究中,浇灌营养液后的葡萄果实提早转色:施用营养液C 后25 d 葡萄成熟期浆果占比超过70%,Glu、Fru 的含量较CK 提高了23.17%、10.19%;35 d 时,Glu、Fru 的含量达到最高,推测适宜外源营养物质的补充有助于提高果实中的糖含量,促进果实提早成熟,这与Wu 等[24]在甘蔗中的研究结果一致。此外,灌施有机无机复合营养液C后25 d,与同时期CK 相比,糖异生相关基因PEPCK、PPDK、FBP、G6P的表达均显著上调,且施加营养液后FBP基因的表达量与Glu、Fru含量显著相关。因此,推测外源营养物质的施加还可能促进糖异生通路中相关基因表达的上调。
前人研究发现,糖异生相关基因的表达是代谢途径中重要的调控因素,其中PEPCK在果实成熟过程调控糖类物质的形成[25],FBP是植物糖异生途径的关键调控基因,对果实发育过程中糖分合成有一定调控作用[7,26]。研究发现,干扰生长发育阶段马铃薯(Solanum tuberosumL.)块茎中FBP基因的表达可造成糖含量降低[27],与本试验葡萄果实中FBP表达上调促进糖含量增加的结论一致。对金桔(Citrus japonicaThunb.)、柑橘(Citrus reticulataBlanco.)进行转录组、基因组测序的结果也说明了PEPCK和FBP是可溶性糖积累差异相关的基因,磷酸烯醇式丙酮酸羧激酶和1,6-二磷酸果糖酶参与糖类物质的形成[28-29]。在本试验中,糖异生相关基因的表达在施用营养液C 后,均呈现不同程度的上调,其中PEPCK和FBP基因的表达较CK 提早10 d达到峰值。在营养液C处理后25 d,各基因的表达量达到最大,10 d 后,葡萄果实中Glu 和Fru 的含量达到峰值。说明施用营养液C 可以有效促进PEPCK和FBP基因的表达上调,并正向调控果实中的糖含量。
在本试验中,PPDK的表达量较糖异生其他相关基因明显偏低,且该基因与糖含量的相关性不显著。Walker 等[30]在樱桃果肉中未检测到PPDK基因的表达,Famiani 等[31]在赤霞珠、霞多丽以及亚历山大麝香葡萄果皮中均未检测到PPDK,这表明PPDK在浆果类水果中存在丰度较低,与本研究结果相符。葡萄糖-6-磷酸酶催化6-磷酸葡萄糖水解为葡萄糖和无机磷酸盐[32],是动物体内平衡葡萄糖含量的一个关键酶,但目前在植物中鲜有研究。本研究发现,G6P基因在葡萄果实中高表达,随着果实成熟G6P基因的表达水平变化不大,且G6P基因的表达量与葡萄果肉中Glu、Fru含量的相关性均不显著,推测G6P基因在浆果类植物中没有直接起到促进糖类物质形成的作用。综上可知,外源营养液的施加对PPDK和G6P基因表达的影响远小于PEPCK和FBP基因,同时在果实软化着色过程中PPDK和G6P基因表达量的变化较小。结合相关性分析结果,即PPDK和G6P基因的表达量与糖含量的相关性较低,说明PPDK和G6P基因可能无法调控葡萄果实中的糖含量或作用较小。
4 结论
本研究结果表明,营养液的施用能有效提高果实成熟期的糖含量,其中有机无机复合的新型水肥营养液C的效果最优。营养液处理显著提高了转色期果实中PEPCK、FBP基因的表达水平,对PPDK和G6P基因的影响不显著。PEPCK和FBP的表达量与葡萄糖、果糖含量呈正相关。综合来看,施用营养液C 后35 d 为采收鄞红葡萄最佳时间,此时成熟与过成熟果实的果粒达94.18%,葡萄糖含量达126.477 mg·g-1,果糖含量达108.966 mg·g-1。

