盐生植物解磷菌的筛选及促生效应研究
李 静 李明源 张 甜 周 茜 王继莲
(喀什大学生命与地理科学学院/新疆帕米尔高原生物资源与生态重点实验室,新疆 喀什 844000)
盐渍土具有电导率高、水势低、离子盐分过多等特点,其恶劣的理化性质使绝大多数植物难以存活,成为作物生产的最大制约因素之一[1-2]。过去的几十年里,人类不合理的开发活动进一步加剧了盐渍土的形成和土壤次生盐渍化的发展趋势[3]。而土壤养分转化是盐渍土植被生长及其生产力的主要限制因素之一[4],尤其磷素是限制植物生长的第二大营养元素,参与植物的能量转移、信号转导及光合作用[5]。农业生产中经常施用过磷酸钙等化学磷肥补给磷元素,但施用后的磷肥当季利用率仅有10%~20%[6],大部分的磷与Ca2+、Fe2+、Fe3+、Al3+等金属离子结合,形成难溶性磷酸盐,不易被植物直接吸收利用[7-8]。这不但造成巨大的资源浪费,还导致土壤板结度加重,土壤性质进一步恶化[9]。
解磷菌(phosphate solubilizing microorganisms,PSM)是一类能将难溶性或不溶性的磷酸盐分解为可溶性磷,以供植物吸收利用的功能微生物。最早的商品化解磷菌制剂是前苏联筛选出的一株巨大芽孢杆菌Bacillus megateriumvar.phosphaticum,于1947年开始量产应用[10]。国内也相继开发出了由多种芽孢杆菌组成的复合解磷微生物肥料。目前报道的解磷菌以细菌居多,还包括少数的解磷真菌及放线菌。解磷菌剂应用至盐碱土壤可显著改善土壤性质及结构,促进植株生长,进而提高农作物的产量和品质。如分离自棉花根际的枯草芽孢杆菌Bacillus subtilisQ3 及类芽孢杆菌属PaenibacillusQ6,能在盐胁迫下有效定殖于棉花根部,对根冠比产生积极影响[11];分离自滨海盐碱地植物根际的芽孢杆菌Bacillussp.T1-8 和T4-9 的接种显著增加了盐碱地玉米产量[12]。可见,通过接种解磷菌剂提高植物耐盐性是一种有效应对土壤盐渍化的方法。但很多解磷菌对环境条件存在依赖性,其作用范围也不同,导致从一个区域分离的解磷菌株在其他宿主植物或地理区域不具备普适性。因此,持续开展PSM 资源的分离筛选依然是开发增强作物抗逆性微生物肥料的有效手段。
新疆地处欧亚大陆腹地,降雨量少,蒸发强烈,是我国最干旱、盐渍化类型最多、土壤积盐最重的地区[13]。北部土壤中的盐以硫酸盐或氯化物-硫酸盐为主,伴随碱化过程;南部土壤以氯化物或硫酸盐-氯化物为主,南北疆苏打化土壤均分布广泛[14]。新疆盐碱地遍布,其中却蕴藏着丰富的微生物多样性,如分离自七角井盐湖和南湖碱湖土壤中的极端嗜盐菌多达1 679 株,隶属于5 门14 个属[15];分离自乌尔禾地区盐渍土壤中的细菌物种有445 种,分属于24 个门、126 个目、410 个属[16]。可见,新疆多样的耐盐碱微生物类群为盐碱土壤改良提供了丰富的菌种资源。而新疆南部的盐渍化耕地占比远高于北部,加之干旱少雨,沙尘灾害天气频繁,是新疆盐渍化治理的核心区域[17]。本研究从新疆南部克孜勒苏柯尔克孜自治州盐碱地3 种典型盐生植物中筛选解磷菌,并通过接种至植物验证其对植株生长及根系发育的影响,旨在挖掘耐盐碱的解磷菌种资源,为研制适用于盐碱地植物促生的微生物肥料奠定基础。
1 材料与方法
1.1 研究区概况及样品采集
研究区位于新疆克孜勒苏柯尔克孜自治州(76°36′32″E,39°47′58″N),该地区全年干旱少雨,昼夜温差大,日照时间长,年均气温9.8 ℃,年均降水量33.8 mm,年均蒸发量近乎降水量的100 倍。土壤pH 值为8.0~8.5,全盐含量11.9 g·kg-1。植被以盐节木(Halocnemum strobilaceum)、盐穗木(Halostachys caspica)、旱生芦苇(Phragmites communis)、骆驼刺(Alhagi sparsifolia)、盐生草(Halogeton glomeratus)等耐盐碱植物为主[18]。2021年10月,采集该地区芦苇、盐穗木、盐节木三种植物根系样本,深挖取出整株根系,抖落与根系附着松散的土壤后封装于自封袋,于4℃条件下运回实验室。
盆栽试验所用土壤采集自未开垦的盐碱地,pH 值8.41,全盐含量1.92 g·kg-1,碱解氮、速效钾和有效磷含量分别为24.52、109.14、16.05 mg·kg-1,全磷含量362.12 mg·kg-1,有机质含量15.10 g·kg-1。
1.2 培养基
解有机磷菌株筛选采用蒙金娜(Mongina)培养基[19]:葡萄糖10 g、(NH4)2SO40.5 g、KCl 0.3 g、MnSO4·4H2O 0.03 g、NaC1 0.3 g、FeSO4·7H2O 0.03 g、CaCO35.0 g、酵母粉0.4 g、琼脂18 g、卵磷脂0.2 g,加蒸馏水至1 000 mL。
解无机磷菌株筛选采用NBRIP(National Botanical Research Institute′s phosphate)培养基[20]:葡萄糖10 g、Ca3(PO4)25 g、KCl 0.2 g、(NH4)2SO41 g、MnSO4·H2O 0.25 g、MgC12·6H2O 5 g、琼脂15 g,加蒸馏水至1 000 mL。
菌种保藏与活化采用LB(Luria-Bertani)培养基:蛋白胨10 g、酵母膏5 g、NaC1 10 g、琼脂20 g,加蒸馏水至1 000 mL。为利于耐盐碱菌种筛选,培养基pH 值均调节至8.0~8.5。
1.3 解磷菌的筛选及纯化
1.3.1 根际土壤解磷菌 土壤样品分根际土和土体土,土体土为抖动根系掉落的与根系结合较松散的土壤,根际土为用刷子小心收集的与根表粘附较紧密的土壤。精准称取1 g 土壤样品,加入装有9 mL 无菌生理盐水的试管中,180 r·min-1振荡30 min 得到土壤悬液。采用10 倍序列稀释法对土壤悬液进行适度稀释,取不同稀释度的样品100 μL 分别涂布于Mongina 和NBRIP 平板上,每个梯度重复3 次。28 ℃倒置培养3~5 d,观察并记录溶磷圈形成情况,挑取能形成明显溶磷圈的菌落进行划线纯化。
1.3.2 根内解磷菌 在超净工作台中剪下根系,用无菌水洗根2 次,再用石蜡封堵根上切口,以0.1%的HgCl2消毒5 min 后用无菌水反复冲洗,最后用无菌滤纸吸干根表水分。剪去被石蜡封堵的根系端口,称取1 g 样品在无菌研钵中研磨成泥状,转至装有9 mL 无菌水的试管中涡旋2~3 min。取上清进行梯度稀释并涂布,同上述方法分离、纯化根内解磷菌株。
1.4 解磷能力测定
采用钼锑抗比色法绘制磷标准曲线[21]。取阳性菌株以1%接种量分别接种至30 mL 的Mongina 和NBRIP液体培养基,28 ℃振荡培养7 d,离心取上清,以钼锑抗比色法测定有效磷含量,同时测定发酵液pH值,分析有效磷含量与发酵液pH值的相关性。
1.5 菌株鉴定
采用细菌基因组提取试剂盒(北京天根生化科技有限公司)提取菌株基因组DNA,以通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)扩增16S rRNA 基因序列。PCR 产物经限制性核酸内切酶Msp Ⅰ和Hae Ⅲ酶切,分析酶切数据并挑选代表菌株送由生工生物工程(上海)股份有限公司完成测序。测序结果提交EzBioCloud 数据库比对,选取同源性高的模式菌株序列用MEGA 11.0 软件以邻接(Neighbor-Joining)法构建系统发育树,Bootstrap值为1 000。
1.6 植物促生试验
以喀什大学生命与地理科学学院植物学实验室惠赠的哥伦比亚野生型拟南芥和喀什种子公司市售新冬20号小麦为供试植物,分别进行非盐碱/盐碱环境下的盆栽接种试验。供试菌株为解有机磷和无机磷能力较强的5株菌。
1.6.1 拟南芥接种试验设计 拟南芥种子经1%次氯酸钠浸泡10 min,去离子水冲洗4~5 次。用无菌牙签将种子点入装有基质的育苗盘中,并覆保鲜膜,待拟南芥生长至4 叶期时以灌根方式进行接种。处理组接种供试菌株培养液和灭活培养液,对照(CK)接种等量LB 液体,每个处理3 个重复。供试菌液浓度统一调为108CFU·mL-1,每隔7 d 灌根一次,于光照培养室中25 ℃、光照14 h/黑暗10 h 培养。统一管理30 d 后收获,分别测量株高、地上干重、根长、根干重等指标,分析接种处理对非盐碱胁迫下拟南芥生长的影响。
1.6.2 小麦接种试验设计 将供试盐碱土与基质按3∶1 的比例混合,高压灭菌后装盆待用。小麦种子同样清毒处理后,挑选大小一致、颗粒饱满的种子于水琼脂平板上催芽。挑选芽长一致的种子移栽,每盆栽种9 株,待幼苗长至4~5 cm 时同上述方法接种处理。统一管理30 d 后收获植株测定相关指标,并采用乙醇浸泡法[22]测定叶绿素含量,评价解磷菌对盐碱土中小麦的促生效果。
1.7 数据处理
采用SPSS 19.0和Origin 2021软件对试验数据进行方差分析和绘图,通过Pearson相关性分析有效磷含量与发酵液pH值的关系。所有数据以平均值±标准差表示。
2 结果与分析
2.1 解磷菌筛选及溶磷能力测定
采用Mongina 和NBRIP 培养基,从芦苇、盐穗木、盐节木根际、根内及土体中共筛选到141 株解磷菌,其中解无机磷菌株100株,解有机磷菌株128株(表1)。分离自盐穗木的菌株(62 株)数量约为芦苇的1.8 倍、盐节木的1.4倍,且根际菌株的数量远多于根内及土体。
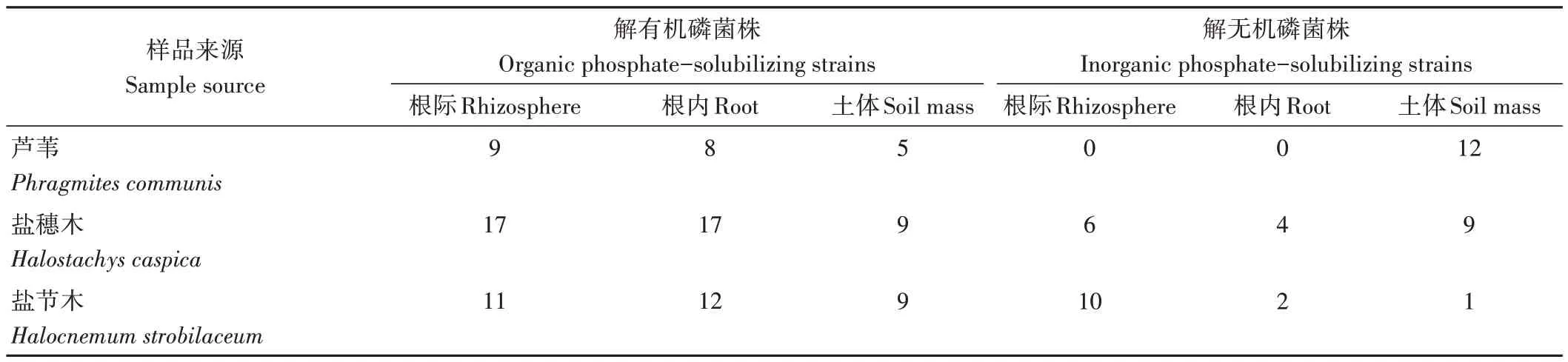
表1 溶磷菌株的分离结果Table 1 Isolation results of phosphate-solubilizing strains
由图1 可知,解有机磷菌株的解磷率介于1.5%~7.6%之间,以MHCB30的解磷率最大,发酵液pH值介于5.32~7.54 之间。解无机磷菌株的解磷率介于1.1%~4.7%之间,以APCB2的解磷率最大,发酵液pH值介于4.52~4.85 之间。Pearson 相关性分析表明,菌株的解有机磷能力与发酵液pH 值无明显对应关系(R2=0.002 7,P<0.05)。而解无机磷能力与pH 值呈显著负相关(R2=0.848 5,P<0.05),pH 值越小,解磷能力越大。
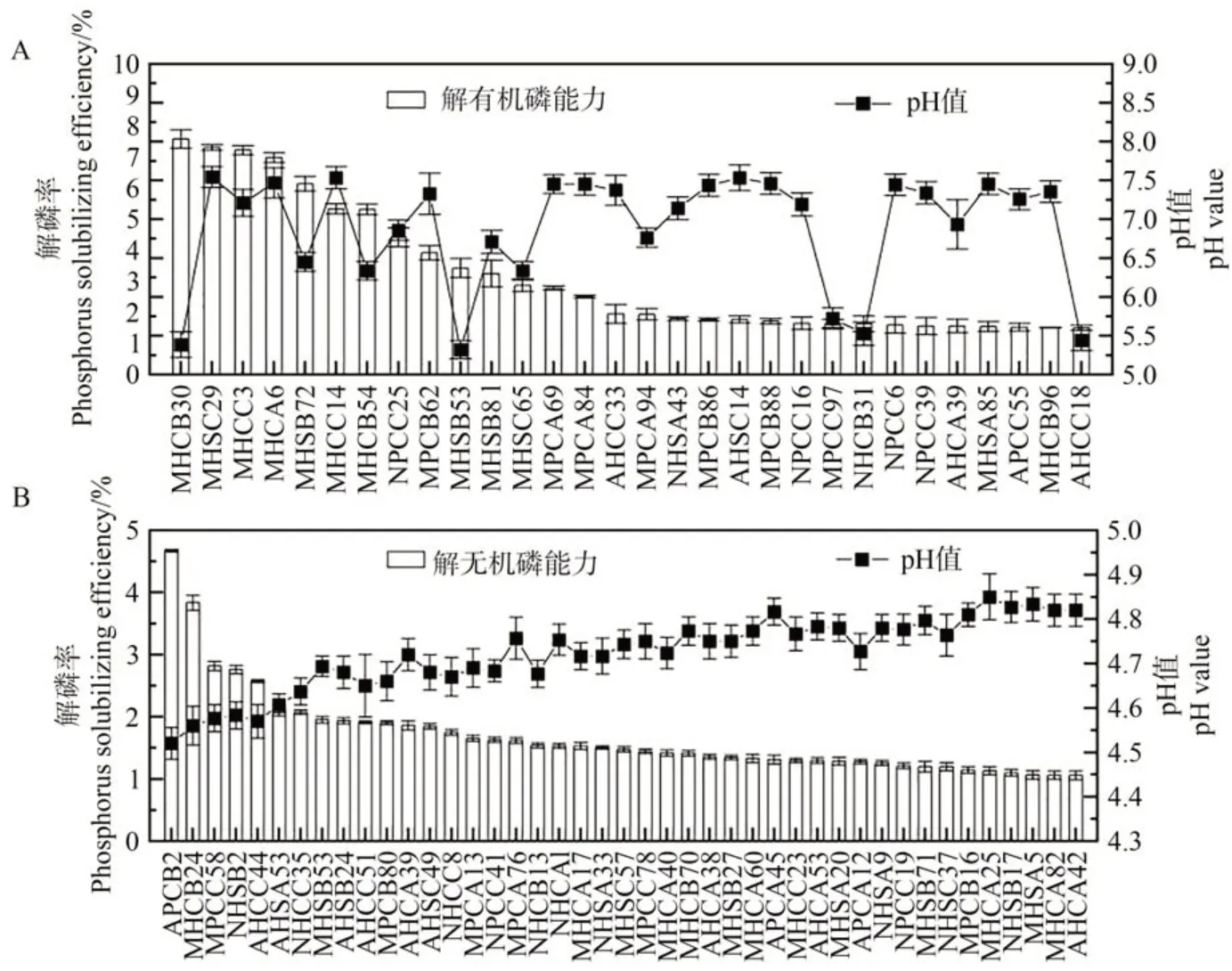
图1 pH值与解磷能力相关性Fig.1 Correlation between pH value and phosphorus solubilizing efficiency
2.2 菌株鉴定
141株菌株经16S rRNA的限制性片段长度多态性(PCR-restrictionfragment length polymorphism,PCRRFLP)分析后,共选取32 株进行16S rRNA 基因测序。如图2 所示,所有菌株分属8 个属,以肠杆菌属(Enterobacter)为绝对优势属,占总菌数的46.9%;埃希氏菌属(Escherichia)有6株,占总菌数的18.8%;类芽孢杆菌属(Paenibacillus)有4株,占总菌数的12.9%;不动杆菌属(Acinetobacter)有3株,占总菌数的9.7%;嗜冷杆菌属(Psychrobacter)、农杆菌属(Agrobacterium)、嗜盐单胞菌属(Halomonas)及微小杆菌属(Microbacterium)均有1株,占总菌数的3.2%。
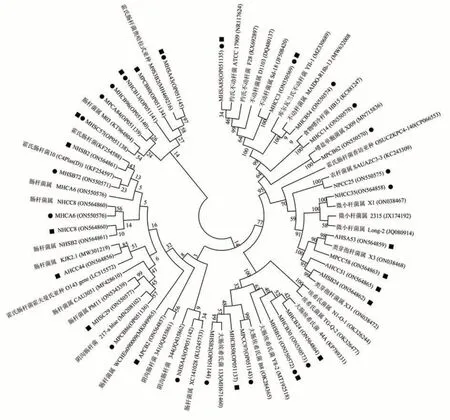
图2 解磷菌株16S rRNA基因系统发育树Fig.2 Phylogenetic tree of bacterial 16S rRNA gene sequences revealing phosphate-solubilizing strains evolutionary divergence
2.3 解磷菌接种对拟南芥生长的影响
2.3.1 解有机磷菌株对拟南芥生长的影响 将解有机磷能力较强的5 株菌接种拟南芥幼苗,结果发现(图3),接种处理明显增加其株高和地上干重,分别较CK 提高了13.1%~76.2%和12.5%~77.3%。相比而言,接种菌株培养液比灭活的培养液促生作用更强。其中MHCB30 对株高的促进作用最强,而MHSC29 对地上干重的促进作用最强。
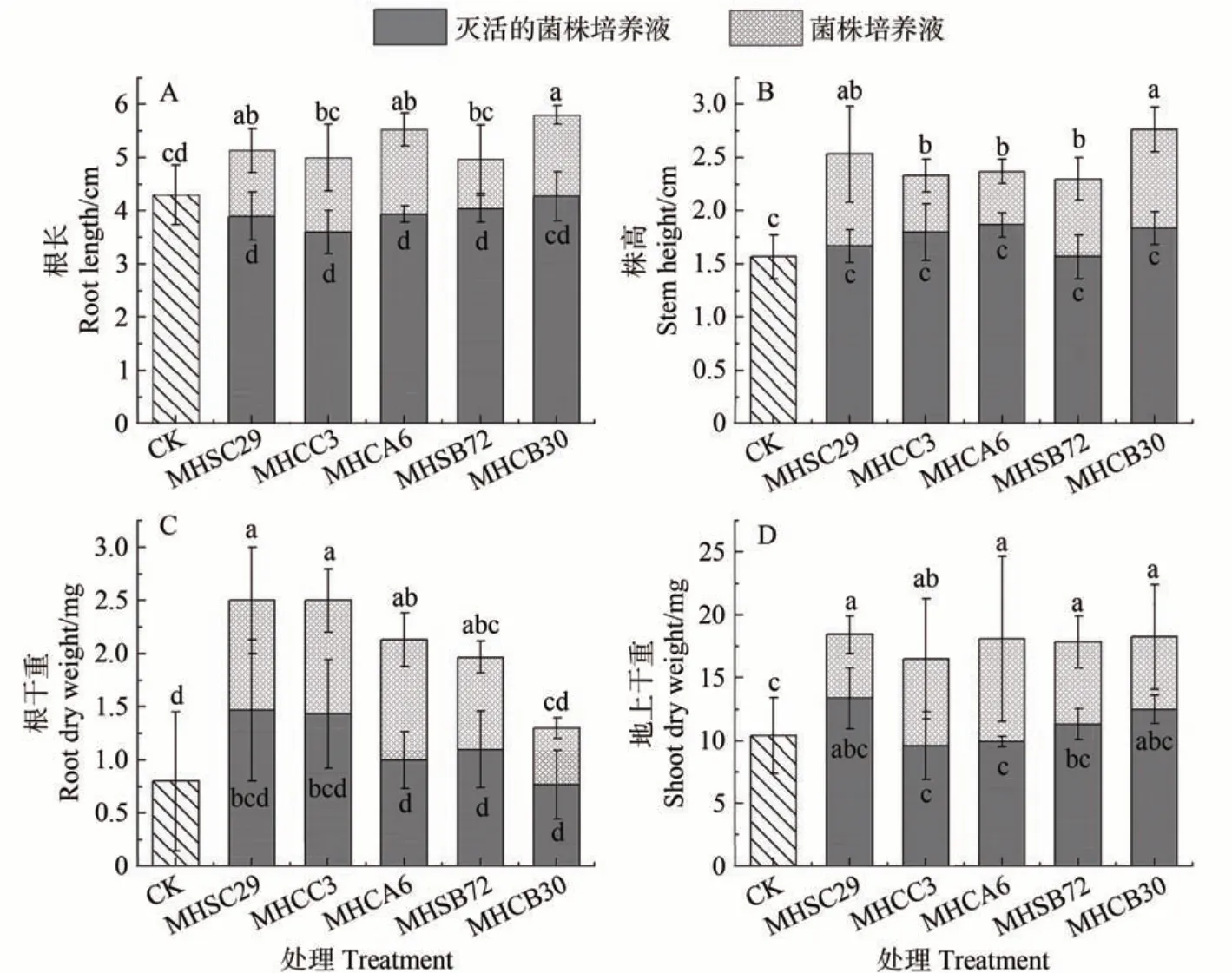
图3 解有机磷菌株对拟南芥的影响Fig.3 Effects of organic phosphate-solubilizing bacteria on the growth of Arabidopsis thaliana
接种灭活的菌株培养液使根长较CK 降低了0.7%~16.2%,但接种处理使根长提高了16.2%~35.3%。接种处理根干重较对照提高了56.3%~213.2%,其中以MHSC29 促进作用最强,但灭活的菌株培养液处理根干重与对照相比无显著差异(P>0.05)。总体而言,MHSC29 对拟南芥的促生作用更强。由图4 可知,接种MHSC29 明显促进了拟南芥根系发育,使侧根数量和长度增加。

图4 解有机磷菌株对拟南芥的促生效果Fig.4 The growth-promoting effects of organic phosphatesolubilizing bacteria on Arabidopsis thaliana
2.3.2 解无机磷菌株对拟南芥生长的影响 由图5可知,除接种灭活的NHSB2 导致株高较CK 降低18.0%外,其他处理均促进作物株高的增加,提高范围在2.5%~94.1%之间,以MPCC58 的增幅最大。同样,接种灭活的MPCC58、NHSB2 使地上干重较CK 降低了1.9%和5.1%,其他处理均提高地上干重,增加范围为3.2%~126.0%,以MHCB24的增幅最大。
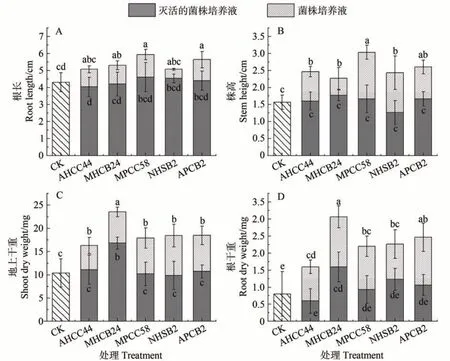
图5 解无机磷菌株对拟南芥的影响Fig.5 Effects of inorganic phosphate-solubilizing bacteria on the growth of Arabidopsis thaliana
除接种灭活的AHCC44 和MHCB24 使根长较对照降低6.2%和2.3%外,其他处理均增加了根长,增加范围为2.3%~38.0%,以MPCC58增加效果最强。除接种灭活的AHCC44导致根干重较CK减少25.2%外,其他处理均有积极影响,使根干重较对照增加了16.7%~283.4%,以MHCB24 增幅最大。综上,MHCB24 的促生效果最明显。
2.4 解磷菌接种对盐碱土种植小麦的影响
2.4.1 解有机磷菌株对小麦的影响 由图6、7 可知,解有机磷菌株明显增加了盐碱土中小麦的株高和茎粗,增加范围分别为2.4%~43.2%和2.3%~53.1%。除接种灭活的MHSC29 和MHSB72 使地上干重较CK降低12.6%和0.6%外,其他处理均使地上干重增加,增加范围为10.7%~92.3%。多数灭活处理对叶绿素含量有负影响,但菌株培养液接种处理均使叶绿素含量增加,增加范围为7.8%~40.5%。MHCC3 对株高、茎粗及叶绿素含量的促进作用最强,而MHSC29 对地上干重的促进作用最强。

图6 解有机磷菌株对小麦的影响Fig.6 Effects of organic phosphate-solubilizing bacteria on the growth of wheat
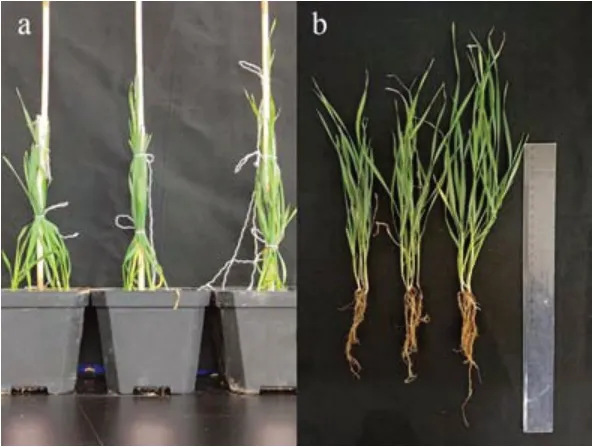
图7 解有机磷菌株对小麦的促生效果Fig.7 The growth-promoting effects of organic phosphatesolubilizing bacteria on wheat
除接种灭活的MHSB72 导致根干重较CK 降低7.3%外,其他处理均有促进作用,较CK增加了12.5%~146.1%。总体而言,MHSC29 和MHCC3 对盐碱土中小麦的促进效果更优。
2.4.2 解无机磷菌株对小麦的影响 由图8 可知,除接种灭活的MHCB24、MPCC58、NHSB2 和APCB2 使株高较CK 降低5.3%、1.4%、2.2%和2.2%外,其他处理均表现出积极作用,使株高较CK 增加13.3%~32.4%,以APCB2促进作用最强。接种灭活的MHCB24、NHSB2和APCB2 抑制了茎粗,分别较CK 降低2.7%、2.4%和4.1%,其他处理均有促进作用,较CK 增加了5.1%~28.1%。除接种灭活的MPCC58 和APCB2 导致地上干重较CK 降低7.5%和3.5%外,其他处理均有积极影响,使地上干重较CK 增加了2.7%~84.4%,以APCB2增加量最大。同时,接种菌株培养液均明显提高了叶绿素含量,较CK提高了31.3%~40.2%。
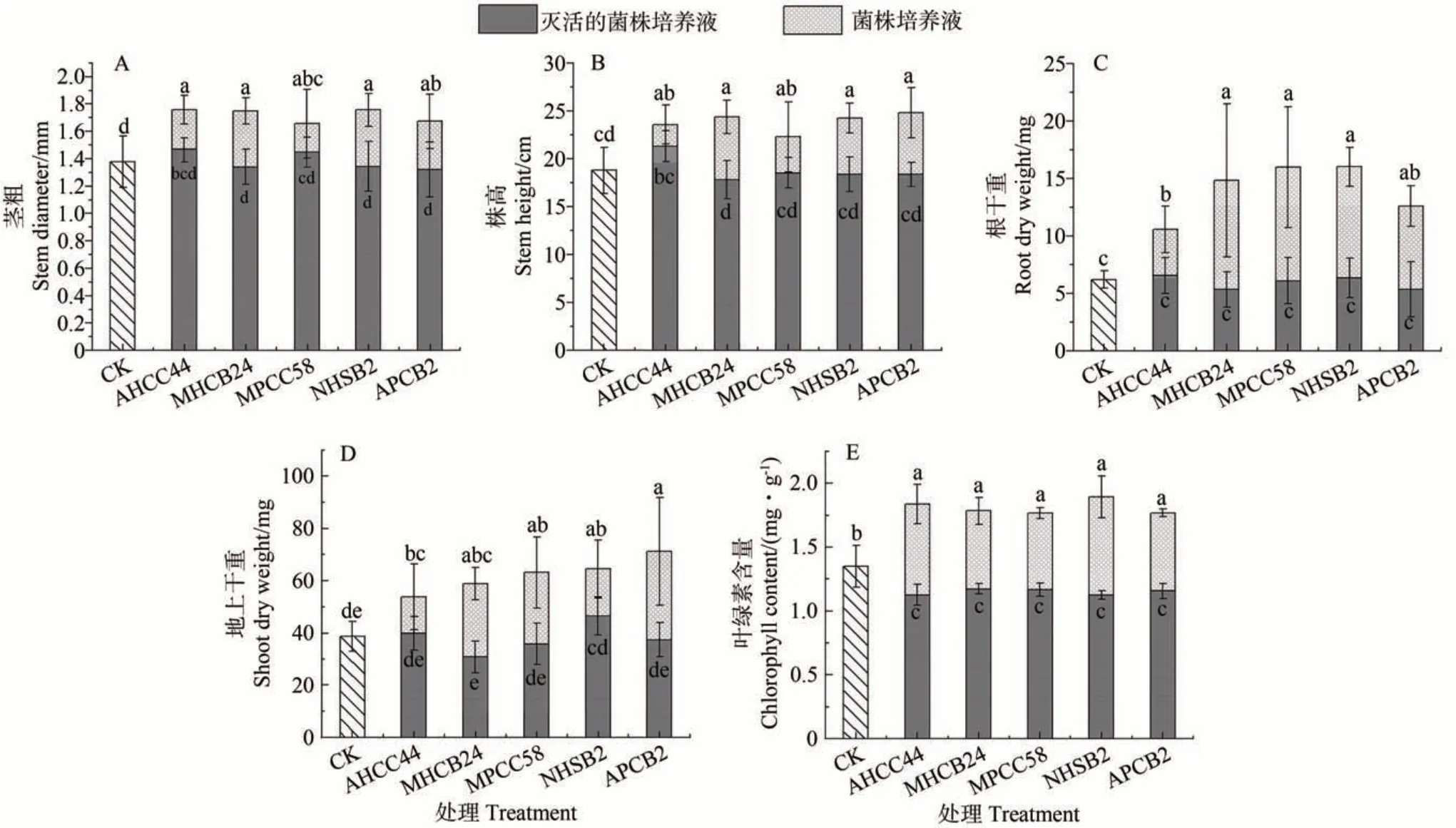
图8 无机磷菌株对小麦的影响Fig.8 Effects of inorganic phosphate-solubilizing bacteria on the growth of wheat
除接种灭活的MHCB24、MPCC58 和APCB2 使根干重较CK降低14.4%、1.9%和14.2%外,其他处理均有促进作用,增加了2.3%~158.1%。综合看,APCB2对盐碱土中小麦生长的促进作用最强。
3 讨论
土壤盐碱化会对植物生长、生理造成严重损伤,但盐碱土中仍活跃着丰富多样的微生物,在生态系统稳定性中起着核心作用[23]。前人研究表明,盐碱土壤中微生物类群变异较大,尤以不动杆菌属(Acinetobacter)、肠杆菌属(Enterobacter)、假单胞菌属(Pseudomonas)等占主要优势[24-26]。本研究从3 种盐生植物中筛选到的解磷菌同样以Enterobacter占绝对优势,进一步证实Enterobacter是盐碱生境中普遍分布,并可能发挥重要作用的细菌类群。
目前,已有诸多农田土壤耐盐碱解磷菌的报道,包括Bacillus、Pseudomonas、固氮菌属(Azotobacter)、Enterobacter、Arthrobacter等[27]。研究证实,解磷菌可通过溶磷及调控根际微生物群落结构来改善土壤性质,促进植物生长[28-31]。本研究中,解无机磷率与培养液pH值呈显著负相关关系,与以往报道相似[32-34]。目前普遍认为,微生物对无机磷的降解机制主要是通过释放有机酸(如葡萄糖酸、草酸、柠檬酸等)降低土壤中的pH 值,将难溶性磷酸盐酸解。有机酸分子还能与磷酸盐中的金属离子形成螯合物,从而释放磷元素,促进植物对磷的吸收利用[35]。由此推测本研究中解无机磷菌株的溶磷过程也与有机酸的产生有关。但不同菌株分泌的有机酸种类及含量不同,导致其解磷能力有所差异。解有机磷菌株的磷含量与培养液pH值无相关性,原因可能是解有机磷菌株多通过所分泌微生物酶的酶解作用增加速效磷含量[36]。研究发现,利用DNA 合成技术将植酸酶合成基因导入Pseudomonas simiaeWCS4174后,其溶磷效果更优[37];木霉TrichodermaTU-MDU45经复合诱变后溶磷量增加了259.1%,对番茄的促生效果更强[38]。因此,基于多种手段选育优良菌种,以进一步提高其解磷能力,是制备高效生物磷肥的有效途径,值得进一步深入研究。
解磷菌株明显促进了拟南芥幼苗生长,对盐碱土的小麦也有积极影响,说明其在增强植物抗盐碱性上具有一定潜力。但不同解磷菌株对宿主植物的响应不同,如泛菌Pantoea cypripediiB19 接种至小麦后,其促生效果[39]与本研究用肠杆菌APCB2 有所差异。究其原因,可能首先是受到自身解磷能力的影响,还可能与其在植物根际的定殖和生物活性有关。因为微生物的定殖受一系列生物环境因素影响,包括宿主植物种类、土壤类型、根系分泌物、细菌营养型等[40-43]。除此之外,菌株的有效定殖还受到土壤性质、温湿度、含氧量等非生物因素的影响[44-45]。可见,微生物解磷能力受多种因素综合影响,导致其对宿主植物的响应不同。
PSM 不仅能通过多种机制促进盐碱土中植物生长,还能促进盐碱土的增肥及修复,改良盐碱土土质[36]。Adnan 等[46]和Singh 等[47]的研究证实,接种解磷微生物增加了盐碱土壤中的矿质溶解性,提高了土壤养分。本研究仅通过盆栽试验评价了解磷菌株的生物学效应,后期需进一步分析解磷菌株对土壤理化性质和生物性状改良的影响,为解磷菌剂改善盐碱土壤提供更多理论支持。本研究所用解磷菌株具备开发为盐碱地微生物肥料的潜能,但尚未开展小区和大田试验。虽然本试验供试土壤是经灭菌处理的封闭系统,充分排除了土著微生物群落及其他生物的干扰,但大田中不可控条件导致的供试菌株竞争性不强、时效性低、稳定性差等系列共性问题尚未得到有效解决。从而导致很多在实验室中效果显著的菌株,难以在开放的自然环境中发挥功效,后续需考察、跟进这些功能菌株的大田应用效果。
目前对耐盐碱功能微生物的筛选及性能研究较多,但将其应用于盐碱土改良尚处于初级阶段,未得到全面推广应用。基于此,可从以下几方面加强对耐盐碱解磷菌的研究:(1)持续开展盐碱环境中解磷菌株的分离筛选,或通过基因工程手段构建高效解磷菌,以进一步提升其促生效果。(2)由于解磷菌株可能兼具多种功能,因此应增强对多功能解磷菌的研究,或整合多种功能菌株构建复合菌剂,以最大化应用于盐碱土。(3)从酶学、分子生物学及菌落生态学等方面进一步揭示解磷菌株的促生机制,为其应用于盐碱土改良提供更多理论支持。
4 结论
本试验从新疆克孜勒苏柯尔克孜自治州3 种典型盐生植物根际、根内和土体中共筛选出141 株解磷菌,其中解有机磷菌株的溶磷率介于1.5%~7.6%之间,解无机磷菌株的溶磷率介于1.1%~4.7%之间,且无机磷含量与发酵液pH 值呈显著负相关。所有菌株隶属于8 个属,以Enterobacter占绝对优势。接种解磷菌对非盐碱胁迫下拟南芥及盐碱土中的小麦幼苗地上和地下部分有明显促生作用。

