臭椿酮对非小细胞肺癌顺铂耐药细胞A549/DDP的增敏作用
李祥伶,刘承一,刘 镭,陈 龙,于胜利,许 倩*
(1.承德医学院基础医学院,河北承德 067000;2.承德医学院附属医院;3.承德市生态环境检验监测站)
肺癌是导致死亡最常见的恶性肿瘤之一[1,2]。据统计[3,4],非小细胞肺癌(non-small cell lung cancer,NSCLC)在肺癌中患病率超过80%,且5年生存率仅为21%。目前,顺铂(cisplatin,DDP)仍是化疗一线用药,但长期使用会出现抗药性而导致治疗失败[5]。因此,寻找一种药物与之联用,增加药物敏感性,是肿瘤治疗研究中的热点。
中草药具有可利用性、有效性高且毒性相对较低的优势[6]。臭椿酮(ailanthone,AIL)是椿皮中提取的一种苦木苦味素类药物,早期研究多在抗菌、抗炎等方面,最近发现其在抗肿瘤方面也有显著作用,如前列腺癌、结直肠癌等[7-9]。AIL亦能逆转DDP、阿霉素等药物的耐药性[10],但机制尚不明确,且在NSCLC的治疗中尚未见报道。因此,本文就AIL对A549/DDP细胞的增敏作用展开研究,为NSCLC中药辅助治疗提供新思路。
1 材料与方法
1.1 仪器
美国BD公司FACS CaLibur型流式细胞仪;中国上海天能公司6100型化学发光仪;美国博腾公司ELX808TM型酶标仪;中国麦克奥迪公司AE2000型倒置光学显微镜;中国大龙兴创公司D3024R型台式高速冷冻离心机;中国海尔公司HR30-2A2型生物安全柜。
1.2 细胞及试剂
人肺癌细胞A549及人肺癌DDP耐药细胞(A549/DDP细胞)购于上海文生物科技有限公司;AIL(货号:SA9130)、MTT(货号:SA9130、M818C)、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶制备试剂盒购于北京索莱宝科技有限公司;DDP(货号:HY-17394/CS-1122)购于美国MCE公司;AnnexinV-FITC/PI凋亡检测和周期检测试剂盒(货号AP101、CCS012)购于杭州联科生物技术股份有限公司;PBS缓冲液(1×)、RPMI-1640 培养基及Trypsin-EDTA Solutio(n0.25%,1×)购于美国Gibco公司;胎牛血清购于以色列Biological Industries公司。
1.3 细胞培养
A549细胞和A549/DDP细胞用含有10%FBS的RPMI-1640 培养基,置于37℃,5%CO2饱和湿度的培养箱中培养。
1.4 MTT法检测细胞活力
将对数生长期的A549和A549/DDP细胞,胰酶消化,计数,以1×104个/孔接种于96孔板中,培养24h,分别按以下方案加药处理。方案一:A549细胞中加入梯度浓度(0、0.05、0.1、0.2、1、2、10、20、40μmol/L)AIL;方案二:A549/DDP细胞中加入梯度浓度(0、0.2、2、20、40、80、160、320μmol/L)AIL;方案三:为确定低毒性AIL浓度,在A549/DDP细胞中加入梯度浓度(0、0.2、0.4、0.6、0.8、1、2μmol/L)AIL;方案四:在A549/DDP细胞中加入梯度浓度(0、25、50、100、200、400、800μg/mL)DDP,并联合低浓度AIL。继续培养24h,加入MTT,孵育4h,加入100μL二甲基亚砜,震荡1~3min。用酶标仪在490nm波长处检测各孔OD值,计算细胞存活率。
1.5 药物联合作用的评价
利用CompuSyn软件中的Chou-Talalay中效分析法[11],计算AIL与DDP联合用药的CI值,若CI<1,认为两种药物有协同作用,CI=1认为两种药物有相加作用,CI>1认为两种药物有拮抗作用[12,13]。
1.6 流式细胞术检测细胞周期
将对数生长期的A549/DDP细胞以1×106个/皿接种于培养皿中,培养24h,分空白组、DDP组(50μg/mL)、AIL组(0.6μmol/L)、AIL(0.6μmol/L)+DDP(50μg/mL)组用药,继续培养24h,收集各组细胞。根据试剂说明每组加入1mL DNA Staining solution和10μL Permeabilization solution,涡旋振荡10s混匀。室温避光孵育30min,低速上样,流式细胞仪进行检测。
1.7 流式细胞术检测细胞凋亡
细胞培养及用药分组如1.6,收集各组细胞,根据试剂说明向每组加入100μL 1×Binding Buffer、5μL Annexin V-FITC 和10μL PI试剂混匀,室温避光孵育5min,流式细胞仪进行检测。
1.8 Western blotting检测凋亡相关蛋白的表达
细胞培养及用药分组如1.6,加入RIPA细胞裂解液,提取总蛋白,12000r/min离心15~20min取上清,BCA法定量蛋白,取适量蛋白加入5×蛋白上样缓冲液,100℃煮沸10min变性,上样后行SDS-PAGE电泳,转膜,5%脱脂奶粉封闭2h,加入相应一抗(抗Bcl-2、Bax、Caspase-3等抗体均1:2000稀释,抗β-ACTIN抗体1:10000稀释),4℃过夜,次日用TBST清洗3次,加入二抗(山羊抗兔IgG以1:5000稀释)孵育1h,TBST清洗3次,凝胶成像系统显影,拍照,ImageJ软件分析条带灰度值,计算目的蛋白的相对表达水平。
1.9 统计学方法
采用SPSS 25.0软件统计分析,数据以均值±标准差()表示,采用单因素方差分析进行3组或3组以上的差异比较,采用Bonferroni进行组间两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1 AIL对A549及A549/DDP细胞活力的影响
MTT实验结果发现,用不同浓度AIL作用A549细胞,当药物浓度≥0.05μmol/L时,细胞活力明显下降(图1A,P<0.05);而用不同浓度AIL作用A549/DDP细胞后,0.2μmol/L浓度对细胞活力无明显影响(图1B,P>0.05),药物浓度≥2μmol/L时,细胞活力显著下降(图1B,P<0.05)。为选择AIL作用的低毒性,用低梯度浓度AIL作用A549/DDP后,发现0.6μmol/L为具有统计学意义的最低浓度(图1C,P<0.05),可作为下一步实验的用药浓度。
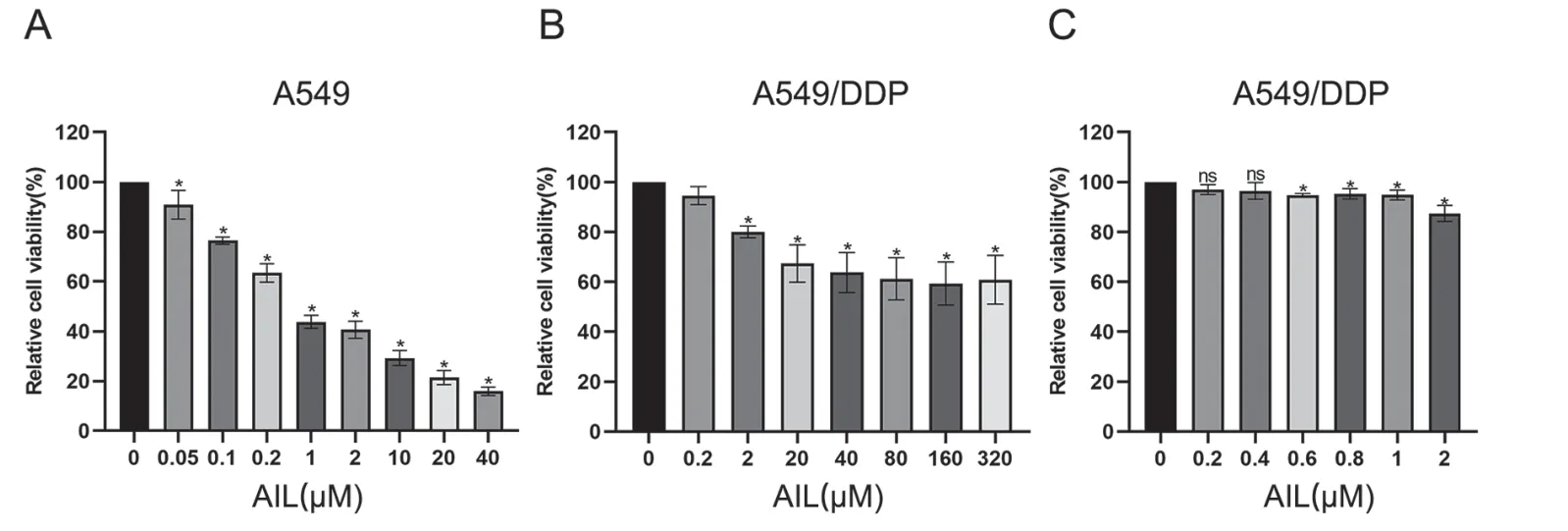
图1 AIL对A549、A549/DDP细胞活力的影响
2.2 AIL与DDP联合用药的协同作用
采用CompuSyn软件计算AIL与DDP联合用药的CI值,如表1所示。当DDP浓度≥50μg/mL时,CI<1,说明联合用药有协同作用。当DDP浓度为50μg/mL,与0.6μmol/L AIL联合应用时,A549/DDP细胞的抑制率为37.18±1.90%,CI值为0.72±0.09%。因此,为了减少药物不良反应,选择药物浓度小且具有联合作用的50μg/mL浓度的DDP进行后续实验。

表1 0.6μmol/L AIL与不同浓度DDP联合作用A549/DDP细胞的联合用药指数
2.3 AIL对A549/DDP细胞周期的影响
流式细胞术检测AIL对A549/DDP细胞周期的影响,如图2。与空白组比较,AIL+DDP组、AIL组细胞在G1期明显阻滞,与DDP组比较,AIL组细胞在G1期阻滞增加(图2B,P<0.05);且分别与空白组、DDP组、AIL组相比,AIL+DDP组细胞在G2期明显阻滞(图2C,P<0.05);各组细胞S期无明显改变(图2D,P>0.05)。
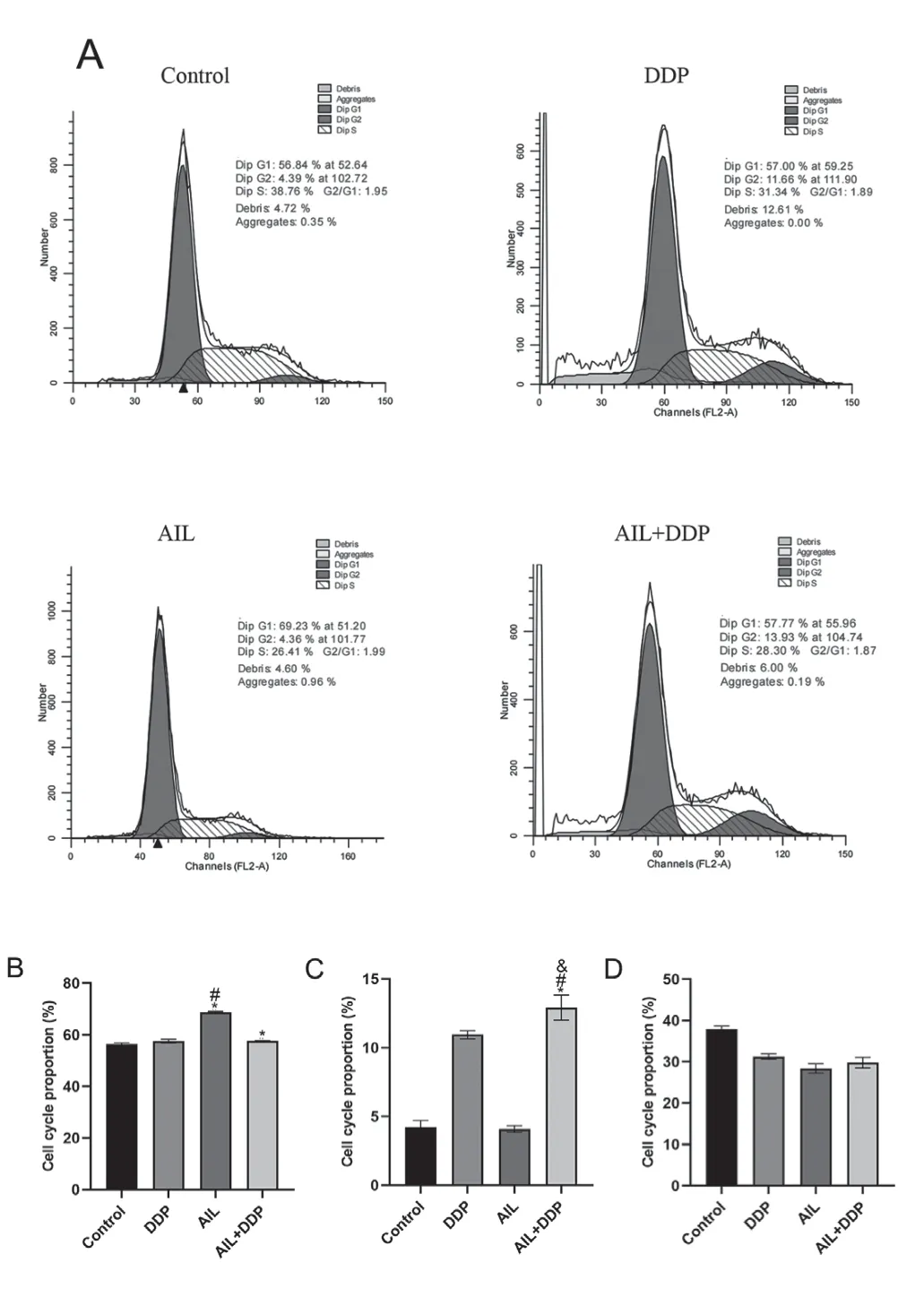
图2 用药后各组A549/DDP细胞细胞周期变化情况
2.4 AIL对A549/DDP细胞凋亡的影响
流式细胞术检测细胞凋亡情况,如图3。结果显示,空白组、DDP组、AIL组和AIL+DDP组的凋亡率分别是10.46±0.52%、36.03±0.63%、16.51±0.96%和40.44±0.79%(图3A)。与空白组、DDP组和AIL组比较,AIL+DDP组细胞凋亡率明显升高,差异有统计学意义(图3B,P<0.05)。
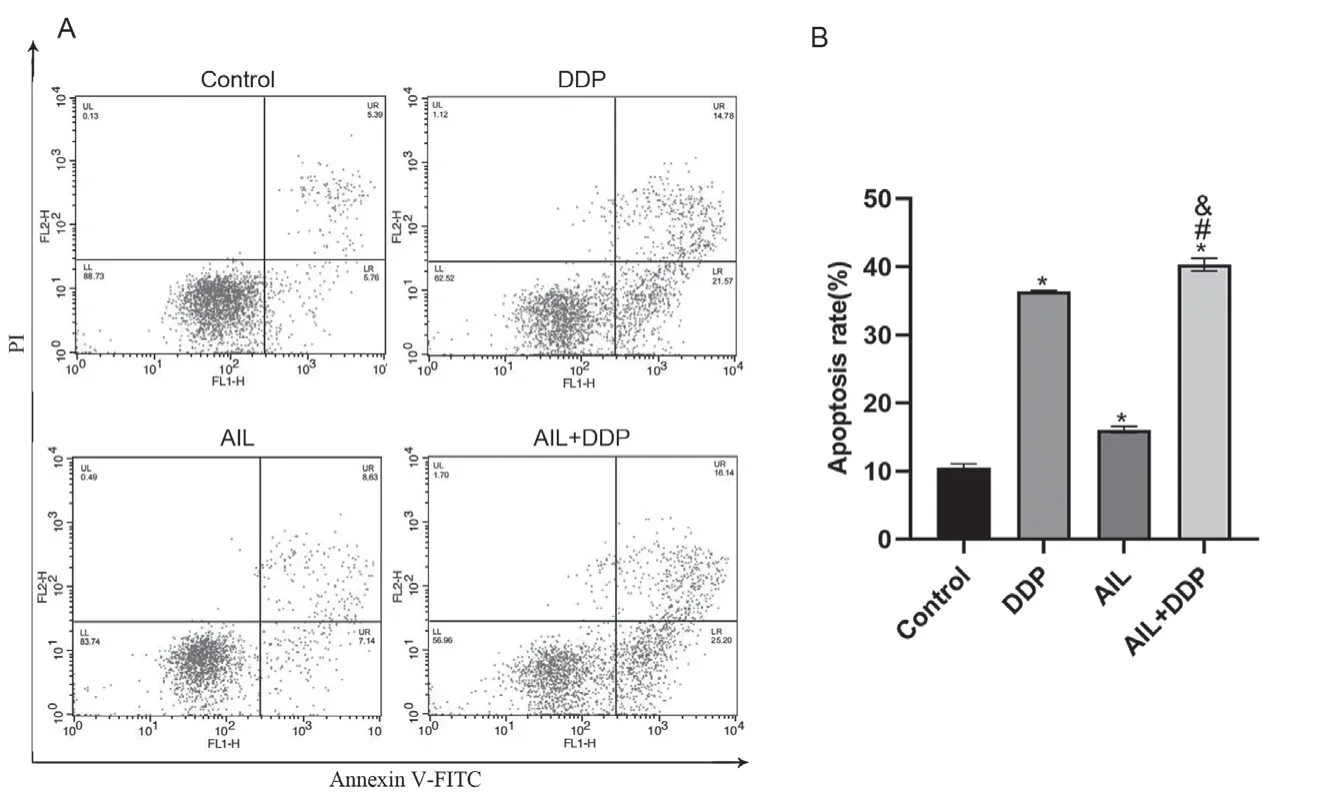
图3 用药后各组A549/DDP细胞凋亡率
2.5 AIL对A549/DDP细胞凋亡及周期相关蛋白的影响。
AIL作用于A549/DDP细胞后,Western blot检测Bcl-2、Bax、Caspase-3、Cleaved Caspase3、CDK4、CyclinD1的蛋白表达水平,如图4所示。分别与空白组、DDP组和AIL组比较,AIL+DDP组中Caspase-3、Bcl-2蛋白表达水平均明显下降,AIL组比空白组Caspase-3、Bcl-2表达水平显著下调(图4E、F,P<0.05)。AIL+DDP组与空白组、DDP组、AIL组比较,AIL+DDP组中Cleaved Caspase3、Bax的表达水平明显升高;AIL组比空白组的Cleaved Caspase3、Bax表达水平显著增加(图4B、C,P<0.05)。与空白组、DDP组比较,AIL+DDP组中CDK4、CyclinD1的表达水平上升;AIL组与空白组、DDP组相比,AIL组CDK4、CyclinD1的蛋白表达水平明显上升(图4D、G,P<0.05)。
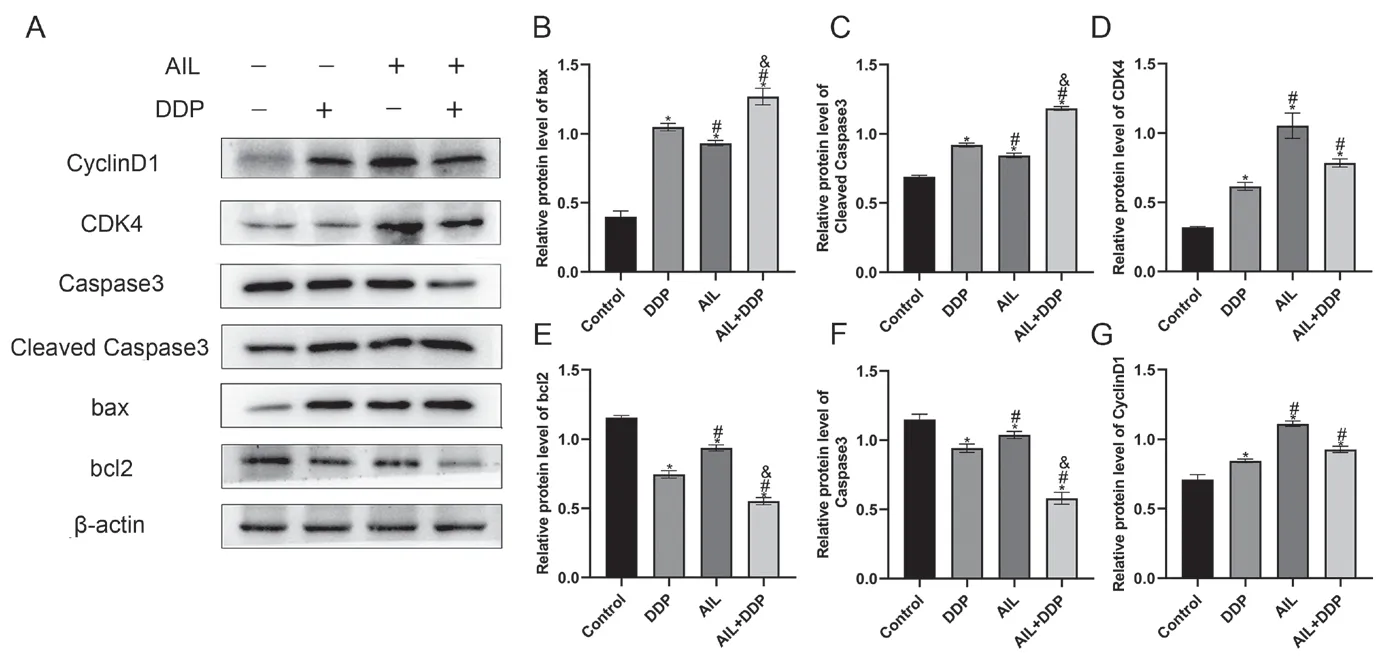
图4 用药后各组A549/DDP细胞中蛋白表达水平
3 讨论
DDP化疗是晚期NSCLC以及手术切除后降低复发风险的重要治疗手段[14]。然而,DDP的持续使用会造成患者产生抗药性,从而导致NSCLC治疗失败[6]。研究[15]表明,有多种机制参与了顺铂耐药,包括顺铂在细胞内积累减少、外排增加、DNA修复能力增强、修复途径增加以及凋亡受抑制等。因此,寻找一种低毒高效的药物,增加DDP敏感性,降低化疗用药量,是目前NSCLC治疗中一个非常重要的策略。
中药单体作为我国独特的治疗手段,因其低毒高效成为目前抗肿瘤辅助药物开发的重点[16]。AIL即为中草药椿皮中提取的小分子化合物。本研究发现,AIL作用A549细胞后,当物浓度≥0.05μmol/L时,细胞活力明显下降;作用A549/DDP细胞后,药物浓度≥2μmol/L时,细胞活力显著下降,这表明AIL对A549、A549/DDP细胞的增殖具有明显抑制作用,这与田艳等[17]研究一致。
细胞凋亡是维持生物体和细胞内稳态的一个重要生物学过程。Caspase-3是参与凋亡的主要途径之一[18,19]。在对乳腺癌的研究[20]中发现,AIL具有诱导细胞凋亡,并将细胞周期阻滞细胞在G1期。本研究进一步检测AIL作用后A549/DDP细胞周期和凋亡情况,结果亦提示AIL作用A549/DDP细胞后,细胞在G1期阻滞,而AIL与DDP联合作用后,细胞在G1期和G2期都发生了明显的阻滞,且周期相关蛋白CDK4、CyclinD1蛋白的表达水平显著升高,AIL可以抑制A549/DDP细胞增殖。本研究检测亦发现,细胞总凋亡率从单独使用DDP的(36.03±0.63)%上升到联合应用后的(40.44±0.79)%,同时检测凋亡相关蛋白的表达情况。AIL用药后,Caspase-3表达水平显著下降,Cleaved Caspase3表达水平明显升高,进一步说明AIL增加A549/DDP细胞对DDP的敏感性可能通过Caspase3介导的凋亡途径。
另外,Bcl-2和Bax都是Bcl-2家族的同源蛋白,有研究[21,22]指出Bcl-2相关蛋白的表达与顺铂耐药联系密切。本研究结果显示,AIL与DDP联合作用A549/DDP细胞后,Bcl-2的蛋白表达水平明显下调,而Bax蛋白表达水平显著上升。
综上所述,AIL能抑制A549/DDP细胞的增殖,诱导其凋亡,增强DDP对A549/DDP的敏感性,抑制A549/DDP细胞生长并促进其凋亡。但是,AIL能否逆转肺癌DDP耐药尚不可知,其机制也有待研究。

