NF-κB和EGFR在胃癌组织中的表达及临床病理意义
王爱民,焦海涛,李常洲,尹静一,吴建龙,张诗彤
(1.承德市中心医院消化内科,河北承德 067000,2.承德医学院)
近年来,尽管胃癌的发病率在逐渐下降,但它仍是世界范围内癌症相关死亡的最常见原因之一[1]。胃癌早期症状隐匿,发现时大多数已经进入进展期,而进展期胃癌只有不到50%的几率可以通过手术完全切除病灶及转移病灶[2],导致这种情况发生的主要原因是缺乏有效的早期筛查和个体化针对性的治疗。胃癌的发生机制非常复杂,涉及到癌基因的大量活化和抑癌基因的大量失活,与细胞中多种基因突变和表达异常有关,是多因素长期作用的共同结果。
核因子-κB(nuclear-factorkappa B,NF-κB)是一种转录因子,属于真核转录因子家族,具有多向转录调节作用,对于细胞信号传递有重要作用。表皮生长因子受体(epidermal growth factor receptor,EGFR)是一种具有酪氨酸蛋白激酶活性的多功能跨膜糖蛋白,在细胞的生长、增值和分化中具有重要作用。许多研究证明,NF-κB与EGFR在多种恶性肿瘤中都存在着高表达,且二者均与胃癌的发生、发展密切相关[3]。本研究采用免疫组化(SP)法检测NF-κB与EGFR在胃癌组织中的表达情况并对二者的相关性进行分析,旨在从分子角度为胃癌的早期诊断和靶向治疗提供帮助。
1 材料与方法
1.1 一般资料
收集承德市中心医院病理科2011年~2013年经石蜡包埋的胃癌组织共106例,其中女性32例,男性74例,年龄42~78岁,中位年龄59岁,年龄<55岁者35例,年龄≥55岁者71例,所有标本均按《中国胃癌诊治规范》进行处理,术前均未行放化疗,术后病理证实均为腺癌,其中低分化腺癌72例,高、中分化腺癌共34例;侵及浆膜层者68例,未侵及浆膜层者38例;无淋巴结转移者44例,伴有淋巴结转移者62例。取34例癌旁正常胃组织作为对照,其中男性21例,女性13例,年龄44~68岁,中位年龄56岁,所有标本均经过充分固定。
1.2 方法
所有组织标本蜡块以4μm为厚度进行连续切片,免疫组化SP法标记胃癌组织和正常胃黏膜组织NF-κB、EGFR的表达情况,步骤严格按照试剂盒进行,一抗为兔抗人单克隆抗体,阴性结果对照组以PBS代替,阳性对照为试剂公司所提供的阳性切片。
1.3 免疫组化结果判定
镜下细胞内如出现棕黄色颗粒判定为阳性,不着色则判定为阴性。NF-kB阳性染色位于胞浆,EGFR阳性染色部位在细胞膜和胞浆,均呈棕黄色颗粒或团块状,弥漫分布,表达结果根据Handel等[4]的分级标准双盲法记分:<5%为阴性(-),≥5%为阳性表达。
1.4 统计学方法
采用SPSS 19.0统计软件对数据进行分析,利用χ2检验和四格表精确概率法,统计学结果以P<0.05具有统计学意义。NF-κB、EGFR之间的相关性分析采用Spearmen等级相关分析。
2 结果
2.1 NF-κB在胃癌及正常胃黏膜组织中的表达
106例胃癌组织中NF-κB阳性表达数为72例,阳性表达率为67.9%;正常胃黏膜组织中NF-κB阳性表达数为2例,阳性表达率为5.9%。NF-κB在胃癌组织中的表达水平明显高于正常胃黏膜组织,经χ2检验,2组之间的差异具有统计学意义(P<0.05),见图1、表1。
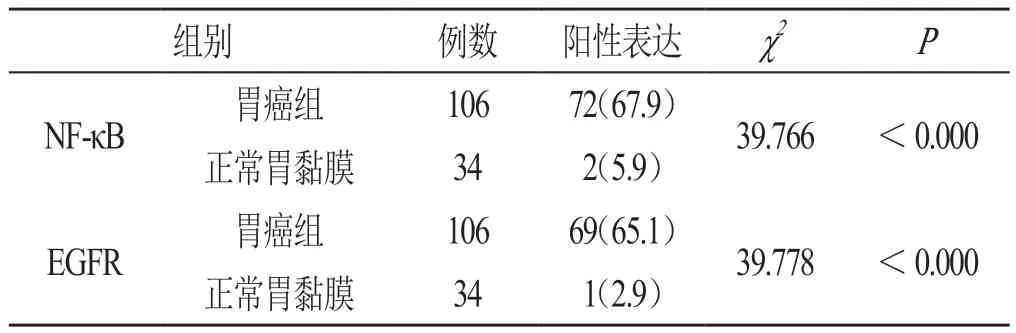
表1 NF-κB、EGFR在胃癌及正常胃黏膜组织中的表达(n,%)
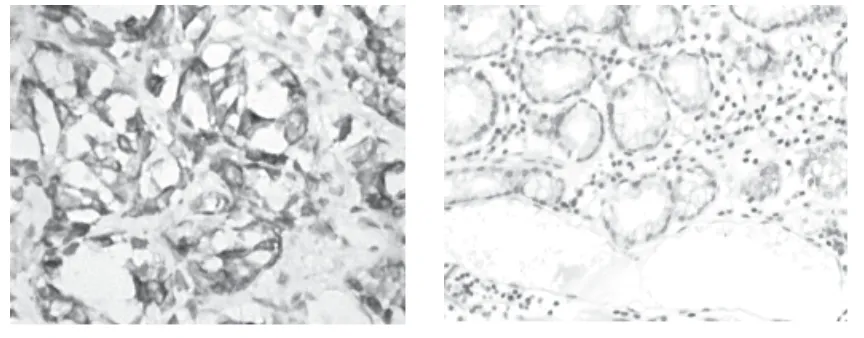
图1 NF-κB在胃癌及正常胃黏膜组织中的表达(×200)
2.2 EGFR在胃癌及正常胃黏膜组织中的表达
EGFR在106胃癌组中阳性表达数为69例,阳性表达率为65.1%;正常胃黏膜组织中EGFR阳性表达数为1例,阳性表达率为2.9%。胃癌组织中EGFR的表达水平明显高于正常胃黏膜组织,经χ2检验,2组之间的差异具有统计学意义(P<0.05),见图2、表1。
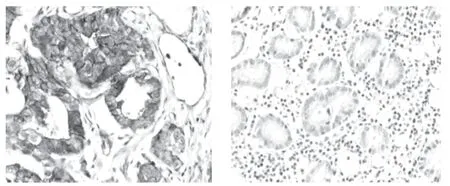
图2 EGFR在胃癌及正常胃黏膜组织中的表达(×200)
2.3 NF-κB、EGFR表达与胃癌临床病理特征的关系
NF-κB、EGFR在胃癌中的表达与肿瘤分化程度、浸润深度、淋巴结是否转移及临床分期有关(P<0.05),与患者年龄、性别无显著相关性(P>0.05),见表2。

表2 NF-κB、EGFR表达与胃癌临床病理特征的关系
2.4 NF-κB、EGFR在胃癌组织表达相关性分析结果
Spearman等级相关性分析发现,NF-κB与 EGFR在胃癌中的表达呈正相关(r=0.202,P<0.05),见表3。
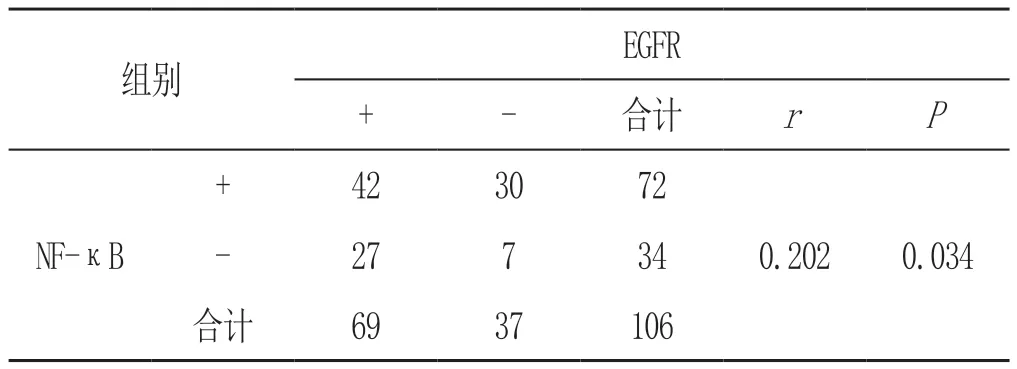
表3 NF-κB、EGFR在胃癌组织表达相关性分析结果(n)
3 讨论
随着对恶性肿瘤发生、发展机制的大量、深入研究,人们已将靶向治疗应用于以化疗为主的综合治疗中,并取得了显著效果。Bang等[4]研究证实,化疗联合靶向治疗能够改善晚期胃癌患者的生存期,这项研究不仅是利用靶向药物治疗胃癌的里程碑,同时也确定曲妥珠单抗是一种能够治疗晚期胃癌的有效靶向药物。胃癌的靶向诊断为胃癌靶向药物的成功应用提供了充分的理论依据。因此,确定高灵敏度及高特异性的胃癌分子标记物是早期诊断胃癌,提高治疗效果,改善预后的关键,也是现在研究的热点方向之一。
EGFR是一种具有酪氨酸激酶活性的膜表面蛋白,它主要表达于人体的表皮细胞,也在一些基质细胞、平滑肌细胞及神经胶质细胞中有表达。EGFR与相对应的多种配体结合后形成同源或异源二聚体,再与ATP结合而发生磷酸化,活化下游信号分子,最终通过这些信号通路促进肿瘤细胞的生长扩散、抑制其凋亡,还能帮助肿瘤细胞抵御正常细胞的侵袭[5]。研究证实,EGFR在胃癌、肺癌、结肠癌、乳腺癌及前列腺癌等恶性肿瘤中存在高表达的情况。EGFR的高表达和异常信号传导是胃癌发生发展的分子机制之一,是导致肿瘤细胞突变和扩散的重要原因,客观上讲,EGFR与胃癌患者的预后密切相关[6]。本研究采用免疫组织化学SP法检测出EGFR在胃癌组织中的表达明显高于正常组织,而且EGFR阳性表达率与肿瘤分化程度、浸润深度、淋巴结是否转移及临床分期呈正相关。由此可见,在胃癌的发生、发展等过程中,EGFR起着重要的作用,证实EGFR可以作为靶点进行靶向治疗。
NF-κB是一类真核转录因子,存在于体内多种细胞中,具有多项调节功能,其活化后通过与多种基因启动子区域的固定核苷酸序列结合来启动基因转录[7]。研究证明,NF-κB在胃癌、宫颈癌、前列腺癌、淋巴瘤、肺癌等均有高表达[8],其参与多种调控增殖基因和凋亡基因的转录,在肿瘤的发生、发展和浸润转移中发挥重要作用[9]。本研究发现,胃癌组织和正常胃黏膜组织NF-κB的表达存在显著的差异性,同时,胃癌中NF-κB阳性表达率伴随肿瘤病理分级、临床分期的增加而增加,在伴有淋巴结转移病例中阳性表达率也明显提高,提示NF-κB在胃癌的进展中具有一定作用,其表达与胃癌的恶性程度和侵袭转移相关,有可能作为判断胃癌预后的指标。
刘宇等[10]研究证明,EGFR与其配体之一的表皮生长因子结合后,可对其下游多条信号通路中的NF-κB进行激活,促进肿瘤细胞分化、增殖。NF-κB的激活伴有多种肿瘤浸润、转移相关的重要细胞因子的活化,其中就包括EGFR,即EGFR的表达会受到NF-κB的调控。因此,EGFR与NF-κB存在相互激活和促进的联系。本实验研究也发现,在大多数NF-κB表达阳性的胃癌组织中,EGFR同样表达阳性,说明在胃癌中NF-κB与EGFR的表达呈正相关。由此结合本实验和前人研究可以推测,EGFR通过促进NF-κB的激活来促进胃癌的分化、增殖,NF-κB通过调控EGFR的表达促进胃癌的发生、发展,通过联合检测NF-κB和EGFR可以判断胃癌侵袭性、转移及预后,也可为胃癌的靶向治疗提供重要依据。目前,在对胃癌靶向治疗的研究中,针对EGFR为靶点的治疗分为抗人类表皮生长因子受体1(EGFR1)治疗和抗人类表皮生长因子受体2(HER-2)治疗,在这两类药物里,只有曲妥珠单抗被证实能在临床一线联合化疗药物进行综合治疗,可提高晚期胃癌的疗效、延长总生存期[11]。其他EGFR靶向药物,如以EGFR1为靶点的药物西妥昔单抗、帕尼单抗和以HER-2为靶点的药物拉帕替尼,均未取得理想的治疗效果,目前仍在研究、探索当中[12]。本研究证明,NF-κB、EGFR在胃癌组织中可同时进行阳性表达,且NF-κB与EGFR的表达呈正相关,二者在胃癌发生发展过程中有协同作用。我们可以设想,在对胃癌进行靶向治疗时,联合应用EGFR靶向药物与NF-κB抑制剂,效果可能会优于上述药物单药治疗效果。此项实验研究为临床上胃癌的靶向治疗提供新的思路和一定的理论基础,也为我们下一步的研究明确了方向。

