梓醇对IL-1β诱导软骨细胞损伤的保护机制研究
马玲,钟利国,崔裕如,刘彬
骨关节炎(osteoarthritis,OA)属于慢性退行性关节疾病,是导致残疾的主要原因,而炎性细胞因子与OA 发病关系密切[1-2]。白细胞介素(IL)-1β 可诱导软骨细胞释放蛋白水解酶和其他炎性细胞因子产生,促进OA 发生[3]。梓醇是一种中药提取物,具有减轻IL-1β 诱导的大鼠软骨细胞炎症反应、细胞凋亡以及细胞外基质降解的作用,是治疗OA的潜在药物[4-5],但其作用机制尚不明确。miR-140-5p 为调节软骨稳态的特异性miRNA,其表达失调与OA 严重程度有关[6]。研究显示,miR-140-5p 水平在OA和IL-1β 诱导的软骨细胞损伤中表达下调,其过表达可抑制IL-1β诱导的软骨细胞炎症反应和细胞凋亡[7]。新近研究发现,梓醇可通过上调miR-140-5p表达抑制肝癌细胞增殖并促进其凋亡[8]。本研究旨在探讨梓醇对OA 的改善作用与miR-140-5p 的关系。
1 材料与方法
1.1 主要材料
选取2019 年7 月—2020 年7 月于荆州市第一人民医院接受治疗的20例膝关节炎患者为研究对象,所有患者均行膝关节置换术,术中切除软骨组织。其中男12例,女8例,年龄43~56岁,平均(48.63±3.26)岁。梓醇购自成都瑞芬思生物科技有限公司(纯度90%);IL-1β 酶联免疫吸附试验(ELISA)试剂盒购自美国Sigma公司;IL-6、肿瘤坏死因子α(TNF-α)、γ 干扰素(IFN-γ)ELISA 试剂盒购自英国Abcam 公司;RNA提取试剂盒、miRNA 提取试剂盒、SYBR Green 试剂盒、反转录试剂盒购自北京天根生化科技有限公司;DMEM 培养基、胰蛋白酶、胎牛血清、凋亡试剂盒购自碧云天生物;Lipofectamine2000 购自美国Invitrogen;miR-NC、miR-140-5p mimics、anti-miR-NC、anti-miR-140-5p 购自广州锐博生物科技有限公司;兔抗人活化的胱天蛋白酶3(Cleavedcaspase 3)、活化的胱天蛋白酶9(Cleaved-caspase 9)抗体购自武汉艾美捷公司;内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体与辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG 二抗购自美国Santa Cruz 公司。MIR-162-PC/MIR-262-PC 型培养箱购自日本松下公司;BD FACSCanto Ⅱ型流式细胞仪购自美国BD 公司;ABI StepOnePlus 荧光定量PCR仪购自美国Applied Biosystems 公司;MODEL550型酶标仪购自美国Bio-Rad公司。
1.2 研究方法
1.2.1 人膝关节软骨细胞分离和培养
取出软骨组织标本后剪碎,加入胰蛋白酶、Ⅱ型胶原酶后置于培养箱内消化细胞,接种于含10%胎牛血清的DMEM培养基,取第3代细胞进行后续实验[9]。
1.2.2 CCK-8法检测梓醇的细胞毒性
将软骨细胞以2 000个/孔接种于96孔板中。在37 ℃和5%CO2条件下孵育24 h后,用不同浓度的梓醇(0、0.1、1、10、20、50和100 ng/L)处理细胞24 h。每孔加入10 µL的CCK-8溶液。在37 ℃下孵育2 h,使用酶标仪测量各孔在450 nm波长处的吸光度(A450),计算细胞活力(%)=(经药物处理的细胞A450/对照细胞A450)×100%。
1.2.3 分组及处理
软骨细胞接种于6 孔板,加入含有10 µg/L IL-1β 的DMEM培养基培养48 h[10],记为IL-1β组,不含IL-1β的正常完全培养基培养的软骨细胞为对照(Con)组。分别加入含有不同浓度(10、20及50 ng/L)的梓醇[4]与IL-1β(10µg/L)培养24 h,分别记为IL-1β+梓醇-低组、IL-1β+梓醇-中组、IL-1β+梓醇-高组。采用脂质体转染法将miR-NC、miR-140-5p mimics分别转染至软骨细胞,转染成功后加入IL-1β(10µg/L)培养24 h,分别记为IL-1β+miR-NC 组、IL-1β+miR-140-5p组。采用脂质体转染法将anti-miR-NC、anti-miR-140-5p分别转染至软骨细胞,转染成功后加入梓醇(50 ng/L)、IL-1β(10µg/L)培养24 h,分别记为IL-1β+梓醇+anti-miR-NC 组、IL-1β+梓醇+anti-miR-140-5p组。
1.2.4 CCK-8法检测细胞活力
将各组软骨细胞接种到96孔板(2 000个/孔)中,按1.2.3进行分组与处理。培养24 h 后,每孔加入10 µL CCK-8 溶液。酶标仪检测每个孔中的A450值。
1.2.5 ELISA检测IL-6、TNF-α、IFN-γ水平
收集各组软骨细胞培养液,4 ℃下12 000×g离心10 min后吸取上清液,参照试剂盒说明书,检测各组IL-6、TNF-α、IFN-γ水平。
1.2.6 流式细胞术检测细胞凋亡
各组软骨细胞胰蛋白酶消化后,重悬于500µL结合缓冲液中。随后,加入5µL Annexin-V-FITC 和5µL PI 染色液,混合后避光孵育30 min。使用流式细胞仪检测细胞凋亡。
1.2.7 实时荧光定量(qPCR)检测miR-140-5p表达水平
用RNA 提取试剂盒提取各组软骨细胞总RNA,反转录合成cDNA,在荧光定量PCR仪上进行扩增。miR-140-5p引物:上游5'-CGCATGGCAGTGGTTTTACCCTA-3',下游5'-ATCCAGTGCAGGGTCCGAGG-3';U6引物:上游5'-CTCGCT TCGGCAGCACATATACT-3',下游5'-ACGCTTCACGAATTT GCGTGTC-3'。反应体系(20µL):SYBR mix 9.0µL、上下游引物各0.5µL、cDNA 模板2.0µL、RNase dH2O 8.0µL。反应条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火1 min,共40个循环;72 ℃延伸1 min。以U6为内参,2-ΔΔCt法计算miR-140-5p的相对表达量。
1.2.8 Western blot 法检测Cleaved-caspase 3、Cleavedcaspase 9蛋白相对表达水平
提取各组软骨细胞总蛋白,十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白质(30µg)并转移到聚偏二氟乙烯膜上。将膜封闭2 h,与一抗Cleaved-caspase 3(1∶1 000)、Cleavedcaspase 9(1∶1 000)、GAPDH 抗体(1∶2 000)在4 ℃孵育24 h,加二抗(1∶3 000)室温孵育1 h,用增强的化学发光试剂显影,Image J软件分析各条带灰度值。
1.3 统计学方法
采用SPSS 21.0软件进行数据分析。符合正态分布的计量资料以±s表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 梓醇对软骨细胞的细胞毒性作用
0、0.1、1、10、20、50 和100 ng/L 梓醇处理后,软骨细胞活性(%)分别为100.12±13.46、99.47±12.58、 98.56±13.11、 96.70±12.65、 95.82±12.39、96.35±12.42、93.47±12.51,差异无统计学意义(n=9,F=0.299,P>0.05),梓醇浓度在0~100 ng/L 之间对软骨细胞没有细胞毒性作用。
2.2 梓醇对IL-1β诱导软骨细胞的影响
2.2.1 细胞活力和炎症反应
与Con组比较,IL-1β组细胞活力降低,而IL-6、TNF-α、IFN-γ 水平升高(P<0.05);与IL-1β 组比较,IL-1β+梓醇-低组、IL-1β+梓醇-中组、IL-1β+梓醇-高组细胞活力升高,而IL-6、TNF-α、IFN-γ水平依次降低(P<0.05),见表1。
Tab.1 Comparison of chondrocyte viability and expression levels of inflammatory cytokines between the five groups表1 各组软骨细胞活力和炎性因子表达水平比较(n=9,±s)

Tab.1 Comparison of chondrocyte viability and expression levels of inflammatory cytokines between the five groups表1 各组软骨细胞活力和炎性因子表达水平比较(n=9,±s)
**P<0.01;a与Con组比较,b与IL-1β组比较,c与IL-1β+梓醇-低组比较,d与IL-1β+梓醇-中组比较,P<0.05。
组别Con组IL-1β组IL-1β+梓醇-低组IL-1β+梓醇-中组IL-1β+梓醇-高组F细胞活力/A450 0.78±0.08 0.31±0.04a 0.42±0.05ab 0.52±0.06abc 0.64±0.07abcd 80.005**IL-6/(ng/L)9.97±0.93 86.55±7.18a 64.19±5.47ab 43.40±4.87abc 16.67±1.39abcd 429.566**组别Con组IL-1β组IL-1β+梓醇-低组IL-1β+梓醇-中组IL-1β+梓醇-高组F TNF-α/(ng/L)5.78±0.56 74.05±7.01a 55.88±4.56ab 30.88±3.44abc 9.89±0.85bcd 471.325**IFN-γ/(ng/L)31.71±3.11 163.14±11.33a 115.22±10.34ab 79.56±7.38abc 44.61±4.17abcd 408.467**
2.2.2 细胞凋亡和miR-140-5p表达
与Con组比较,IL-1β组细胞凋亡率和Cleavedcaspase 3、Cleaved-caspase 9 蛋白表达水平升高,miR-140-5p表达水平降低(P<0.05);与IL-1β组比较,IL-1β+梓醇-低组、IL-1β+梓醇-中组、IL-1β+梓醇-高组细胞凋亡率和Cleaved-caspase 3、Cleavedcaspase 9蛋白表达水平依次降低,miR-140-5p表达水平依次升高(P<0.05),见图1、2,表2。
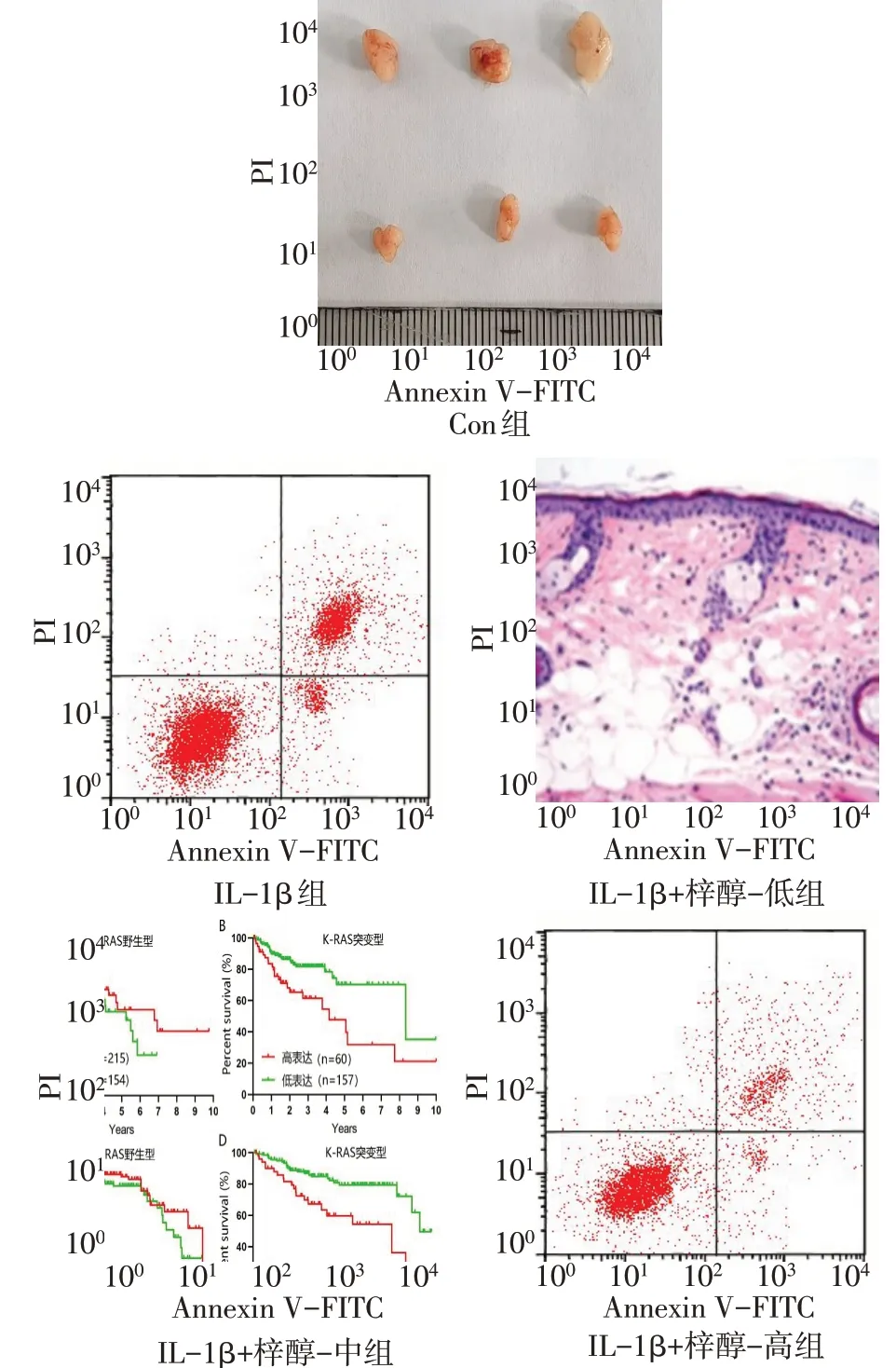
Fig.1 Apoptosis of chondrocytes in each group图1 各组软骨细胞凋亡水平
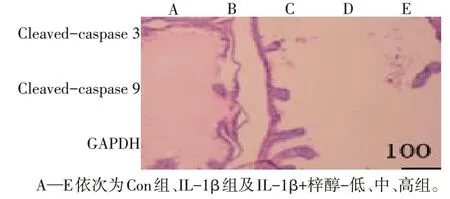
Fig.2 Expression levels of apoptosis-related proteins in each group图2 各组软骨细胞凋亡相关蛋白表达
Tab.2 Comparison of apoptosis rate,Cleaved-caspase 3,Cleaved-caspase 9 protein expression and miR-140-5p expression levels between the five groups表2 各组软骨细胞凋亡率、Cleaved-caspase 3、Cleavedcaspase 9蛋白表达和miR-140-5p表达水平比较(n=9,±s)
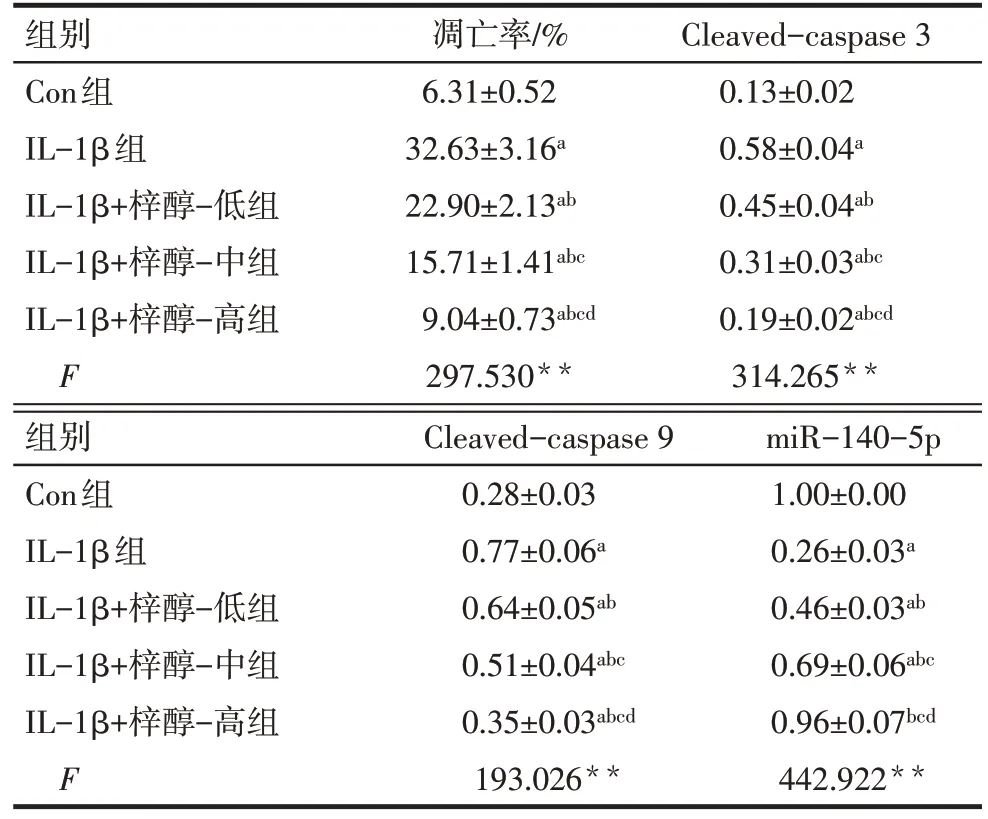
Tab.2 Comparison of apoptosis rate,Cleaved-caspase 3,Cleaved-caspase 9 protein expression and miR-140-5p expression levels between the five groups表2 各组软骨细胞凋亡率、Cleaved-caspase 3、Cleavedcaspase 9蛋白表达和miR-140-5p表达水平比较(n=9,±s)
**P<0.01;a与Con组比较,b与IL-1β组比较,c与IL-1β+梓醇-低组比较,d与IL-1β+梓醇-中组比较,P<0.05。
组别Con组IL-1β组IL-1β+梓醇-低组IL-1β+梓醇-中组IL-1β+梓醇-高组F凋亡率/%6.31±0.52 32.63±3.16a 22.90±2.13ab 15.71±1.41abc 9.04±0.73abcd 297.530**Cleaved-caspase 3 0.13±0.02 0.58±0.04a 0.45±0.04ab 0.31±0.03abc 0.19±0.02abcd 314.265**组别Con组IL-1β组IL-1β+梓醇-低组IL-1β+梓醇-中组IL-1β+梓醇-高组F Cleaved-caspase 9 0.28±0.03 0.77±0.06a 0.64±0.05ab 0.51±0.04abc 0.35±0.03abcd 193.026**miR-140-5p 1.00±0.00 0.26±0.03a 0.46±0.03ab 0.69±0.06abc 0.96±0.07bcd 442.922**
2.3 miR-140-5p 过表达对IL-1β 诱导后软骨细胞的影响
2.3.1 细胞活力和炎症反应
与IL-1β+miR-NC 组比较,IL-1β+miR-140-5p组细胞活力升高,而IL-6、TNF-α、IFN-γ 水平降低(P<0.05),见表3。
Tab.3 Comparison of cell viability and inflammatory cytokines in chondrocytes between the two groups表3 各组软骨细胞活力A值和炎性因子表达水平比较(n=9,±s)
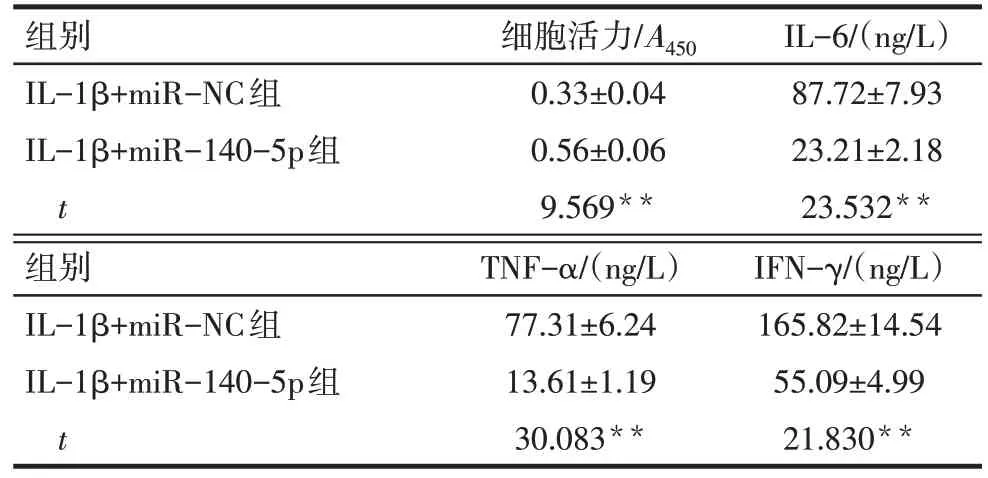
Tab.3 Comparison of cell viability and inflammatory cytokines in chondrocytes between the two groups表3 各组软骨细胞活力A值和炎性因子表达水平比较(n=9,±s)
**P<0.01。
组别IL-1β+miR-NC组IL-1β+miR-140-5p组t细胞活力/A450 0.33±0.04 0.56±0.06 9.569**IL-6/(ng/L)87.72±7.93 23.21±2.18 23.532**组别IL-1β+miR-NC组IL-1β+miR-140-5p组t TNF-α/(ng/L)77.31±6.24 13.61±1.19 30.083**IFN-γ/(ng/L)165.82±14.54 55.09±4.99 21.830**
2.3.2 细胞凋亡和Cleaved-caspase 3、Cleavedcaspase 9蛋白水平以及miR-140-5p表达
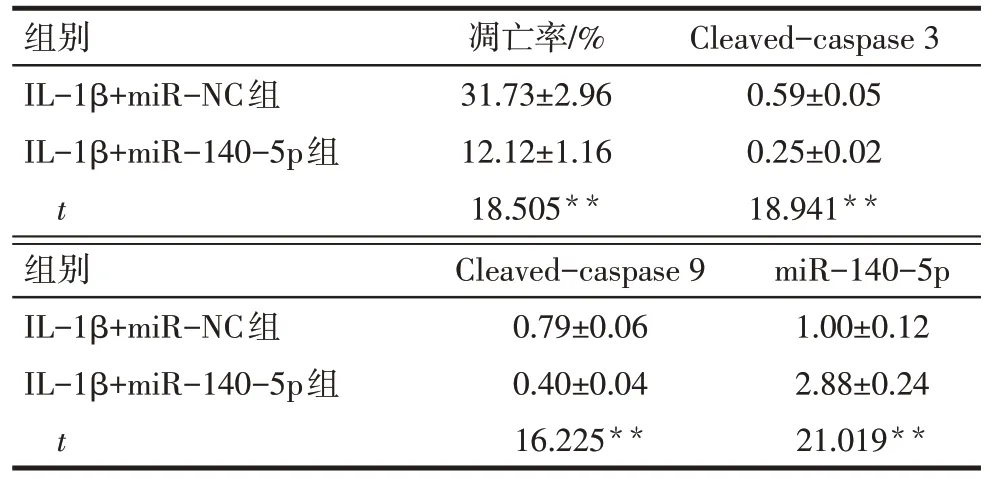
与IL-1β+miR-NC 组比较,IL-1β+miR-140-5p组细胞凋亡率、Cleaved-caspase 3、Cleaved-caspase 9蛋白水平降低,miR-140-5p 表达水平升高(P<0.01),见图3、表4。
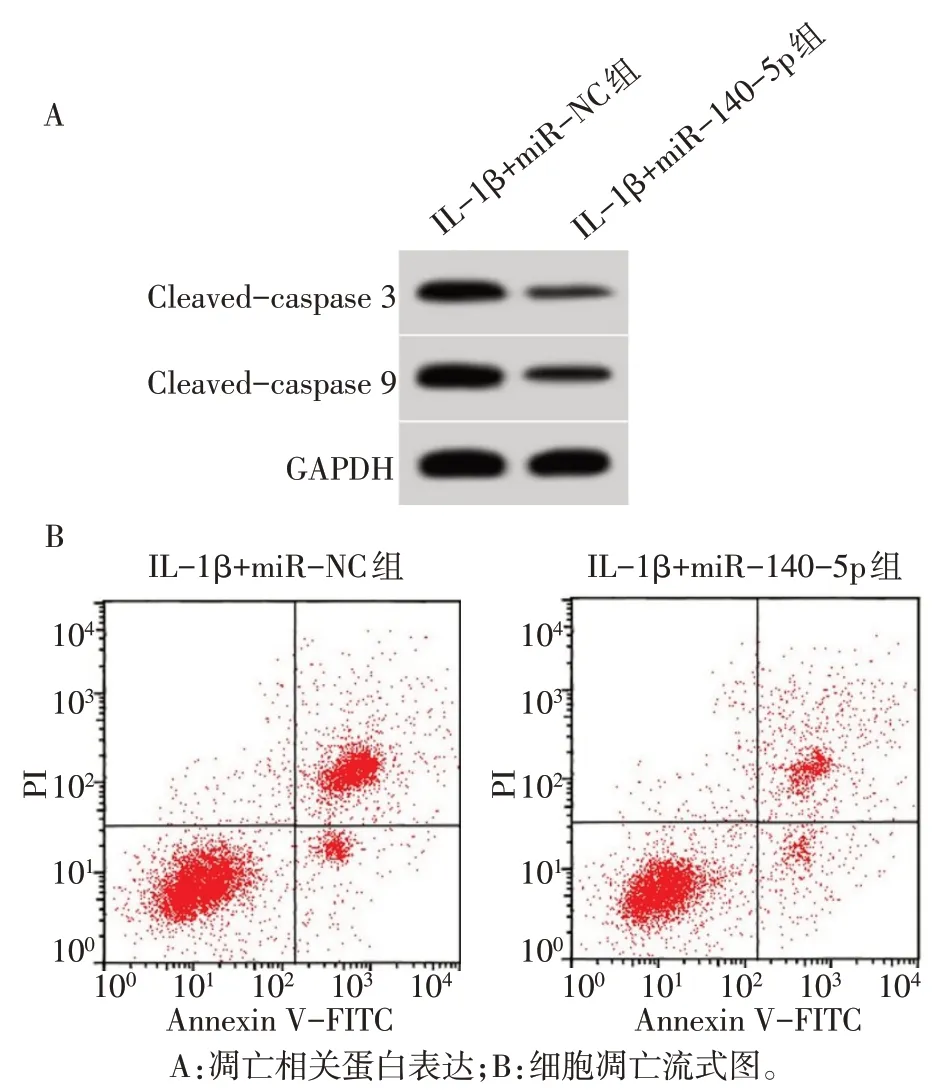
Fig.3 Apoptosis levels of chondrocytes in each group图3 过表达miR-140-5p后各组软骨细胞凋亡水平
Tab.4 Comparison of apoptosis rate,Cleaved-caspase 3,Cleaved-caspase 9 protein expression and miR-140-5p expression levels between the two groups表4 miR-140-5p过表达后各组软骨细胞凋亡率,Cleavedcaspase 3、Cleaved-caspase 9蛋白表达和miR-140-5p表达水平比较(n=9,±s)
Tab.4 Comparison of apoptosis rate,Cleaved-caspase 3,Cleaved-caspase 9 protein expression and miR-140-5p expression levels between the two groups表4 miR-140-5p过表达后各组软骨细胞凋亡率,Cleavedcaspase 3、Cleaved-caspase 9蛋白表达和miR-140-5p表达水平比较(n=9,±s)
**P<0.01。
组别IL-1β+miR-NC组IL-1β+miR-140-5p组t凋亡率/%31.73±2.96 12.12±1.16 18.505**Cleaved-caspase 3 0.59±0.05 0.25±0.02 18.941**组别IL-1β+miR-NC组IL-1β+miR-140-5p组t Cleaved-caspase 9 0.79±0.06 0.40±0.04 16.225**miR-140-5p 1.00±0.12 2.88±0.24 21.019**
2.4 下调miR-140-5p 表达逆转了梓醇对IL-1β 诱导软骨细胞损伤
2.4.1 细胞活力和炎症反应
与IL-1β+梓醇+anti-miR-NC组比较,IL-1β+梓醇+anti-miR-140-5p 组细胞活力降低,而IL-6、TNF-α、IFN-γ水平升高(P<0.01),见表5。
Tab.5 Comparison of cell viability and inflammatory cytokines in chondrocytes between the two groups表5 下调miR-140-5p后各组软骨细胞活力和炎性因子表达水平比较(n=9,±s)
**P<0.01。
组别IL-1β+梓醇+anti-miR-NC组IL-1β+梓醇+anti-miR-140-5p组t细胞活力/A450 0.65±0.06 0.39±0.04 10.817**IL-6/(ng/L)15.96±1.29 73.17±6.54 25.747**组别IL-1β+梓醇+anti-miR-NC组IL-1β+梓醇+anti-miR-140-5p组t TNF-α/(ng/L)9.07±0.75 61.39±5.07 30.625**IFN-γ/(ng/L)42.37±4.29 123.94±10.94 20.824**
2.4.2 细胞凋亡、Cleaved-caspase 3、Cleavedcaspase 9蛋白水平以及miR-140-5p表达
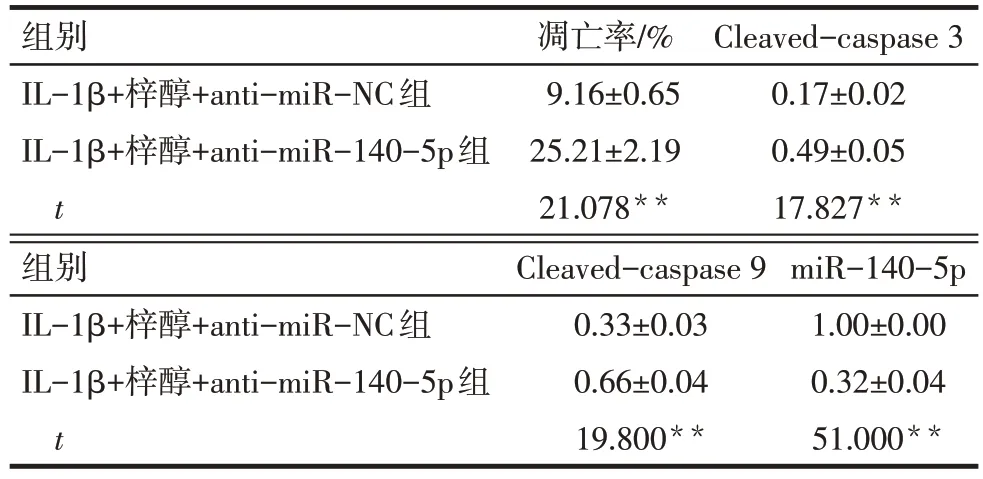
与IL-1β+梓醇+anti-miR-NC组比较,IL-1β+梓醇+anti-miR-140-5p 组细胞凋亡率,Cleavedcaspase 3、Cleaved-caspase 9 蛋白水平升高,miR-140-5p表达水平降低(P<0.01),见图4、表6。
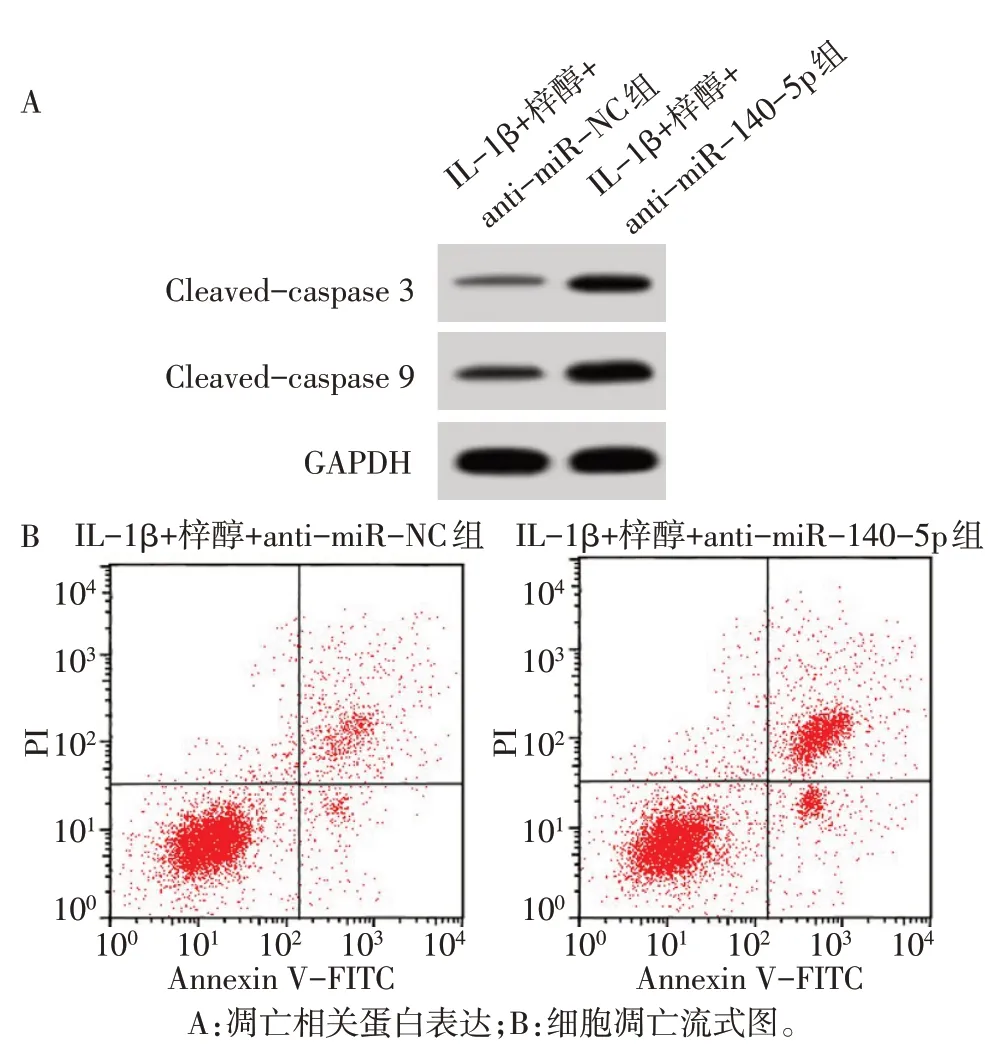
Fig.4 Apoptosis levels of chondrocytes in each group图4 下调miR-140-5p后各组软骨细胞凋亡水平
Tab.6 Comparison of apoptosis rate,Cleaved-caspase 3,Cleaved-caspase 9 protein expression and miR-140-5p expression levels between the two groups表6 下调miR-140-5p后各组软骨细胞凋亡率,Cleavedcaspase 3、Cleaved-caspase 9蛋白表达和miR-140-5p表达水平比较(n=9,±s)
Tab.6 Comparison of apoptosis rate,Cleaved-caspase 3,Cleaved-caspase 9 protein expression and miR-140-5p expression levels between the two groups表6 下调miR-140-5p后各组软骨细胞凋亡率,Cleavedcaspase 3、Cleaved-caspase 9蛋白表达和miR-140-5p表达水平比较(n=9,±s)
**P<0.01。
组别IL-1β+梓醇+anti-miR-NC组IL-1β+梓醇+anti-miR-140-5p组t凋亡率/%9.16±0.65 25.21±2.19 21.078**Cleaved-caspase 3 0.17±0.02 0.49±0.05 17.827**组别IL-1β+梓醇+anti-miR-NC组IL-1β+梓醇+anti-miR-140-5p组t Cleaved-caspase 9 0.33±0.03 0.66±0.04 19.800**miR-140-5p 1.00±0.00 0.32±0.04 51.000**
3 讨论
OA 的主要治疗药物是非甾体抗炎药,可缓解OA症状[11]。然而,长期使用非甾体抗炎药可能导致胃肠道和心血管疾病[12]。因此,寻找新的潜在治疗药物对改善OA 有重要意义。软骨细胞的过度凋亡和细胞炎症反应是OA 的主要病理特征。基于OA的发病机制,已有研究表明部分中药及其活性成分(如白藜芦醇、灯盏花乙素)可用于治疗OA,减轻软骨细胞损伤[13]。梓醇是一种从地黄根中分离出来的环烯醚萜苷,有抗炎作用[4-5,14]。IL-1β 可触发炎性细胞因子的释放以及软骨细胞凋亡,被广泛应用于OA 的病理生理学研究[5,10]。本研究结果显示,IL-1β 诱导的软骨细胞中IL-6、TNF-α、IFN-γ 水平升高,软骨细胞凋亡率和Cleaved-caspase 3、Cleavedcaspase 9 蛋白水平均升高,表明IL-1β 可诱导软骨细胞凋亡。曾允富等[4]研究显示,梓醇可抑制IL-1β诱导的软骨细胞凋亡。本研究亦显示,梓醇可降低促炎细胞因子水平和细胞凋亡率以及Cleavedcaspase 3、Cleaved-caspase 9 蛋白表达,提示梓醇可抑制IL-1β 诱导的软骨细胞炎性损伤和细胞凋亡,再次证实了梓醇可能是改善OA的潜在药物。
miRNA 在骨关节炎中表达异常,并可参与OA发生、发展[15-16]。miR-140-5p 是一种在OA 中特异性表达的新型非编码miRNA。研究显示,miR-140-5p 在人OA 软骨中表达降低[17]。过表达miR-140-5p对IL-1β诱导的软骨细胞炎症和细胞凋亡具有抑制作用[7]。本研究显示,在IL-1β 诱导的软骨细胞中,miR-140-5p 表达量较正常培养的软骨细胞降低,过表达miR-140-5p 后,IL-1β 诱导的软骨细胞凋亡和炎性损伤均减轻,表明miR-140-5p 在OA 中可能发挥保护作用。梓醇可增加IL-1β诱导的软骨细胞中miR-140-5p 的表达量,表明梓醇可促进miR-140-5p 表达。此外,下调miR-140-5p 表达可拮抗梓醇对IL-1β诱导的软骨细胞炎症及细胞凋亡的抑制作用,提示梓醇可能通过上调miR-140-5p减缓IL-1β诱导的软骨细胞炎症反应及凋亡。
综上所述,梓醇可通过上调miR-140-5p表达来减轻IL-1β诱导的软骨细胞炎性因子的释放以及凋亡,且miR-140-5p 可能是梓醇改善OA 的潜在靶点。在未来的研究中将对miR-140-5p 的下游靶标进行分析,并结合体内实验进一步验证梓醇对OA发挥保护作用的分子机制。

