芒柄花素对妊娠期糖尿病大鼠氧化应激损伤的影响
田亚静,杨雪,汪静,葛文杰,何玉玲
妊娠期糖尿病(gestational diabetes mellitus,GDM)是妊娠期发生的一种代谢异常性疾病,可导致流产、巨大儿、早产等不良结局[1-2]。GDM 患者体内产生过量的活性氧(reactive oxygen species,ROS),引发的强烈氧化应激是造成胎盘损伤与不良妊娠结局的主要原因,抗氧化药物可缓解氧化应激反应[3-4]。 核因子E2 相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)在维持氧化还原稳态中起重要作用,激活Nrf2 可抑制高血糖诱导的氧化应激和炎症反应[5],还可上调抗氧化基因血红素单加氧酶-1(hemeoxygenase-1,HO-1)/磷酸酰胺腺嘌呤二核苷酸醌氧化还原酶-1(NADPH quinine oxidoreductase-1,NQO1)表达水平,有效减轻哮喘小鼠炎症和氧化应激损伤[6]。通过激活Nrf2/HO-1 可改善GDM 小鼠葡萄糖不耐受,抑制体内氧化应激,最终改善生殖结局[7]。因此,笔者推测Nrf2/HO-1/NQO1是防治GDM的重要作用靶点。芒柄花素又称刺芒柄花素,是一种异黄酮类化合物,为天然抗氧化剂。研究显示,芒柄花素能用于多种心脑血管疾病的治疗,还可激活Nrf2/HO-1信号通路,进而降低糖尿病肾病大鼠血糖、血脂,抑制其肾组织氧化应激损伤[8-9]。本研究以不同剂量芒柄花素处理GDM模型大鼠,旨在探讨芒柄花素是否可通过激活Nrf2/HO-1/NQO1信号通路来减轻GDM大鼠氧化应激损伤。
1 材料与方法
1.1 主要材料
SPF 级SD 大鼠130 只,雌雄各半,7 周龄左右,体质量200~260 g,购自广州赛业百沐生物科技有限公司,动物生产许可证号:SCXK(粤)2020-0055。在屏障环境中分笼饲养,4只/笼,饲养严格参照《中华人民共和国实验动物管理条例》进行。链脲佐菌素(纯度≥98%)、Nrf2 抑制剂ML385(纯度≥98%)、芒柄花素(纯度≥99%)均购自北京索莱宝科技有限公司;丙二醛(malondialdehyde,MDA)测定试剂盒、谷胱甘肽(glutathione,GSH)测定试剂盒、总抗氧化能力(total antioxidant capacity,TAC)检测试剂盒均购自南京建成生物工程研究所;兔源抗大鼠β-actin 一抗、兔源抗大鼠Nrf2 一抗、超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒、兔源抗大鼠HO-1 一抗、辣根过氧化物酶(horseradish peroxidase,HRP)偶联羊抗兔二抗、兔源抗大鼠NQO1一抗均购自英国Abcam 公司。全自动生化分析仪(型号PM4)购自天津微纳芯科技有限公司;透射电子显微镜(型号Talos L120C)购自北京欧波同光学技术有限公司;酶标仪(型号YT-MB96A)购自山东云唐智能科技有限公司;双胶迷你垂直电泳槽(型号VE-180)、转印电泳槽(型号VE-186)购自南京普阳科学仪器研究所等。
1.2 研究方法
1.2.1 GDM模型建立及分组
参照文献[10]建立GDM 大鼠模型:选择空腹血糖(fasting serum glucose,FSG)值正常的SD 大鼠,雌雄比为1∶1合笼过夜,次日检查阴道栓得到孕鼠56只(记为孕0 d),随机抽取47 只于其腹腔内注射45 mg/kg 的链脲佐菌素,孕3 d 测量FSG,≥16.7 mmol/L 表示GDM 造模成功。共成功造模45只,按随机数字表法分为模型组、芒柄花素低剂量(50 mg/kg)组[11]、芒柄花素高剂量(100 mg/kg)组[11]、ML385(20 mg/kg)组[12]、芒柄花素高剂量+ML385组,每组9只;另取9只正常妊娠大鼠作为对照组。芒柄花素和ML385均以生理盐水溶解至所需浓度,分别采取腹腔注射和灌胃给药,对照组给予等剂量生理盐水,各组均于孕3 d给药,1次/d,持续至孕19 d。
1.2.2 大鼠体质量及糖脂代谢指标测定
孕20 d时以乙醚麻醉大鼠(提前禁食禁水12 h),测量其体质量后采集尾静脉血,放入全自动生化分析仪中检测FSG、总胆固醇(TC)、三酰甘油(TG)水平。
1.2.3 胚胎存活率、胎鼠体质量及胎盘形态观察
糖脂代谢测定结束后处死各组大鼠,取1.5 mL 尾静脉血,于4 ℃、3 000 r/min 离心10 min 取上清液,-80 ℃保存备用。纵向切开腹腔及子宫,从子宫中取出胎鼠和胎盘,对胎鼠进行计数并称质量,得出其平均体质量,计数存活胚胎数和总胚胎数(即总着床点数),计算胚胎存活率=存活胚胎数/总胚胎数×100%。肉眼观察各组胎盘的颜色、外观后剪取约0.8 g 胎盘组织保存在液氮备用,剩余胎盘组织浸入含0.05 mol/L蔗糖的钙藻酸盐缓冲液中固定,1 h后浸没入2.5%戊二醛中于4 ℃下继续固定24 h,使用透射电子显微镜观察胎盘超微结构并采集图像。
1.2.4 血清及胎盘组织MDA、GSH、SOD和TAC水平检测
取1.2.3 中保存在液氮中的胎盘组织,加入高强度RIPA裂解液匀浆,4 ℃、3 000 r/min 离心20 min 取上清液,以BCA法测定蛋白总浓度后每组取300 µL。取1.2.3 中保存在-80 ℃中的血清于冰水浴中解冻后每组取300µL,按照试剂盒说明书分别检测血清及胎盘组织中MDA、GSH、SOD 和TAC水平。
1.2.5 Western blot法检测胎盘组织Nrf2/HO-1/NQO1通路蛋白相对表达水平
自1.2.4 中各组剩余的胎盘组织蛋白样品液中取50 µg总蛋白上样,跑电泳、转膜、5%脱脂奶粉室温封闭2.5 h后,剪下检测蛋白条带分别孵育兔源抗大鼠β-actin、Nrf2、HO-1、NQO1一抗(稀释比均为1∶2 000),4 ℃过夜后TBST振荡洗膜3 次,室温孵育HRP 偶联羊抗兔二抗(1∶1 000),2 h 后TBST振荡洗膜3次,通过增强化学发光法显色并采集蛋白条带图像,使用Image J软件分析定量各组蛋白相对表达水平。
1.3 统计学方法
采用GraphPad Prism 8.0.1 软件进行数据分析。符合正态分布的计量数据以±s表示,多组间比较采用单因素方差分析,组间多重比较用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠体质量及糖脂代谢水平比较
与对照组比较,模型组体质量及FSG、TG、TC水平升高(P<0.05)。与模型组比较,芒柄花素低剂量组、芒柄花素高剂量组大鼠体质量及FSG、TG、TC水平均降低(P<0.05),而ML385 组大鼠体质量及FSG、TG、TC 水平升高(P<0.05)。与芒柄花素低剂量组比较,芒柄花素高剂量组体质量及FSG、TG、TC水平降低(P<0.05)。与ML385组比较,芒柄花素高剂量+ML385组大鼠体质量及FSG、TG、TC水平降低(P<0.05)。见表1。
Tab.1 Comparison of body weight,blood glucose and blood lipid levels of rats between the six groups表1 各组大鼠体质量及血糖、血脂水平比较(n=9,±s)

Tab.1 Comparison of body weight,blood glucose and blood lipid levels of rats between the six groups表1 各组大鼠体质量及血糖、血脂水平比较(n=9,±s)
**P<0.01;a与对照组比较,b与模型组比较,c与芒柄花素低剂量组比较,d与ML385组比较,P<0.05;表2—5同。
组别对照组模型组芒柄花素低剂量组芒柄花素高剂量组ML385组芒柄花素高剂量+ML385组F母体体质量/g 306.85±6.20 356.34±7.14a 332.68±5.25b 310.02±4.39bc 372.69±7.81b 351.73±6.92d 154.591**FSG/(mmol/L)3.54±0.38 17.42±3.13a 10.83±2.34b 4.02±0.54bc 26.79±3.48b 15.21±2.95d 115.158**TG/(mmol/L)0.75±0.08 1.48±0.14a 1.13±0.10b 0.81±0.09bc 1.95±0.19b 1.43±0.12d 117.919**TC/(mmol/L)2.70±0.24 5.15±0.56a 3.89±0.40b 2.78±0.29bc 6.26±0.48b 5.08±0.41d 108.771**
2.2 各组胚胎存活率及胎鼠体质量比较
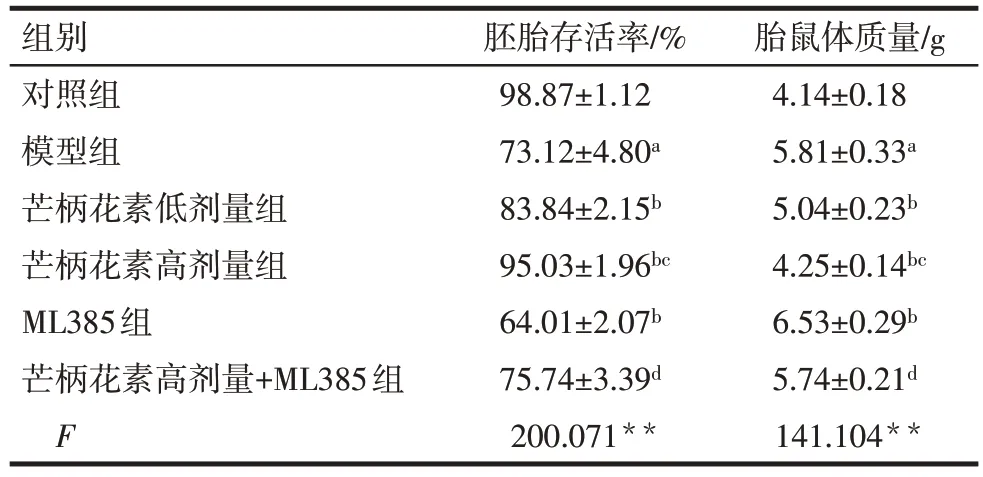
与对照组比较,模型组大鼠胚胎存活率降低,胎鼠体质量升高(P<0.05)。与模型组比较,芒柄花素低剂量组、芒柄花素高剂量组大鼠胚胎存活率均升高,胎鼠体质量均降低(P<0.05),而ML385 组大鼠胚胎存活率降低,胎鼠体质量升高(P<0.05)。与芒柄花素低剂量组比较,芒柄花素高剂量组大鼠胚胎存活率升高,胎鼠体质量降低(P<0.05)。与ML385组比较,芒柄花素高剂量+ML385组大鼠胚胎存活率升高,胎鼠体质量降低(P<0.05)。见表2。
Tab.2 Embryo survival rate and fetal weight of rats in each group表2 各组大鼠胚胎存活率及胎鼠体质量(n=9,±s)
Tab.2 Embryo survival rate and fetal weight of rats in each group表2 各组大鼠胚胎存活率及胎鼠体质量(n=9,±s)
组别对照组模型组芒柄花素低剂量组芒柄花素高剂量组ML385组芒柄花素高剂量+ML385组F胚胎存活率/%98.87±1.12 73.12±4.80a 83.84±2.15b 95.03±1.96bc 64.01±2.07b 75.74±3.39d 200.071**胎鼠体质量/g 4.14±0.18 5.81±0.33a 5.04±0.23b 4.25±0.14bc 6.53±0.29b 5.74±0.21d 141.104**
2.3 各组大鼠胎盘形态比较
对照组大鼠胎盘超微结构正常,无损伤表现。模型组大鼠胎盘超微结构发生损伤:滋养层细胞出现空泡且微绒毛密度降低,与血管内皮细胞之间连接松散。与模型组比较,芒柄花素低剂量组、芒柄花素高剂量组大鼠胎盘超微结构损伤表现均减轻,芒柄花素高剂量组大鼠胎盘超微结构损伤表现相比芒柄花素低剂量组进一步减轻;ML385 组大鼠胎盘超微结构损伤表现加重。与ML385 组比较,芒柄花素高剂量+ML385组大鼠胎盘超微结构损伤表现减轻。见图1。
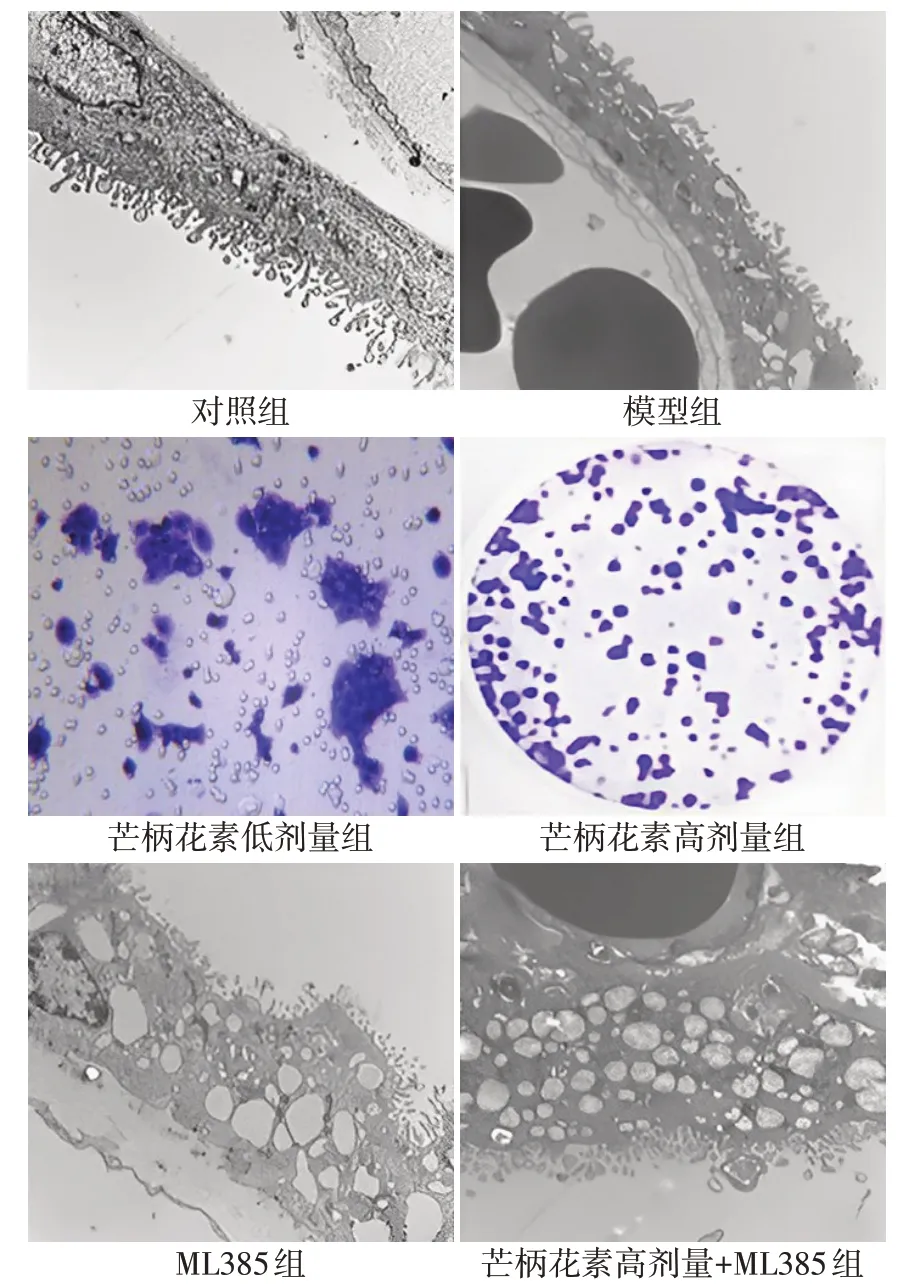
Fig.1 Ultrastructure of placental tissue of rats in each group observed by transmission electron microscope(×25 000)图1 透射电镜观察各组大鼠胎盘组织超微结构(×25 000)
2.4 各组血清及胎盘组织氧化应激指标比较
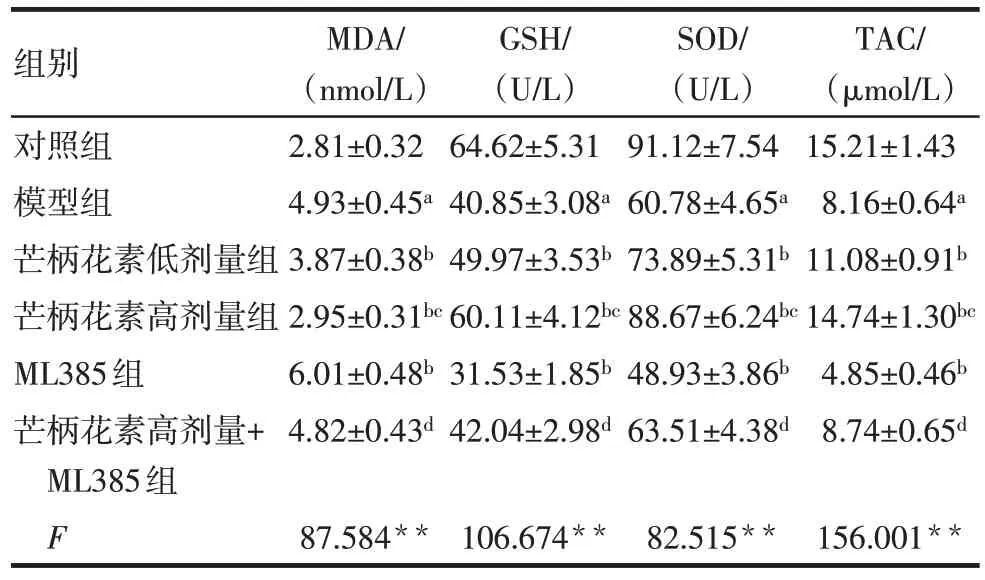
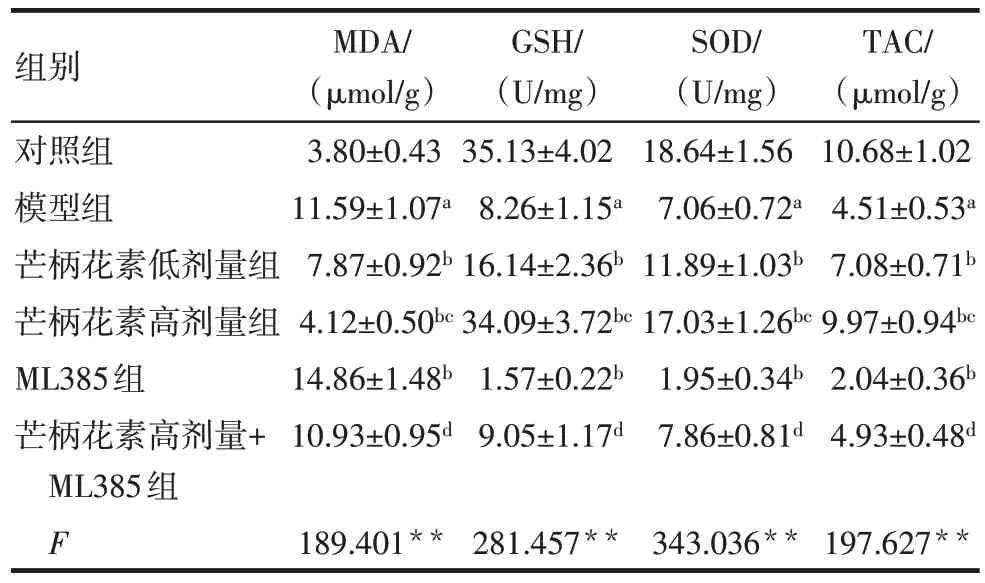
与对照组比较,模型组大鼠血清及胎盘组织MDA 水平升高,GSH、SOD 和TAC 水平降低(P<0.05)。与模型组比较,芒柄花素低剂量组、芒柄花素高剂量组大鼠血清及胎盘组织MDA水平均降低,GSH、SOD 和TAC 水平均升高(P<0.05),而ML385组大鼠血清及胎盘组织MDA 水平升高,GSH、SOD和TAC 水平降低(P<0.05)。与芒柄花素低剂量组比较,芒柄花素高剂量组大鼠血清及胎盘组织MDA水平降低,GSH、SOD 和TAC 水平升高(P<0.05)。与ML385 组比较,芒柄花素高剂量+ML385 组大鼠血清及胎盘组织MDA 水平降低,GSH、SOD 和TAC水平升高(P<0.05)。见表3、4。
Tab.3 Serum levels of MDA,GSH,SOD and TAC in rats of each group表3 各组大鼠血清氧化应激指标MDA、GSH、SOD和TAC水平(n=9,±s)
Tab.3 Serum levels of MDA,GSH,SOD and TAC in rats of each group表3 各组大鼠血清氧化应激指标MDA、GSH、SOD和TAC水平(n=9,±s)
组别对照组模型组芒柄花素低剂量组芒柄花素高剂量组ML385组芒柄花素高剂量+ML385组F MDA/(nmol/L)2.81±0.32 4.93±0.45a 3.87±0.38b 2.95±0.31bc 6.01±0.48b 4.82±0.43d 87.584**GSH/(U/L)64.62±5.31 40.85±3.08a 49.97±3.53b 60.11±4.12bc 31.53±1.85b 42.04±2.98d 106.674**SOD/(U/L)91.12±7.54 60.78±4.65a 73.89±5.31b 88.67±6.24bc 48.93±3.86b 63.51±4.38d 82.515**TAC/(µmol/L)15.21±1.43 8.16±0.64a 11.08±0.91b 14.74±1.30bc 4.85±0.46b 8.74±0.65d 156.001**
Tab.4 Levels of MDA,GSH,SOD and TAC in placental tissue of rats in each group表4 各组大鼠胎盘组织氧化应激指标MDA、GSH、SOD和TAC水平(n=9,±s)
Tab.4 Levels of MDA,GSH,SOD and TAC in placental tissue of rats in each group表4 各组大鼠胎盘组织氧化应激指标MDA、GSH、SOD和TAC水平(n=9,±s)
组别对照组模型组芒柄花素低剂量组芒柄花素高剂量组ML385组芒柄花素高剂量+ML385组F MDA/(µmol/g)3.80±0.43 11.59±1.07a 7.87±0.92b 4.12±0.50bc 14.86±1.48b 10.93±0.95d 189.401**GSH/(U/mg)35.13±4.02 8.26±1.15a 16.14±2.36b 34.09±3.72bc 1.57±0.22b 9.05±1.17d 281.457**SOD/(U/mg)18.64±1.56 7.06±0.72a 11.89±1.03b 17.03±1.26bc 1.95±0.34b 7.86±0.81d 343.036**TAC/(µmol/g)10.68±1.02 4.51±0.53a 7.08±0.71b 9.97±0.94bc 2.04±0.36b 4.93±0.48d 197.627**
2.5 各组胎盘组织Nrf2/HO-1/NQO1信号通路蛋白表达水平比较
与对照组比较,模型组大鼠胎盘组织Nrf2、HO-1、NQO1蛋白表达降低(P<0.05)。与模型组比较,芒柄花素低剂量组、芒柄花素高剂量组大鼠胎盘组织Nrf2、HO-1、NQO1 蛋白表达均升高(P<0.05),而ML385组大鼠胎盘组织Nrf2、HO-1、NQO1蛋白表达降低(P<0.05)。与芒柄花素低剂量组比较,芒柄花素高剂量组大鼠胎盘组织Nrf2、HO-1、NQO1蛋白表达升高(P<0.05)。与ML385组比较,芒柄花素高剂量+ML385 组大鼠胎盘组织Nrf2、HO-1、NQO1 蛋白表达升高(P<0.05)。见图2、表5。
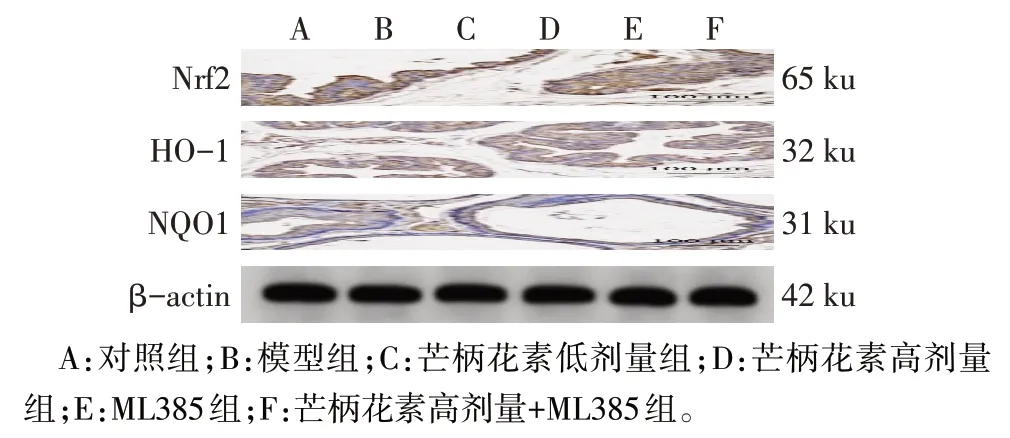
Fig.2 Expression of Nrf2/HO-1/NQO1 pathway protein in placental tissue of rats in each group detected by Western blot assay图2 各组大鼠胎盘组织Nrf2/HO-1/NQO1通路蛋白表达
Tab.5 Relative expression level of Nrf2/HO-1/NQO1 pathway protein in placental tissue of rats in each group表5 各组大鼠胎盘组织Nrf2/HO-1/NQO1通路蛋白相对表达水平(n=9,±s)
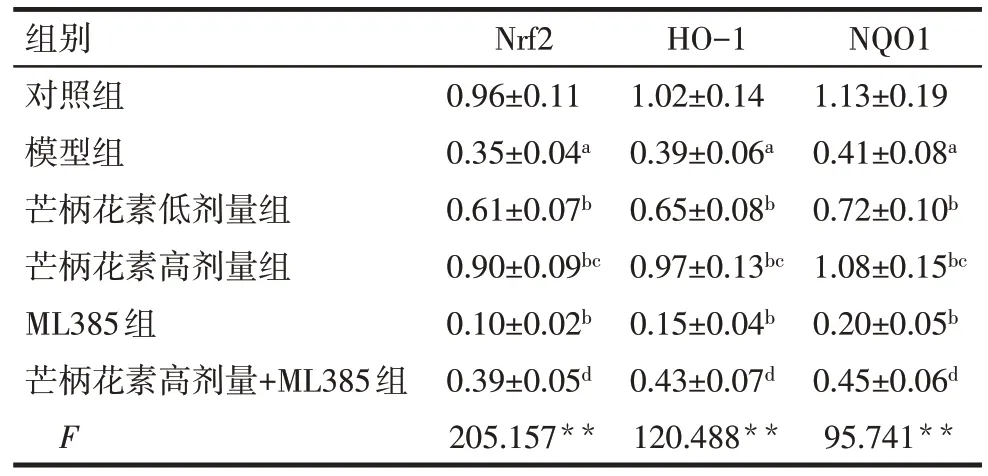
Tab.5 Relative expression level of Nrf2/HO-1/NQO1 pathway protein in placental tissue of rats in each group表5 各组大鼠胎盘组织Nrf2/HO-1/NQO1通路蛋白相对表达水平(n=9,±s)
组别对照组模型组芒柄花素低剂量组芒柄花素高剂量组ML385组芒柄花素高剂量+ML385组F Nrf2 0.96±0.11 0.35±0.04a 0.61±0.07b 0.90±0.09bc 0.10±0.02b 0.39±0.05d 205.157**HO-1 1.02±0.14 0.39±0.06a 0.65±0.08b 0.97±0.13bc 0.15±0.04b 0.43±0.07d 120.488**NQO1 1.13±0.19 0.41±0.08a 0.72±0.10b 1.08±0.15bc 0.20±0.05b 0.45±0.06d 95.741**
3 讨论
目前,口服降糖药和胰岛素注射是GDM主要治疗方案,但长期应用对母婴均可造成一定危害[13-14]。本研究采用腹腔注射链脲佐菌素的方法诱导建立GDM模型,结果显示造模大鼠体质量、FSG、TG、TC、胎鼠体质量较对照组升高,抗氧化活力降低,致使大鼠胎盘萎缩且超微结构发生损伤,胚胎存活率明显降低,表明链脲佐菌素可导致孕鼠糖脂代谢紊乱,引发高强度氧化应激,损害胎盘结构及胎鼠正常发育,导致不良妊娠结局。
GDM发病机制复杂,其中ROS过量产生及抗氧化能力下降是重要的发病机制之一,拮抗患者体内氧化应激损伤是防治GDM 的有效手段[3-4,15-16]。芒柄花素是一种天然抗氧化剂,能通过提升机体抗氧化活力而对组织器官发挥保护作用[8]。它可通过减轻氧化应激而改善脓毒症诱导的大鼠急性肾功能损伤[17],还可缓解糖尿病小鼠氧化应激损伤,改善其认知功能[18],因而预测芒柄花素可能用于防治GDM。本研究结果显示,与模型组比较,芒柄花素低剂量和高剂量组大鼠血清及胎盘组织GSH、SOD、TAC水平升高,胚胎存活率升高,母体体质量、FSG、TG、TC、胎鼠体质量、血清及胎盘组织MDA 水平降低,表明芒柄花素可改善糖脂代谢,降低GDM大鼠血糖及血脂水平,提升其抗氧化活力,抑制氧化应激反应,减轻大鼠胎盘结构损伤,促使胎鼠存活,提示芒柄花素能减轻GDM 大鼠氧化应激损伤,芒柄花素在GDM的防治中有很好的发展前景。
Nrf2/HO-1/NQO1是机体内重要的抗氧化信号,可通过调控氧化应激反应来参与缺血性脑卒中、GDM 等疾病的发生、发展过程,激活该通路可抑制氧糖剥夺/复氧诱导的海马神经元ROS 和过氧化产物MDA 生成,提升抗氧化酶活性,通过抑制氧化应激发挥神经保护作用[19]。恢复GDM小鼠Nrf2/HO-1信号活性可减轻其体内氧化应激,改善GDM症状及不良妊娠结局[20]。张馨允等[9]研究表明,芒柄花素可激活Nrf2/HO-1 信号,减轻糖尿病肾病大鼠肾脏氧化应激损伤。本研究结果显示,与模型组比较,ML385组大鼠血清及胎盘组织GSH、SOD、TAC水平下降,胎盘组织Nrf2、HO-1、NQO1 蛋白表达及胚胎存活率降低,母体体质量、FSG、TG、TC、胎鼠体质量、血清及胎盘组织MDA 水平升高,表明抑制Nrf2表达可增强GDM大鼠体内氧化应激反应,加重胎盘结构损伤及不良妊娠结局。与ML385 组比较,芒柄花素高剂量+ML385 组大鼠血清及胎盘组织GSH、SOD、TAC 水平升高,胎盘组织Nrf2、HO-1、NQO1蛋白表达及胚胎存活率升高,母体体质量、FSG、TG、TC、胎鼠体质量、血清及胎盘组织MDA水平降低,说明芒柄花素可逆转ML385的作用,提示芒柄花素减轻GDM大鼠氧化应激损伤是通过激活Nrf2信号实现。
综上所述,芒柄花素可改善GDM 大鼠糖脂代谢,降低其血糖血脂,增强抗氧化活性,抑制大鼠体内氧化应激,减轻其胎盘损伤,提高胎鼠发育存活率,改善不良妊娠结局,激活Nrf2/HO-1/NQO1 信号通路可能是其药理机制之一。本文证实了芒柄花素对GDM 的防治作用,为其临床应用提供了理论依据,但其具体的药理机制还不够深入,Nrf2信号下游分子调控机制不清楚,还需更多实验进行深入探讨。

