紫杉醇药代动力学参数TC>0.05临床应用横断面调查及影响因素分析*
黄玲玲,王君萍,吴正宇,吴婷婷,姚 媛,陈美玲,朱文靖,朱凤琴
中国科学院合肥肿瘤医院 1药学中心;2妇科肿瘤中心,合肥 230031
紫杉醇(paclitaxel,PTX)属于广谱抗肿瘤药物,广泛应用于卵巢癌、乳腺癌、肺癌、头颈部肿瘤、食管癌、胃癌及软组织肉瘤等化疗。临床上PTX 的给药剂量是基于患者体表面积(body surface area,BSA)方法计算,然而基于BSA 计算给药剂量未考虑到个体间代谢差异[1],导致PTX 疗效的不确定性和不良反应的发生。药代动力学参数临界血药浓度(0.05 μmol·L-1)以上暴露时间(TC>0.05)是衡量PTX化疗后体内药物暴露量的重要参数,国内外研究表明TC>0.05大小与PTX 化疗毒性和近期疗效密切相关。JOERGER M 等设定PTX 药代动力学参数TC>0.05靶目标为26~31 h 时,可显著降低PTX 3 周方案化疗的中性粒细胞减少发生率[2]。国内学者发现TC>0.05靶目标为26~30 h 时,PTX 化疗疗效好、血液毒性发生率低[3]。在真实世界中,基于TC>0.05对PTX 化疗疗效、血液毒性预测性尚不清楚。因此,本文采用横断面调查研究方法,分析PTX 药代动力学参数TC>0.05在真实世界中的应用情况及TC>0.05的影响因素,旨在为临床合理使用PTX 药代动力学参数TC>0.05提供参考。
1 资料与方法
1.1 资料来源和调查方法
调查对象为2019 年11 月~2021 年12 月出院的89 例实体肿瘤患者。纳入标准:①病理诊断为恶性肿瘤患者;②年龄≥18 岁;③KPS 评分≥70 分;④化疗前血常规、心功能和肝肾功能正常。排除标准:①严重肝肾功能不全者;②死亡病例;③化疗超过6 个周期。收集患者年龄、身高、体重、KPS 评分、临床诊断、化疗方案、血药浓度监测结果、血常规数据及近期疗效评估结果。
1.2 PTX 给药方案
参照中国临床肿瘤学会(Chinese Society of Clincal Oncology,CSCO)指南,患者接受含PTX(紫杉醇注射液,辰欣药业股份有限公司,国药准字H20057404,规格10 mL∶60 mg;注射用紫杉醇脂质体,南京绿叶制药有限公司,国药准字号H20030357,规格30 mg)的3 周化疗方案,PTX 用药剂量为135~175 mg·m-2。
1.3 PTX 血药浓度监测及其药代动力学参数TC>0.05的计算
在PTX 静脉滴注开始后18~30 h 内采集一次血样,并准确记录滴注开始时间、结束时间和采血时间。采集静脉血2 mL,EDTA 抗凝,3500 r·min-1离心15 min,取上层血浆,进行PTX 血药浓度分析。PTX 血药浓度监测采用免疫比浊法。利用迪瑞CS600 生化仪、MyPaclitaxelTM试剂盒(江苏长星医疗科技有限公司)测定血浆PTX 血药浓度。利用My-Care 药物暴露计算器,根据患者PTX 血药浓度、滴注开始和滴注结束时间计算PTX 药代动力学参数TC>0.05[4]。
1.4 评价标准
1.4.1 近期疗效评价 按照WHO 实体瘤疗效评价标准,分为完全缓解(complete response,CR)、部分缓解(partial responses,PR)、稳定(stable diseases,SD)和进展(progressed disease,PD)。疗效评价为CR、PR 和SD 作为临床获益组,疗效评价为PD 作为疾病进展组。
1.4.2 血液学毒性评价 按照美国国立癌症研究院通用不良事件术语标准4.0 版(Common Terminology Criteriafor Adverse Events,CTCAE v4.0)评价患者治疗中出现的不良反应,分为0~Ⅳ级。Ⅰ级:白细胞3.0×109/L~正常值、嗜中性粒细胞1.5×109/L~正常值;Ⅱ级:白细胞(2.0~3.0)×109/L、嗜中性粒细胞(1.0~1.5)×109/L;Ⅲ级:白细胞(1.0~2.0)×109/L、嗜中性粒细胞(0.5~1.0)×109/L;Ⅳ级:白细胞<1.0×109/L、嗜中性粒细胞<0.5×109/L。
1.5 统计学方法
采用SPSS 26.0 进行数据分析,对于不服从正态分布的资料,使用中位数(上四分位数,下四分位数)进行描述,使用非参数检验(Kruskal-Wallis 检验和U 检验)进行差异性分析;定性资料使用频数(%)的形式进行描述,使用卡方分析法(包括连续性校正法和Fisher 确切概率法)对计数资料进行分析。P <0.05 为差异有统计学意义,本次检验均为双侧检验。
2 结果
2.1 患者一般情况
共89 例患者、133 例次血药浓度结果被纳入研究。其中女性50 例(56.18%),男性39 例(43.82%),年龄33~76 岁,平均(57.58±9.37)岁。PTX 最低用药剂量180~300 mg,平均(217.93±21.61)mg。患者BSA 1.30~2.20 m2,平均(1.69±0.28)m2。
肿瘤类型分布:妇科肿瘤(36 例,40.45%)、头颈部肿瘤(33 例,37.08%)、肺癌(8 例,9.00%)、食管癌(8 例,9.00%)、阴茎癌(2 例,2.24%)、乳腺癌(1 例,1.12%)和胃癌(1 例,1.12%)。
2.2 患者PTX 血药浓度监测结果分布
PTX 药代动力学参数TC>0.05范围为16~57 h,平均值为(30.98±7.05)h。结合已报道的结果[3],将TC>0.05按照<26 h、26~31 h 和>31 h 范围进行分组,各组间例次构成比差异无统计学意义(P >0.05),详见表1。
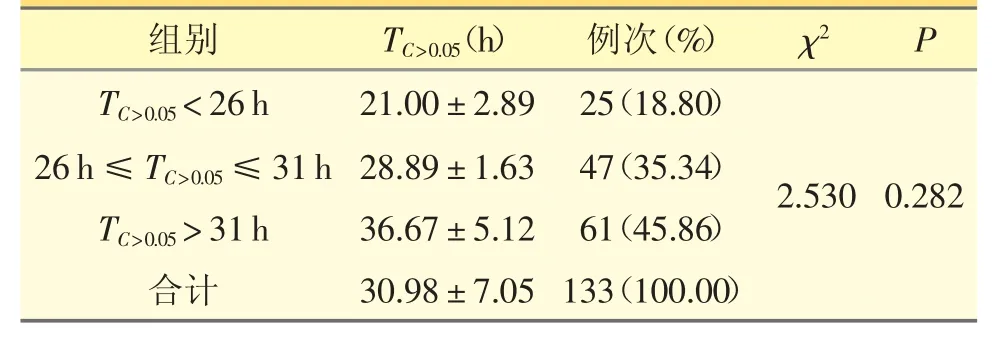
表1 患者PTX 血药浓度监测结果分布
2.3 血液毒性与PTX 药代动力学参数TC>0.05 的关系
本次研究中8 例次PTX 血药浓度监测后未获取血常规检查结果,最终共87 例患者125 例次PTX 血药浓度监测结果和化疗后数据被纳入此次血液学毒性结果分析,见表2。化疗后血液学毒性0 级TC>0.05中位数为27.00(31.00,37.00)h,Ⅰ~Ⅱ级TC>0.05中位数为27.00(31.00,33.25)h,Ⅲ~Ⅳ级TC>0.05为29.50(32.00,35.25)h,差异无统计学意义(H=1.937,P=0.380)。TC>0.05不同范围组之间Ⅲ~Ⅳ级血液学毒性发生率差异无统计学意义(χ2=3.226,P=0.521)。
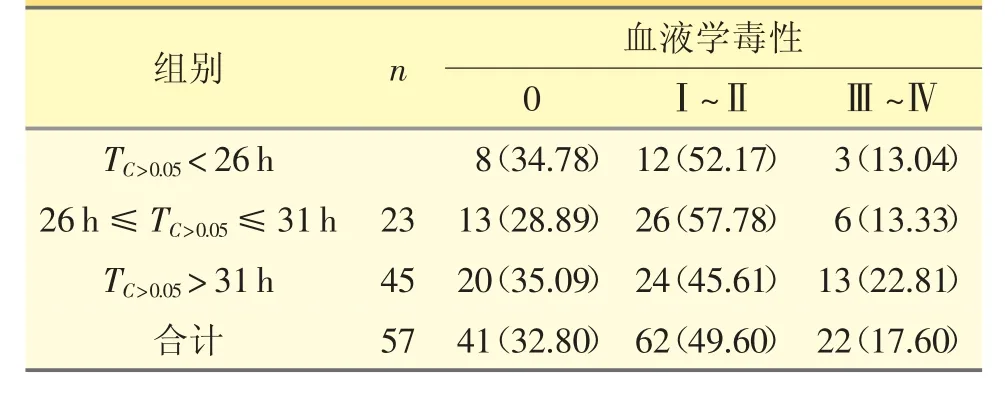
表2 血液学毒性与PTX TC >0.05 的关系[n(%)]
2.4 近期疗效与PTX 药代动力学参数TC>0.05 的关系
本次研究中,术后辅助化疗患者26 例,近期疗效评估结果无法追踪患者18 例,最终45 例患者69例次血药浓度监测结果被纳入TC>0.05与近期疗效关系的分析,如表3 所示。疾病进展组与疾病获益组TC>0.05差异无统计学意义(Z=-0.159,P=0.874)。TC>0.05不同范围组之间获益率差异无统计学意义(χ2=0.801,P=0.670)。

表3 近期疗效与PTX TC>0.05 的关系[n(%)]
上述45 例患者中21 例为头颈部肿瘤,共行PTX 血药浓度监测28 例次,如表4 所示。疾病进展组与疾病获益组TC>0.05差异无统计学意义(Z=0.192,P=0.208)。TC>0.05不同范围组之间获益率差异无统计学意义(P=0.246)。

表4 头颈部肿瘤近期疗效与PTX TC>0.05 的关系[n(%)]
2.5 PTX 药代动力学参数TC>0.05 影响因素分析
本次横断面调查分析了患者年龄、KPS 评分和PTX 剂型对患者PTX 化疗后TC>0.05值的影响,结果如表5 所示。年龄≥65 岁者与年龄<65 岁者TC>0.05差异有统计学意义(Z=-3.701,P=0.001),且两组TC>0.05>31 h 占比差异有统计学意义(χ2=13.024,P=0.001)。KPS 70~80 分与KPS 90~100 分组之间TC>0.05差异无统计学意义。PTX 脂质体组和PTX 注射液组TC>0.05差异有统计学意义(Z=-3.717,P=0.001),且两组TC>0.05>31 h 占比差异有统计学意义(χ2=19.087,P <0.001)。
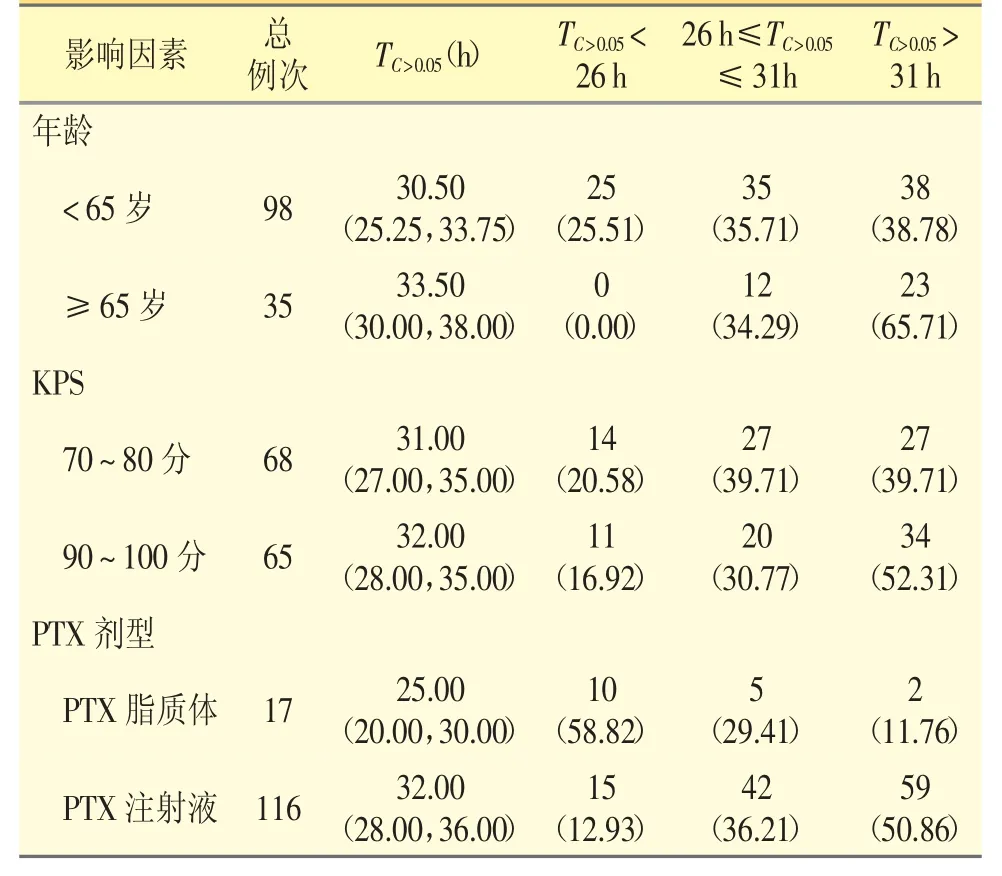
表5 PTX 的TC>0.05 影响因素分析[n(%)]
3 讨论
3.1 紫杉醇药代动力学参数TC>0.05 的临床应用
随着PTX 在临床广泛应用,尤其是短时间输注方案的推广,PTX 的非线性药代动力学特征日趋明显,TC>0.05被应用于PTX 化疗毒性和治疗分析。本研究直接采用MyPaclitaxelTM试剂盒测定患者PTX 血药浓度,采用MyCare 药物暴露计算器计算PTX 药代动力学参数TC>0.05。
3.2 紫杉醇药代动力学参数TC>0.05 与血液毒性和疗效关系
血液学毒性是PTX 剂量限制性毒性,严重的血液学毒性患者存在发热性中性粒细胞减少症的风险,可造成严重的感染并发症和大量的医疗资源占用[5]。进展期非小细胞肺癌患者接受PTX 3 周方案化疗时,严重嗜中性粒细胞减少症发生率为13%~39%,嗜中性粒细胞减少症伴发热发生率为1%~3%[6]。本研究显示PTX 化疗后血液学毒性发生率为67.2%,其中Ⅲ~Ⅳ级血液学毒性发生率为17.6%,表明PTX 治疗过程中患者发生血液学毒性的风险高。虽然发生0 级、Ⅰ~Ⅱ级和Ⅲ~Ⅳ级血液学毒性患者间TC>0.05值差异无显著性,但这可能与血液学指标监测时机有关。PTX 化疗后骨髓抑制通常在药物使用后4~12 d 出现,骨髓抑制指标的最低值时间仍然未知。本次研究中化疗后血液检查时间范围是1~11 d,检测时间中位数是4 d。化疗后血液检查时间的不一致性,对PTX TC>0.05与血液毒性关系的分析也存在一定影响。
既往基于TC>0.05的个体化给药研究表明TC>0.05与PTX 化疗疗效相关[7]。然而,本研究通过比较TC>0.05不同范围组之间临床获益率,未发现显著性差异(14.03% vs 36.84% vs 49.12%,P >0.05)。对头颈部肿瘤进行亚组分析,也未发现TC>0.05与PTX 化疗疗效相关。同样一项以PTX 敏感的晚期鼻咽癌(n=93)和非小细胞肺癌(n=40)患者为独立研究对象,化疗方案采用PTX 联合卡铂(AUC=5)的前瞻性Ⅱ期临床试验研究,也未发现TC>0.05与晚期鼻咽癌和非小细胞肺癌疗效显著相关[8]。
根据国内外研究,笔者认为不同研究者采用不同TC>0.05的折点从而导致TC>0.05与PTX 治疗效果和血液毒性研究结果不一致。张琰等研究表明将TC>0.05控制在35 h 以下,可减少接受PTX 为基础的3 周化疗方案的实体瘤患者血液毒性发生率[9]。在晚期鼻咽癌患者和NSCLC 患者中,XUE J 等发现TC>0.05>39h 时,Ⅲ~Ⅳ级血液毒性发生率明显增加[8]。综上,TC>0.05的靶目标值设置为26~31 h 在PTX 常规化血药浓度监测临床应用中适用性较差,学者需要根据本区域医疗中心PTX 血药浓度临床应用研究结果确定靶值。
3.3 紫杉醇药代动力学参数TC>0.05 影响因素
随着PTX 治疗药物监测研究的进展,人们发现PTX 药代动力学个体间异质性很大。前期研究发现血清白蛋白水平的生理病理因素的变化与PTX 药代动力学异质性相关[10]。本研究结果表明在接受PTX 化疗后,患者年龄和PTX 剂型对PTX 的TC>0.05值存在一定影响。老年患者TC>0.05值大于非老年患者,这可能与老年患者体液成分改变、身体脏器功能下降、细胞自我修复功能下降有关[11]。值得注意的是,虽然在临床应用中PTX 注射液和脂质体剂型用药剂量均为135~175 mg·m-2q3 w,但应用PTX 注射液剂型患者PTX 的TC>0.05值明显高于应用PTX脂质体剂型患者,说明PTX 制剂剂型的优化导致药物的分布、代谢发生改变,提示临床用药过程中要注意不同剂型间血药浓度差异以保证用药安全。
目前,PTX 个体化给药技术除了血药浓度监测外,基因检测和酶探针也日渐受到关注。药物基因学的研究表明[12],基因多态性对某些肿瘤患者PTX体内代谢存在一定的影响,但不是其异质性的主要因素。近年来药物代谢组学在预测和解释PTX 治疗结果中研究也取得一定进展[13]。未来基于PTX 的血药浓度监测的研究和临床实践可进一步结合基因组学、代谢组学等手段,指导PTX 个体化临床应用。
本次研究结果表明,将TC>0.05靶目标值设为26~31 h 时,未观察到临床获益率或血液毒性发生率与TC>0.05具有相关性。这可能与PTX 药代动力学在个体间异质性、TC>0.05折点设定有关,所以PTX 血药浓度监测常规化临床应用尚需更多实践研究确定合适的靶目标值。值得注意的是,在PTX 临床应用中要重点关注老年患者、不同PTX 制剂使用患者血药浓度监测结果,保障PTX 安全用药。此次调查研究样本量偏少,无法对混杂因素进行进一步分层分析,因而存在局限性,但仍具有一定的临床启示作用。希望进一步扩大样本量或覆盖不同的医疗区域中心,以获得能够常规化开展血药浓度监测检测的中国人群的PTX 血药浓度监测靶目标值。

