槐耳多糖抑制AEG-1表达对子宫内膜癌细胞生物学行为的影响
张泽敏,庞岚
(1.邯郸市第一医院产科;2.邯郸市妇幼保健院妇科,河北 邯郸 056000)
子宫内膜癌 (endometrial cancer ,EC)是全球女性中第4常见的妇科肿瘤[1],发病率呈逐渐上升趋势,且趋于年轻化[2]。手术、激素治疗、放化疗和新型靶向治疗等是目前治疗EC的主要方法,但EC患者的5年生存率并没有显著提高[3]。因此,全面了解EC发病机制,寻找更有效的EC治疗方法势在必行。槐耳多糖(Huaier polysaccharide,HP)是从Trametes robiniophila Murr中提取的一种活性成分,其可抑制乳腺癌恶性进展[4];且HP可促进胃癌细胞凋亡并抑制增殖[5]。而关于HP对EC细胞生物学行为的影响尚不清楚。星形胶质细胞升高基因1(Astrocyte elevated gene-1,AEG-1)是一种致癌基因,其在EC组织中表达量异常升高,且与癌细胞的侵袭、转移密切相关[6];相关报道[7]称HP通过失活AEG-1通路抑制肝癌细胞转移。而目前HP能否通过抑制AEG-1影响EC细胞生物学行为尚不明确。因此,本研究拟观察HP对EC细胞增殖、迁移、侵袭、凋亡的影响及其可能的分子机制。
1 材料与方法
1.1 细胞及动物
人子宫内膜癌ishikawa细胞购自上海慧颖生物公司。35只4~6周龄、体重为15~22 g的雌性BALB/c裸鼠购自导科医药技术(广东)有限公司(SCXK(粤)2022-0060)。温度(22±2 °C)、湿度约60%、光照(12 h光照,12 h黑暗),将BALB/c 裸鼠饲养在独立的标准清洁笼中,在整个实验过程中可随意饮食和摄水。
1.2 主要试剂
槐耳多糖粗提物购自启东盖天力药业有限公司,将槐耳多糖粗提物用二乙基氨基乙基纤维素-52层析柱析出,再用蒸馏水洗涤,0.1~0.3 mol/L氯化钠洗脱。HP的纯度通过以葡萄糖为标准的苯酚-硫酸法进行评估,HP用PBS稀释以制备50 mg/mL的储备溶液并储存在-20 °C;AEG-1小干扰RNA(si-AEG-1)及其阴性对照(si-NC)、AEG-1过表达物(pcDNA-AEG-1)及其阴性对照(pcDNA)均购自广州基迪奥生物公司;CCK-8试剂盒购自上海科艾博生物公司;Annexin V-FITC/PI细胞凋亡试剂盒购自杭州联科美讯生物公司;兔源一抗AEG-1、细胞周期蛋白D1(CyclinD1)、Bcl-2相关X蛋白(Bcl-2-Associated X Protein,Bax)、半胱氨酸蛋白酶3(Caspase-3)、基质金属蛋白酶(matrix matalloproteinases ,MMP)-2、MMP-9、GAPDH及羊抗兔IgG二抗均购自英国Abcam公司。
1.3 HP作用浓度的确定
将ishikawa细胞悬液均匀铺入96孔板中,待细胞生长至80%汇合度时,分别加入0、1、3、5、7、9、11 μg/mL HP处理ishikawa细胞24 h,继续加入10 μL CCK-8试剂在37 ℃下孵育2 h,酶标仪测量细胞在450 nm下OD值。细胞活力=(OD实验孔-OD空白孔)/(OD对照孔-OD空白孔)。
1.4 细胞培养与分组
将ishikawa细胞在37 °C、5% CO2条件下,于DMEM培养基(10%胎牛血清)中培养。取对数生长期的ishikawa细胞,分为Ct组(正常培养的ishikawa细胞)、HP-L组[8](1μg/mL HP处理细胞48 h)、HP-H组[8](5 μg/mL HP处理细胞48 h)、si-NC组(细胞转染si-NC 48 h)、si-AEG-1组(细胞转染si-AEG-1 48 h),根据前期预实验结果,5 μg/mL HP对ishikawa细胞生物学行为的影响显著优于1 μg/mL HP,故后续选择5 μg/mL HP与pcDNA-AEG-1共同处理ishikawa细胞以探究HP与AEG-1对ishikawa细胞生物学行为的影响,故在上述分组的基础上再进行以下分组:HP-H+pcDNA组(细胞转染pcDNA 48h后再用5 μg/mL HP处理48 h)、HP-H+pcDNA-AEG-1组(细胞转染pcDNA-AEG-1 48 h后再用5 μg/mL HP处理48 h)。收集各组细胞用于后续实验。
1.5 CCK-8法检测ishikawa细胞增殖
将各组ishikawa细胞以5×104个/孔的密度96孔板中,孵育48 h后,各加入CCK-8试剂10 μL,再37 ℃下孵育2 h。利用酶标仪上测量各组细胞在450 nm下的光密度(OD) 值。
1.6 EdU染色检测ishikawa细胞增殖
ishikawa细胞在含10%胎牛血清的DMEM培养基重悬,与10 μM EdU一起培养2 h,再按照1.3中的方法处理细胞。胰蛋白酶消化后,经离心、洗涤、固定、透化和1×Apollo反应混合物孵育后,用DAPI对DNA进行染色。通过流式细胞仪检测细胞增殖,并通过EdU阳性细胞的百分比估计增殖能力。
1.7 流式细胞术检测ishikawa细胞凋亡
各组ishikawa细胞采用PBS缓冲液洗涤后,于结合缓冲液重悬,加入Annexin V-FITC和碘化丙啶各5 μL,在4 ℃下避光孵育30 min,接着在500 μL结合缓冲液中重悬,最后通过流式细胞仪分析细胞凋亡情况,细胞凋亡率=(凋亡细胞数目/总细胞数目)× 100%。
1.8 划痕愈合实验检测ishikawa细胞迁移
ishikawa细胞按1.3的方法处理后接种在6孔板中,达到100%汇合度后,用200 μL移液枪枪头在各孔底部制造划痕。然后将细胞与无血清培养基一起孵育48 h。利用光学显微镜观察迁移情况,划痕愈合率(%)=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%。
1.9 Transwell测定ishikawa细胞侵袭
用无血清培养基稀释的基质胶平铺在Transwell上室,上室在室温下风干备用。将无血清培养基稀释的细胞悬液(2×105个/ 200 μL)添加到Transwell上室。将含有10%胎牛血清的培养基600 μL加入到下室。将小室在37 °C下孵育48 h后,取出小室后,用磷酸盐缓冲溶液洗涤两次。用棉签去除残留细胞,95%酒精固定后进行结晶紫染色。用光学显微镜观察细胞侵袭情况。
1.10 Western blot检测ishikawa细胞中相关蛋白表达水平
RIPA裂解缓冲液用于裂解ishikawa细胞。将细胞裂解物在冰上孵育15min后,以12 000 r/min的转速离心20 min。蛋白质浓度采用二辛可宁酸试剂盒测定。取30 μg蛋白质样品进行SDS-PAGE,转至聚偏二氟乙烯膜。用5%脱脂牛奶在室温下封闭膜1 h,然后与一抗AEG-1(1∶1 000)、CyclinD1(1∶2 000)、Bax(1∶1 000)、Caspase-3(1∶1 000)、MMP-2(1∶2 000)、MMP-9(1∶1 000)、GAPDH(1∶2 000)在4 ℃下孵育过夜。将膜彻底清洗后,将其与辣根过氧化物酶(HRP)缀合的山羊抗兔抗体在室温下孵育1 h。用ECL试剂观察蛋白质印迹,Image J软件分析蛋白表达。
1.11 裸鼠体内肿瘤生长实验
将ishikawa细胞悬液以1×107个/200 μL通过皮下注射到裸鼠左侧腋窝,当肿瘤直径约为10 mm 时,将小鼠随机分为7组:裸鼠Ct组(灌胃生理盐水且还需皮下注射生理盐水)、裸鼠HP-L组[8](灌胃25 μg/g HP且还需皮下注射生理盐水)、裸鼠HP-H组[8](灌胃100 μg/g HP且还需皮下注射生理盐水)、裸鼠si-NC组(皮下注射转染si-NC的ishikawa细胞且还需灌胃生理盐水)、裸鼠si-AEG-1组(皮下注射转染si-AEG-1的ishikawa细胞且还需灌胃生理盐水)、裸鼠HP-H+pcDNA组(皮下注射转染pcDNA的ishikawa细胞且灌胃100 μg/g HP)、裸鼠HP-H+pcDNA-AEG-1组(皮下注射转染pcDNA-AEG-1的ishikawa细胞且灌胃100 μg/g HP),每组各5只。给药1次/d,连续28 d后,用2%戊巴比妥钠处死小鼠,取出移植的肿瘤,称量肿瘤质量。
1.12 统计学分析
2 结果
2.1 不同浓度HP对ishikawa细胞活力的影响
与浓度0 μg/mL HP比较,1 μg/mL HP、3 μg/mL HP、5 μg/mL HP处理的ishikawa细胞活力升高,7 μg/mL HP、9 μg/mL HP、11 μg/mL HP处理的ishikawa细胞活力降低,因此选取1 μg/mL HP、5 μg/mL HP分别作为后续处理ishikawa细胞的低、高剂量浓度。见表1。
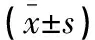
表1 不同浓度HP对ishikawa细胞活力的影响
2.2 HP对ishikawa细胞增殖能力的影响
与Ct组比较,HP-L组、HP-H组ishikawa细胞OD450值、EdU阳性率均降低(P<0.05);与Ct组、si-NC组比较,si-AEG-1组ishikawa细胞OD450值、EdU阳性率均降低(P<0.05);与HP-H组、HP-H+pcDNA组比较,HP-H+pcDNA-AEG-1组ishikawa细胞OD450值、EdU阳性率均升高(P<0.05)。见图1及表2。
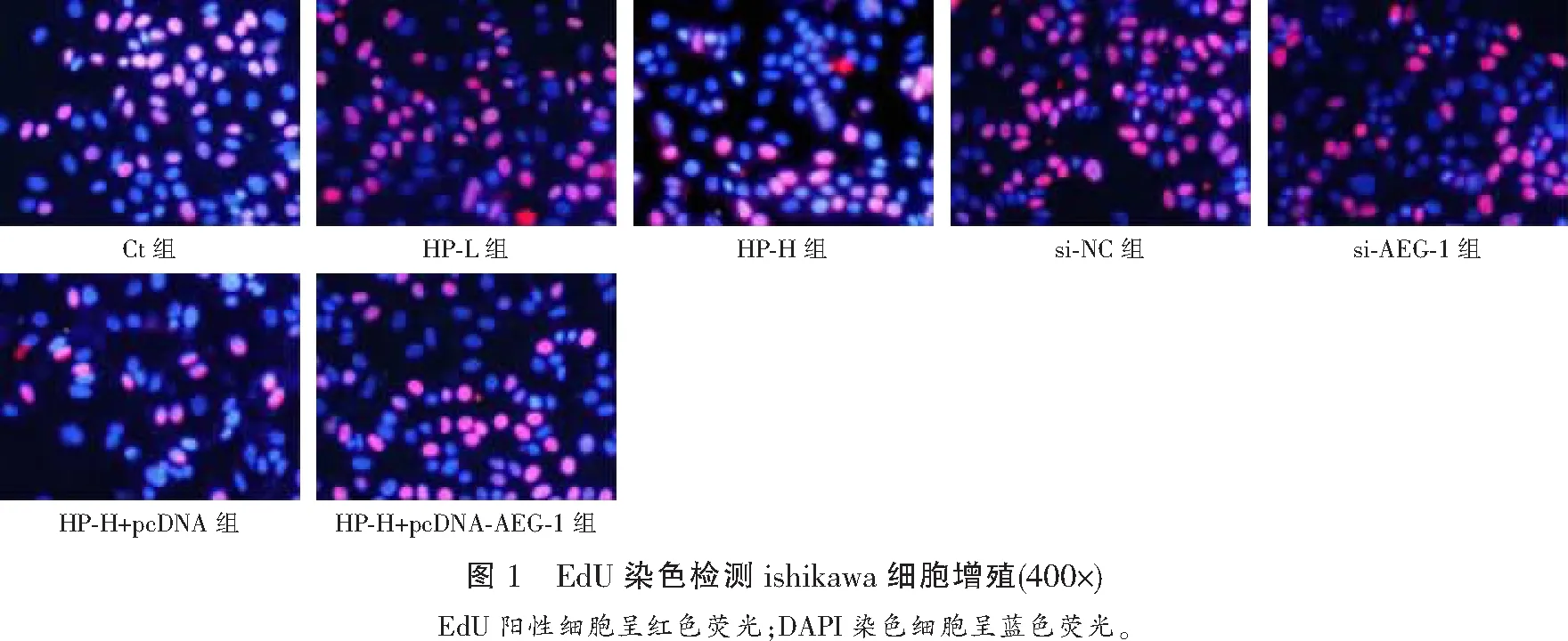
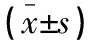
表2 各组ishikawa细胞OD450值及EdU阳性率比较
2.3 HP对ishikawa细胞凋亡能力的影响
与Ct组比较,HP-L组、HP-H组ishikawa细胞凋亡率升高(P<0.05);与Ct组、si-NC组比较,si-AEG-1组ishikawa细胞凋亡率升高(P<0.05);与HP-H组、HP-H+pcDNA组比较,HP-H+pcDNA-AEG-1组ishikawa细胞凋亡率降低(P<0.05)。见图2及表3。
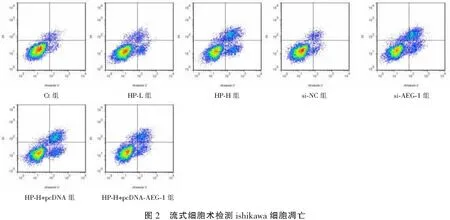
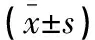
表3 各组ishikawa细胞凋亡率比较
2.4 HP对ishikawa细胞迁移能力的影响
与Ct组比较,HP-L组、HP-H组ishikawa细胞划痕愈合率降低(P<0.05);与Ct组、si-NC组比较,si-AEG-1组ishikawa细胞划痕愈合率降低(P<0.05);与HP-H组、HP-H+pcDNA组比较,HP-H+pcDNA-AEG-1组ishikawa细胞划痕愈合率升高(P<0.05)。见图3及表4。

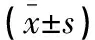
表4 各组ishikawa细胞划痕愈合率比较
2.5 HP对ishikawa细胞侵袭能力的影响
与Ct组比较,HP-L组、HP-H组侵袭细胞数降低(P<0.05);与Ct组、si-NC组比较,si-AEG-1组侵袭细胞数降低(P<0.05);与HP-H组、HP-H+pcDNA组比较,HP-H+pcDNA-AEG-1组侵袭细胞数升高(P<0.05)。见图4及表5。
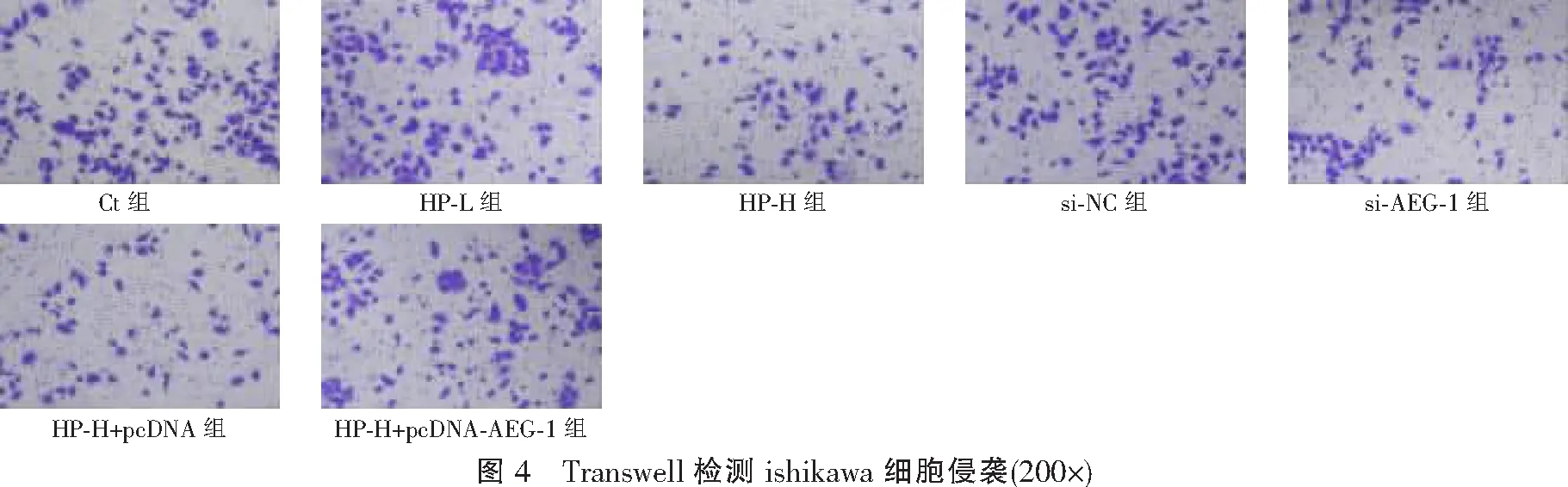
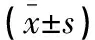
表5 各组ishikawa细胞侵袭细胞数比较
2.6 HP对ishikawa细胞中相关蛋白表达的影响
与Ct组比较,HP-L组、HP-H组ishikawa细胞中AEG-1、CyclinD1、MMP-2、MMP-9蛋白表达降低,Bax、Caspase-3蛋白表达升高(P<0.05);与Ct组、si-NC组比较,si-AEG-1组ishikawa细胞中AEG-1、CyclinD1、MMP-2、MMP-9蛋白表达降低,Bax、Caspase-3蛋白表达升高(P<0.05);与HP-H组、HP-H+pcDNA组比较,HP-H+pcDNA-AEG-1组ishikawa细胞中AEG-1、CyclinD1、MMP-2、MMP-9蛋白表达升高,Bax、Caspase-3蛋白表达降低(P<0.05)。见图5和表6。
表6 各组ishikawa细胞中相关蛋白表达水平比较
2.7 HP对裸鼠体内肿瘤生长的影响
与裸鼠Ct组比较,裸鼠HP-L组、裸鼠HP-H组裸鼠体内肿瘤质量降低(P<0.05);与裸鼠Ct组、裸鼠si-NC组比较,裸鼠si-AEG-1组裸鼠体内肿瘤质量降低(P<0.05);与裸鼠HP-H组、裸鼠HP-H+pcDNA组比较,裸鼠HP-H+pcDNA-AEG-1组裸鼠体内肿瘤质量升高(P<0.05)。见图6及表7。
表7 各组裸鼠体内肿瘤质量比较
3 讨论
EC是一种以子宫内膜细胞无节制或异常生长为特征的疾病[9]。相关研究[10]表明,2018年全球报告了大约38万例新病例和8万例EC相关死亡病例,且EC的发病率不断增加,预后较差。因此,迫切需要寻找有效的EC治疗策略。
HP作为Trametes robiniophila Murr的提取物,其具有抗肿瘤潜力和免疫调节作用[11]。已有研究报道,HP可抑制乳腺癌进展[12];HP可诱导透明细胞肾细胞癌细胞凋亡,阻碍增殖、迁移、侵袭[13]。以上研究表明HP可抑制肿瘤的进展。本研究显示,HP可抑制ishikawa细胞增殖、肿瘤生长、迁移与侵袭,诱导凋亡,且HP的剂量越高,对应的趋势越明显,表明HP在EC中发挥抑癌作用。CyclinD1是衡量细胞增殖的常用指标,其表达量越高表明细胞增殖能力越强[14];Bax、Caspase-3是细胞凋亡相关蛋白,增加Bax、Caspase-3水平可促进细胞凋亡[15];基质金属蛋白酶可促进细胞迁移和侵袭,作为基质金属蛋白酶家族的成员,MMP-2和MMP-9在肿瘤中均具有高度活性,同时也能促进细胞迁移和侵袭[16]。本研究显示,低、高剂量HP均可抑制ishikawa细胞中CyclinD1、MMP-2、MMP-9蛋白表达,促进Bax、Caspase-3蛋白表达,证实了HP具有抑制ishikawa细胞增殖、迁移与侵袭,诱导细胞凋亡的作用。
AEG-1是促进肿瘤发展的关键因素,其可通过促进细胞增殖与转移、提高抗凋亡能力,进而加速肿瘤的进展[17]。据报道,AEG-1在肝癌细胞中高表达,并促进了肝癌细胞的转移[18];沉默AEG-1抑制了非小细胞肺癌细胞增殖、迁移、侵袭[19];EC组织中AEG-1表达增高,并可促进肿瘤组织的淋巴结转移[20]。以上研究表明AEG-1在多种肿瘤中具有促癌的作用。本研究显示,AEG-1蛋白在ishikawa细胞中高表达,沉默AEG-1可抑制ishikawa细胞增殖、肿瘤生长、侵袭与迁移,诱导细胞凋亡,且低、高剂量HP均可抑制ishikawa细胞中AEG-1蛋白表达,推测HP可能通过下调AEG-1抑制ishikawa细胞生长、侵袭与迁移,诱导凋亡。为了验证该推测,本研究在高剂量HP作用的基础上再加上pcDNA-AEG-1干预ishikawa细胞或注射ishikawa细胞的裸鼠。结果显示,pcDNA-AEG-1减弱了高剂量HP对ishikawa细胞增殖、迁移与侵袭的抑制作用、细胞凋亡的促进作用及对裸鼠体内肿瘤生长的抑制作用。证实了HP可能通过下调AEG-1抑制ishikawa细胞增殖、肿瘤生长、侵袭与迁移,诱导凋亡。
综上,HP可能通过下调AEG-1抑制ishikawa细胞增殖、肿瘤生长、侵袭与迁移,诱导凋亡。其具体机制还待更深入的研究。

