坎地沙坦对肝癌小鼠新生血管生成的抑制作用
崔志华,蒋丽媛,井磊,王亚珍
(保定市第一医院肿瘤科,河北 保定 071000)
近年来肝癌发病率呈上升趋势,晚期肝癌患者失去了根治性切除的机会[1-3],只能保守治疗,部分患者即使行姑息性切除术,但5年生存率仅为10%左右[4],所以寻找肝癌有效的治疗方案可使广大晚期肝癌患者获益。血管紧张素Ⅱ (angiotensin Ⅱ,AngⅡ)是肾素-血管紧张素系统的重要效应介质,可通过其受体发挥作用[5-7]。血管紧张素转换酶抑制剂(ACEI)能够抑制肿瘤新生血管生成,证明Ang II可能具有血管生成等生物学效应[8]。本实验主要研究Ang II1型受体拮抗剂(AngiotensinⅡ type 1 recepeor,AT1 ) 坎地沙坦对肝癌小鼠新生血管生成的抑制作用。
1 材料与方法
1.1 实验动物、H22肝癌细胞株及试剂
肝癌H22细胞株(河北医科大学实验动物中心)。雄性BALB/C小鼠(清洁级Ⅱ)鼠(第二军医大学实验动物中心)。主要试剂:Ang II1型受体拮抗剂(AT1)坎地沙坦西酯片(日本武田药品工业株式会社);兔抗小鼠血管内皮生长因子(VEGF)多克隆抗体(美国Santa Cruz生物技术公司);EnVision免疫组化试剂盒(美国Dako公司);氟尿嘧啶注射液(上海旭东海普药业有限公司)。
1.2 建模及分组
1.2.1 肿瘤细胞悬液的制备及细胞活力计数检测 将保种7 d的种鼠脱颈处死,抽取腹水至无菌离心管内,800 r/min离心3 min,按1∶5加生理盐水稀释混匀,制成肿瘤细胞悬液。取0.5 mL肿瘤细胞悬液于无菌管中,加入0.4% 0.5mL台盼兰染色钟,光学显微镜下观察活细胞数(活细胞不被台盼兰染色,呈无色透明状)。计算细胞活力>90%(细胞活力=活细胞数/总细胞数×100%)。同时检测细胞计数,并根据细胞计数调整肿瘤细胞悬液浓度至5×106个/mL。
1.2.2 造模及分组 110只BALB/C小鼠均适应性饲养1周,注入约1×106个肿瘤细胞的细胞悬液完成建模。选择建模成功的BALB/C小鼠100只,采用数字表随机法分为空白对照组(NEC组)、低剂量坎地沙坦组(LCA组)、中剂量坎地沙坦组(MCA组)、高剂量坎地沙坦组(HCA组)、氟尿嘧啶组(5-FU组) ,每组各20只。
1.3 方法
各组小鼠均常规相同的饲养,环境温度调节在(20±2)℃,实验过程中不控制饲料摄入量,不限制饲料成分。各组小组均在建模后24 h开始治疗。NEC组:0.9%生理盐水0.6 mL灌胃,1次/d,连续8 d。LCA组、MCA组、HCA组各50 mg/kg、100 mg/kg、200 mg/kg坎地沙坦灌胃,1次/d,连续8 d。5-FU:5-FU 25 mg/kg,腹腔注射,1次/d,连续6 d后常规喂养。
1.4 观察指标
(1)体重及肿瘤生长情况:建模前、治疗第2、4、6、8天给药前先给小鼠秤重,观察体重变化,记录各小鼠建模至可见肿瘤时间。(2)治疗后第9 天,每组小鼠各随机选取10只脱颈处死,拔取完整肿瘤组织,用游标卡尺测量肿瘤最长径和垂直径,计算肿瘤体积并称重,计算抑瘤率[抑瘤率=(NEC组瘤重-各实验组瘤重)/NEC组瘤重×100%]。将肿瘤体积等分切开,一份用4%戊二醛固定用透射电镜观察细胞凋亡;另一份用10%福尔马林固定,行HE染色作组织病理学检查,观察肿瘤组织Ang II1型受体阳性率,计算抑瘤率;应用免疫组化法标记VEGF;应用EnVision免疫组化二步法检测肿瘤组织微血管密度。(3)各组剩余的10只小鼠停药后不处死,继续饲养,记录存活时间。
1.5 结果判定
VEGF阳性判定标准:以棕黄色染色的细胞浆或细胞膜为阳性,根据阳性细胞占比与强度计分,无阳性细胞和无染色计0分;阳性细胞占1%~25%,染色强度弱计1分;阳性细胞占26%~50%,染色强度中计2分;阳性细胞占51%~75%,染色强度强计3分;阳性细胞占76%~100%,计4 分。VEGF阳性分值=阳性细胞占比评分+染色强度评分。
微血管密度(MVD)判定:分别用低倍(100×)和高倍(400×)镜在肿瘤组织微血管最丰富区域选取3个视野,计数微血管数,取平均值。
1.6 统计学分析
2 结果
2.1 各组小鼠体重情况
各组小鼠建模前体重比较,差异无统计学意义(P>0.05)。治疗后4 d、6 d、8 d ,5-FU组小鼠体重低于建模前,其余4组均高于建模前(P<0.05)。组间两两比较:治疗后4 d、6 d、8 d,5-FU组体重均低于其余4组;治疗后8 d, MCA组、HCA组小鼠体重低于NEC组、LCA组(P<0.05)。见表1。

表1 各组小鼠建模前后体重比较
2.2 各组治疗9 d后瘤体重量和抑瘤率比较
各组瘤体体积、瘤体质量组间两两比较:NEC组>LCA组>MCA组>HCA组、5-FU组(P<0.05);抑瘤率组间两两比较:LCA组

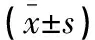
表2 各组小鼠治疗9 d后瘤体重量和抑瘤率比较
2.3 透射电镜结果
JEOL-1200EX透射电镜(放大倍速数50万倍)观察显示,NEC组小鼠肿瘤组织细胞核大深染,细胞结构不完整,形态不规则,核质比例增大,胞质内可见许多空泡,未见细胞凋亡征象;LCA、MCA、HCA、5-FU组小鼠肿瘤组织均可见不同阶段的凋亡细胞;各组凋亡细胞数量由高到低排序为:HCA组、MCA组、LCA组和5-FU组。LCA组肿瘤细胞核染色质浓缩,表面有微绒毛,胞膜完整,部分线粒体可见嵴和膜的融合、消失;MCA组肿瘤组织细胞核染色质聚集,胞膜较完整,线粒体呈空泡状,髓样化;HCA组核染色质高度浓缩,胞膜部分完整,线粒体髓样化,呈囊泡状或空泡状,嵴杂乱无章,膜包裹内可见胞核碎片凋亡小体。5-FU组肿瘤细胞排列较规则,粗面内质网扩张,细胞器较少,胞质较多,胶原纤维增生明显,核周隙宽。见图2。

2.4 肿瘤进展及生存情况比较
各组小鼠建模至可见肿瘤时间、平均存活时间比较,差异有统计学意义(P<0.05)。建模至可见肿瘤时间组间两两比较:LCA、MCA、HCA、5-FU组均长于NEC组,差异有统计学意义(P<0.05)。平均存活时间组间两两比较:HCA组>MCA组、5-FU组>LCA组>NEC组(P<0.05)。见表3。
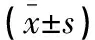
表3 各组小鼠建模至可见肿瘤时间和平均存活时间比较
3 讨论
肿瘤形成初期主要靠弥散,当体积≥2 mm3时,其所需的营养物质和氧气等就必须依靠血管供应,一旦肿瘤新生血管生成受到抑制,癌细胞所需的营养供应减少或阻断,会导致癌细胞凋亡、坏死,继而出现肿瘤退化、萎缩[9-11]。因此,抑制肿瘤新生血管的生成是治疗恶性肿瘤的新靶点,也是肿瘤靶向治疗的新途径。目前有研究在乳腺癌、结直肠癌、胰腺癌等恶性肿瘤组织中呈高表达,且AngⅡ受体主要是AT1[12-14]。新生血管生成是公认的实体肿瘤预后评估的有价值的因素,同样也可用于肝癌预后的评估。肿瘤诱导新生血管生成的过程十分复杂,多种细胞因子起着重要的作用,其中VEGF是介导血管生成最重要的细胞因子。本实验结果显示,各组VEGF阳性评分差异均有统计学意义(P<0.05)。VEGF阳性评分组间比较:NEC组、5-FU组>LCA、MCA组>HCA组(P<0.05)。而5-FU组小鼠肿瘤组织VEGF阳性评分与NEC组比较,差异无统计学意义(P>0.05)。说明AT1可抑制小鼠肿瘤组织VEGF表达,且存在剂量依赖性,剂量越大,对肿瘤组织VEGF表达的抑制作用越强。而5-FU对小鼠肿瘤组织VEGF表达无明显的抑制作用。
MVD是评价血管生成状况的可靠指标,可反映血管生成程度。本实验结果显示MVD组间比较:NEC组、5-FU组>LCA>MCA组>HCA组(P<0.05)。提示AT1可能显著抑制肝癌小鼠新生血管的生成,降低肿瘤组织的微血管密度,且呈剂量依赖性。临床常用的化疗药物5-FU抑制新生血管生成的作用并不明显。本实验结果显示,各组瘤体体积、瘤体重量组间两两比较:NEC组>LCA组>MCA组>HCA组、5-FU组(P<0.05)。抑瘤率组间两两比较:LCA组 延长肝癌的生存期,提高生活质量也是肝癌治疗的主要目的。本试验结果显示,小鼠模型建立后在肿瘤生长期间,NEC、LCA、MCA、HCA组小鼠体重持续增加,但增加幅度随着药物剂量的增加呈下降趋势。只有5-FU组小鼠体重持续减轻,通过观察发现,5-FU组小鼠治疗期间所有小鼠均出现了不同程度的腹泻,药物的副反应影响了该组小鼠的食欲,这就是5-FU组小鼠体重不增反降的可能原因。而观察NEC、LCA、MCA、HCA各组小鼠,建模后进食量较之前无明显变化,未发现腹泻及其它副反应,小鼠体重因剂量增加而减轻可能与肿瘤重量有关。本实验结果显示,各组平均存活时间比较差异有统计学意义(P<0.05)。各组平均存活时间组间比较,HCA组>MCA组、5-FU组>LCA组>NEC组(P<0.05)。说明AT1能显著延长肝癌小鼠的生存时间,且随着AT1剂量的增大,小鼠生存时间明显增加,呈剂量依赖性。透射电镜观察显示,NEC组小鼠肿瘤组织未见细胞凋亡征象;LCA、MCA、HCA、5-FU组小鼠肿瘤组织均可见不同阶段的凋亡细胞;各组凋亡细胞数量由高到低排序为:HCA组、MCA组、LCA组和5-FU组。 综上,AT1可抑制肝癌小鼠移植瘤的生长和新生血管生成,延长小鼠生存时间,其抑郁作用存在量效依赖性。提示AT1有可望成为肝癌治疗的安全有效药物。本实验初步探讨了AT1在体内对肝癌的抑制作用及机制,为肝癌分子发病机制的深入研究提供理论基础,为肝癌治疗模式的改进提供新途径,但AT1的抗肝癌机制有待进一步研究。

