磷酸酶及张力蛋白同源物、AT丰富结合域1A基因及昼夜运动输出周期在子宫内膜异位症相关卵巢癌组织中的表达及诊断价值
高秀娟, 张雅丽, 庄新荣, 张桂香
(承德医学院附属医院 妇科, 河北 承德, 067000)
子宫内膜异位症(EMS)是指子宫外任何部位出现包括子宫内膜基质和上皮细胞的子宫内膜组织,属于雌激素依赖性慢性炎症性疾病,患者主要以痛经、慢性盆腔痛和不孕为主要表现[1]。EMS是一种良性疾病,但具有向恶性肿瘤转变的可能,并在生物学上表现出局部侵袭、转移和抵抗细胞凋亡,其中子宫内膜异位症相关卵巢癌(EAOC)是EMS最常见的恶性病变[2-3]。EMS恶变为EAOC的概率不足3.0%, 且占比不足卵巢癌的6.7%, 通常没有明显的临床症状,患者确诊时多已进入晚期,错过了手术治疗的最佳时机,5年生存率不足37%[4-5]。糖类抗原125(CA125)是临床辅助诊断卵巢癌的标志物,但CA125对于卵巢癌早期病变的诊断效能较低[5]。
研究[6]显示,尽管EAOC的发病机制仍不清楚,但许多因素可影响EAOC的发生,如基因突变、氧化应激、激素及炎症免疫等。磷酸酶及张力蛋白同源物(PTEN)是首个被发现的具有磷酸酶活性的抑癌基因,又称晚期肿瘤突变基因,在肿瘤细胞增殖、凋亡和迁移中发挥关键作用。作为染色质重塑复合物SWI/WNF家族的成员, AT丰富结合域1A基因(ARID1A)属于抑癌基因之一。作为生物钟基因,昼夜运动输出周期(CLOCK)是生物钟的核心基因,可节律性地共同结合到E-box上调节多种基因的转录,其中包括肿瘤基因c-MYC[7-9]。近年来,有学者[10]研究PTEN与ARID1A在胰腺癌中的表达,或ARID1A与CLOCK在胃癌中的表达[11], 胰腺癌、胃癌及EAOC同属于腺癌范畴,作者推测PTEN、ARID1A及CLOCK在EAOC的发生与进展中也扮演重要角色。本研究观察EAOC患者PTEN、ARID1A、CLOCK蛋白及基因在卵巢癌组织的表达,并与未发生EAOC的单纯EMS囊肿组织的相关指标进行比较,现将结果报告如下。
1 资料与方法
1.1 一般资料
回顾性收集2016年3月—2020年3月本院收治的30例EAOC患者的临床资料,并设为EAOC组,患者年龄27~42岁,平均(34.52±3.15)岁。另收集同期收治的30例未发生EAOC的单纯EMS患者的临床资料,并设为非EAOC组,患者年龄30~45岁,平均(37.25±3.23)岁。EAOC及EMS患者均行病变组织病理检查,且均经资深病理专家确诊。2组患者的一般资料比较,差异无统计学意义(P>0.05), 具有可比性,见表1。所有患者签署知情同意书。纳入标准: (1) 首次诊断的EAOC患者,符合《卵巢恶性肿瘤诊断与治疗指南(第4版)》[12]中EAOC的诊断标准,且经超声检查、实验室检查、病理组织学检查确诊。① 单个卵巢中同时存在癌组织和异位内膜; ② 二者组织学关系类似; ③ 排除转移性的恶性肿瘤; ④ 显微镜下具有异位子宫内膜向恶性组织转化的形态学(图1)。(2) 入院前半年内未服用激素类药物者。(3) 患者临床资料完整,从采样到PTEN、ARID1A及CLOCK检测时间≤3个月。排除标准: ① 合并宫颈癌、子宫内膜癌等其他恶性肿瘤患者; ② 合并肝炎、心肌炎或肾衰竭等疾病患者; ③ 合并凝血功能障碍患者; ④ 入组前已接受放化疗等干预手段的EAOC患者。
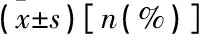
表1 2组患者基线资料比较
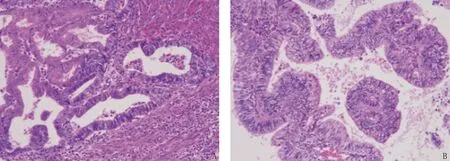
A: 非EAOC患者子宫内膜腺体与间质充盈,周围伴纤维结缔组织增生,可见炎症细胞浸润,红细胞或含铁血黄素的巨噬细胞散在分布; B: EAOC患者子宫内膜腺体细胞异型,呈腺体上皮特征,周围可见大量炎症细胞及巨噬细胞浸润。图1 非EAOC和EAOC组织的病理表现(放大100倍)
1.2 PTEN、ARID1A和CLOCK蛋白表达检测
取患者活检或手术切除的病变组织样本(EAOC组的癌组织、非EAOC组的囊肿组织),置入4%多聚甲醛中进行固定,制成石蜡切片,采用免疫组化法(试剂购自上海生工生物科技有限公司)检测PTEN、ARID1A和CLOCK蛋白的表达,将PTEN、ARID1A和CLOCK单克隆抗体作为一抗进行孵育,利用DBA显色试剂盒显色。结果判定: 按着色细胞占视野的百分比进行评分,阳性细胞率<5%为0分, 5%~<25%为1分, 25%~<50%为2分, 50%~75%为3分, >75%为4分; 按着色强度分级进行评分,不着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。PTEN蛋白相对表达=着色细胞占视野的百分比(着色强度,结果分为蛋白阴性表达(-)为≤2分,蛋白弱阳性(+)为3~4分,蛋白中度阳性()为5~8分,蛋白强阳性()为9~12分。
1.3 PTEN、ARID1A、CLOCK基因检测
将患者活检或手术切除的病变组织(EAOC组的癌组织、非EAOC组的囊肿组织)经液氮研磨,采用TRIzol试剂提取总RNA, 采用琼脂糖凝胶电泳检测RNA纯度与浓度,采用反转录试剂盒对总RNA进行逆转录,生成cDNA。检测PTEN、ARID1A、CLOCK基因的表达水平,以GAPDH为内参。所有反应均在基因扩增仪进行, PCR反应总体积20 μL: 10 μL 2×SYBR Gree Master Mix缓冲液,上游、下游引物各200 nmol/L, 1 μL cDNA模板; 扩增程序: 95 ℃预变性5 min, 95 ℃变性10 s, 60 ℃退火10 s, 72 ℃延伸10 s, 共45个循环。采用2-△△Ct法计算PTEN、ARID1A、CLOCK基因的相对表达。引物序列见表2。

表2 引物序列
1.4 质量控制
严格按照中华人民共和国国务院令第717号《中华人民共和国人类遗传资源管理条例》、《全国临床检验操作规程》相关规定执行; 严格按本院病理科制定的《人类正常及病变器官的制备、冻存、复苏和鉴定操作指南》及《妇科组织免疫组化操作规程及操作流程》进行操作检测。
1.5 统计学分析

2 结 果
2.1 非EAOC组与EAOC组病变组织PTEN、ARID1A和CLOCK蛋白阳性表达比较
与非EAOC组相比, EAOC组患者PTEN阳性比率、ARID1A阳性比率较低, CLOCK阳性比率较高,差异有统计学意义(χ2=15.864、15.864、13.125,P<0.01)。见表3、图2。

表3 非EAOC组与EAOC组病变组织PTEN、ARID1A和CLOCK蛋白阳性表达[n(%)]
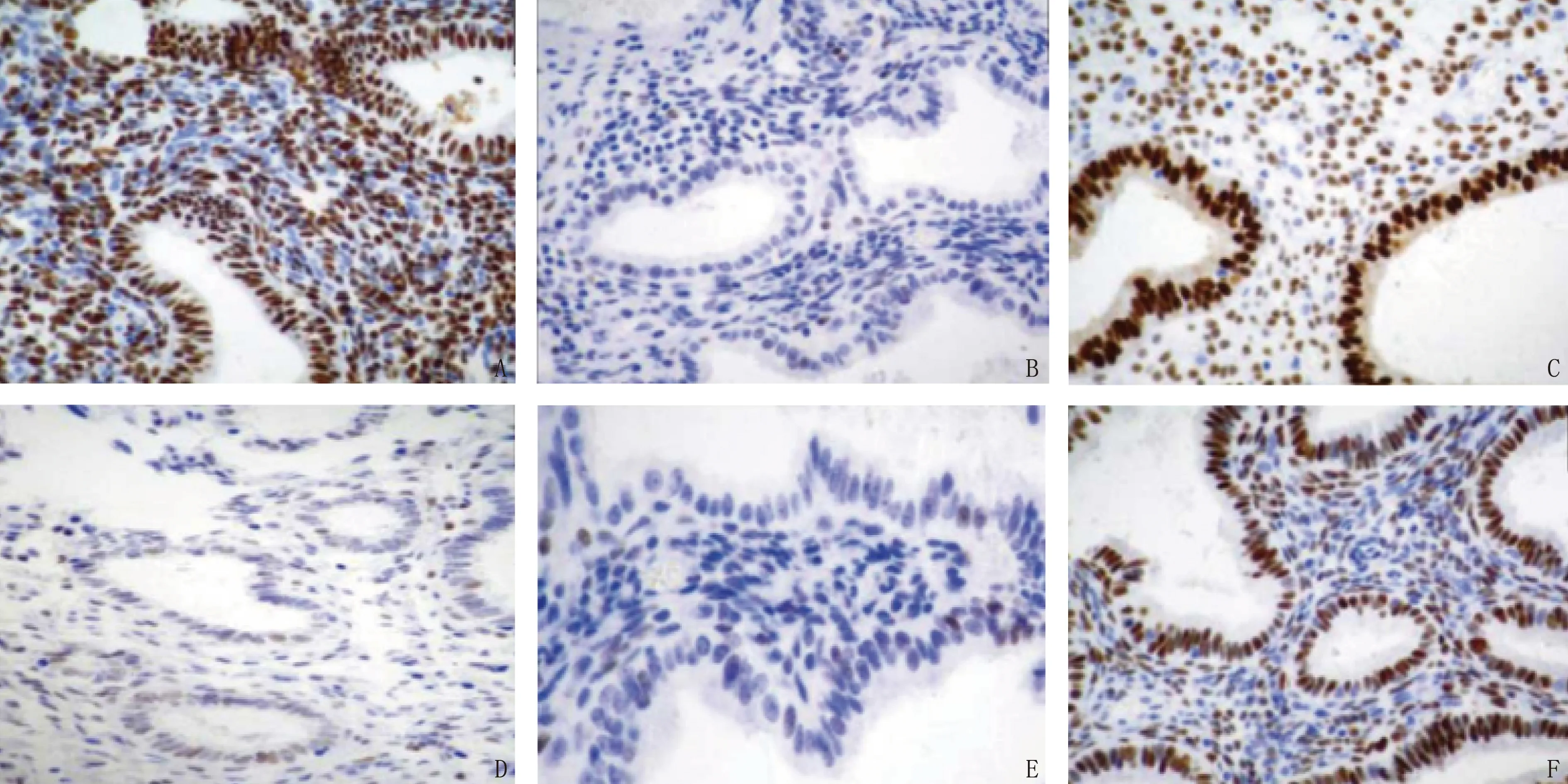
A: 非EAOC囊肿组织PTEN蛋白; B: EAOC卵巢癌组织PTEN蛋白; C: 非EAOC囊肿组织ARID1A蛋白; D: EAOC卵巢癌组织ARID1A蛋白; E: 非EAOC囊肿组织CLOCK蛋白; F: EAOC卵巢癌组织CLOCK蛋白。图2 非EAOC组与EAOC组病变组织PTEN、ARID1A、CLOCK蛋白染色图(放大100倍)
2.2 非EAOC组与EAOC组病变组织PTEN、ARID1A和CLOCK的基因表达
与非EAOC组相比, EAOC组患者PTEN、ARID1A相对表达量较低, CLOCK相对表达量较高,差异有统计学意义(t=18.868、7.391、9.578,P<0.01)。见表4、见图3。

表4 非EAOC组与EAOC组病变组织PTEN、ARID1A和CLOCK的基因表达
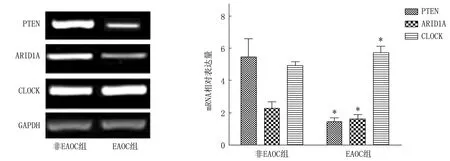
与非EAOC组比较, ∗P<0.05。图3 非EAOC和EAOC病变组织ARID1A和CLOCK基因表达
2.3 病变组织的PTEN、ARID1A及CLOCK基因与EAOC发生的回归分析
将病变组织的PTEN、ARID1A及CLOCK纳入作为自变量(均为连续变量),将EAOC发生情况作为因变量(1=发生, 0=未发生),经Logistic回归分析显示,病变组织PTEN、ARID1A及CLOCK异常表达可能与EAOC发生有关, PTEN和ARID1A是EAOC发生的保护因子, CLOCK是促进EAOC发生的风险因子(OR>1,P<0.05)。见表5。

表5 PTEN、ARID1A及CLOCK与EAOC发生的回归分析
2.4 病变组织PTEN、ARID1A及CLOCK基因单独及联合预测EAOC发生的价值
将EAOC发生作为因变量(1=发生, 0=未发生),将病变组织的PTEN、ARID1A及CLOCK表达作为自变量,绘制ROC曲线图,当病变组织的PTEN、ARID1A及CLOCK的cut-off值分别取1.352、1.512、4.953时,提示EAOC发生风险较高, PTEN、ARID1A及CLOCK单独及联合预测EAOC发生的AUC分别为0.856、0.860、0.870、0.931。见表6、图4。

表6 病变组织PTEN、ARID1A及CLOCK基因单独及联合预测EAOC的诊断价值
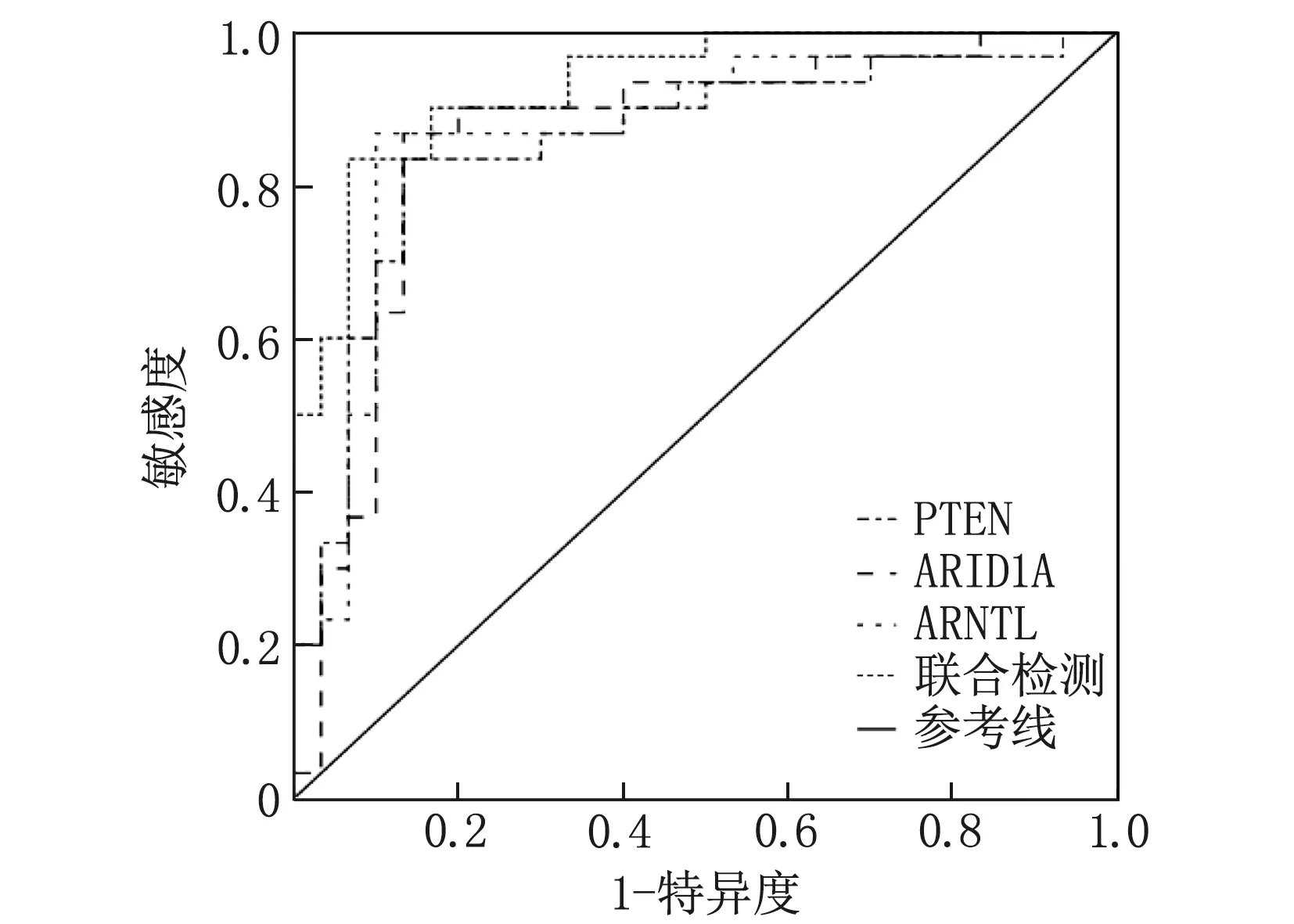
图4 病变组织PTEN、ARID1A及CLOCK基因单独及联合预测EAOC的ROC曲线
3 讨 论
研究[13]指出约2.5%的EMS患者可发展为EAOC。EAOC是指发生机制和组织学与EMS密切相关的一组特殊的病理类型,与病变存在一定的相似性。本研究结果显示, EAOC和未发生EAOC的单纯EMS病变组织均存在纤维结缔组织增生、炎症细胞浸润及巨噬细胞,该结果进一步佐证EAOC是由EMS恶化的结果。研究[14-15]显示EAOC可能与EMS存在遗传相似性,具体表现为基因改变谱系相似。全基因组关联研究[16]表明,基因标记增加EMS的相关风险,EAOC被认为是卵巢癌发病的直接前体。EAOC的增殖分化等病理进展过程受到多种基因的调节,这些基因的突变、蛋白功能或表达改变均有可能参与肿瘤的进展[17-18]。
PTEN是首个被发现的具有磷酸酶活性的抑癌基因,通过影响肿瘤细胞的生物学特征而发挥作用,如增殖、凋亡和迁移等。PTEN作为子宫内膜的管家基因,在维持内膜腺上皮和间质细胞代谢方面具有重要作用; 此外, PTEN具有蛋白磷酸酶活性,可负性调控细胞的转移与浸润,通过抑制依赖P13K激活的蛋白激酶B活性等机制加速诱导细胞死亡[19]。研究[20]发现,非EAOC子宫囊肿组织中PTEN蛋白和基因表达均显著降低,诱导血管内皮表达,促进异位的内膜组织的微小血管生成,进而为异位子宫内膜的成功种植和生长创造了有利条件。ARID1A具有改变染色质结构来达到调控靶基因表达的作用,在诸多恶病质中呈低表达,这也提示ARID1A可能是一种重要的抑癌基因[21]。ARID1A的基因突变存在于乳腺癌、胃癌及膀胱癌等多种肿瘤中,其缺失突变对于预测早期卵巢透明细胞癌发生具有一定的价值[22]。
本研究采用检测EAOC与未发生EAOC的单纯EMS病变组织的ARID1A 蛋白和基因,结果显示,与非EAOC相比, EAOC癌组织的ARID1A蛋白和基因表达均显著降低。研究[23-24]显示EAOC发生后, ARID1A发生移码、突变,而ARID1A的移码、突变又导致机体蛋白表达缺失,造成恶性循环,导致EAOC发生并加速病情进展,但本研究EAOC癌组织的ARID1A蛋白和基因表达显著降低是否与ARID1A基因突变有关,仍需要进一步研究证实。生物钟是一种调节生物过程和日常行为(即生物规律)的进化保守的分子计时机制,以24 h为周期的昼夜节律是生物钟在机体内最为常见的表现形式。昼夜节律受到多种节律基因的调节,这些基因的正常表达可保证机体每日在同一时间发生的行为具有规律性和重复性,以保证机体在正确的时间引发适当的生理或行为反应。节律紊乱会导致多种妇产科疾病的发生,如月经周期紊乱、EMS等[25]。近年来,有关生物节律与肿瘤发生的研究也越来越多,多种节律基因参与调节胰腺癌、乳腺癌、卵巢癌等恶病质的发生[26-27]。CLOCK是生物钟的核心基因,可节律性地共同结合到E-box上调节多种基因的转录,其中包括肿瘤基因c-MYC[28]。早期研究[29]发现CLOCK在卵巢癌细胞中表达减少,并且其表达水平可能与生存率、肿瘤分期分型有关,提示节律基因参与了卵巢癌的发病,并对卵巢癌的治疗提供一定依据,但是节律基因是否参与EAOC的发病及其调节机制仍未可知。本研究结果显示,与非EAOC组相比,EAOC组癌组织的CLOCK蛋白和基因相对表达均较高,究其原因可能是CLOCK可调控组织细胞增殖、生长代谢、凋亡的节律性,当CLOCK发生突变后,生物节律体系被打破,导致EAOC发生。本研究Logistic回归分析显示,病变组织的PTEN、ARID1A及CLOCK异常表达可能与EAOC发生有关, PTEN和ARID1A是EAOC发生的保护因子, CLOCK是促进EAOC发生的风险因子(OR>1,P<0.05)。ROC曲线证实,病变组织的PTEN、ARID1A及CLOCK的表达对预测EAOC发生具有一定的价值,但联合检测预测EAOC发生的效能最高。
本研究存在的不足: ① 作为EAOC潜在肿瘤标记物, PTEN与ARID1A受到广泛关注,是否存在其他抑癌基因与ARID1A协同突变来促进EAOC的发生、调节肿瘤细胞转移,PTEN是否与ARID1A协同调节EAOC的发生发展及其具体调节的分子机制仍需进行深入研究。② 本研究检测术后的切除的病变标本PTEN、ARID1A及CLOCK表达,其变化与临床病理参数相关,但三者的改变是癌变的原因、癌变的结果还是贯穿癌变的全过程,仍需结合EAOC细胞模型进一步确认。
综上所述,未发生EAOC的单纯EMS及EAOC病变组织的PTEN、ARID1A及CLOCK表达存在显著差异, PTEN、ARID1A及CLOCK可能参与了EAOC发生。PTEN和ARID1A是EAOC发生的保护因子, CLOCK是促进EAOC发生的风险因子。检测PTEN、ARID1A及CLOCK有助于临床诊断EAOC, 且三者联合检测的诊断价值最高。

