凋亡蛋白Caspase-9/Caspase-3在慢性间歇性低氧模型小鼠肝损伤中的作用
余孝海 刘国莹 钟明奎
摘要:目的探索凋亡蛋白Caspase-9/Caspase-3在慢性间歇性低氧模型小鼠肝损伤中的作用。方法将雄性C57小鼠随机分为正常氧对照组(Sham)、慢性间歇性低氧组(CIH),CIH组小鼠放入低氧仓进行间歇性低氧处理(8 h/d,连续28d)。4周后HE 染色显微镜下观察肝部病理形态学改变,比较两组小鼠血清指标白介素-1(IL-1)、白介素-6(IL-6)、谷丙转氨酶(ALT)、谷草转氨酶(AST)水平。用Western blot检测小鼠肝组织中凋亡蛋白Caspase3 和Caspase9的水平。结果与Sham组相比,CIH组肝组织形态学病理改变受损严重,白介素-1(IL-1)、白介素-6(IL-6)、谷丙转氨酶(ALT)、谷草转氨酶(AST)水平显著升高;凋亡蛋白Caspase3 和Caspase9的表达上调。结论慢性间歇性低氧引起肝损伤,机制可能与凋亡蛋白上调相关。
关键词:慢性间歇性低氧,肝损伤,凋亡蛋白
中图分类号:R531.8
文献标识码:A
文章编号:1674-9545(2023)03-0102-(05)
DOI:10.19717/j.cnki.jjun.2023.03.019
间歇性低氧(chronicinter—mittent hypoxia,C1H)是阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)最为典型的病理生理特征,OSAS可以引起代谢综合征损伤多种器官[1]。氧化应激是指体内活性氧(reactive oxygen species,ROS)与抗氧化剂和活性氮之间的一种动态平衡被打破。缺血再灌注模型可以模擬OSAS患者睡眠中反复出现的缺氧-复氧损伤,缺氧-复氧破坏了患者体内抗氧化剂和促氧化剂平衡系统,体内过量产生ROS,从而导致过氧化损伤[2]。缺氧还可以造成引起慢性炎症,慢性炎症也是OSAS重要的病理生理学特征。OSAS引起的CIH在体内可过量产生ROS,ROS的过度激活主要是两方面参与机体调节,一方面参与体内氧化应激反应,另一方面可以作为第二信使,可以激活低氧诱导因子-1α和核因子kB(Nuclear Factor-kB ,NF-kB)等核转录因子,NF-k B通路是比较常见的炎症信号通路,同时可以使白介素IL-6(interleukin-6,IL-6)和肿瘤坏死因子TNF-α(Tumor Necrosis Factor-α,TNF-α)活化,引发炎症反应[3,4]。 同时有研究显示,CIH可以促进非酒精性肝病(nonalcoholic fatty liverdisease,NAFLD)患者的病情变化,从脂肪肝不断进展为肝硬化、甚至是肝癌。即使是没有伴随NAFLD大鼠,CIH也可通过促进一系列炎症反应,从而调控炎症因子活性,一定程度造成肝损伤[5-6]。氧化损伤与细胞凋亡有很大关系,氧化损伤是导致肝损伤的原因之一。该研究目的是建立慢性间歇性低氧模型,观察慢性间歇性低氧时凋亡蛋白在肝脏损伤中的作用,探讨慢性间歇性低氧模型(CIH)小鼠对肝损伤机制。
1.1 材料
1.1.1 动物 实验动物清洁级雄性C57小鼠,(n=16,体重=27±4g),由安徽长临河医药科技有限公司,按照安徽医科大学实验动物保护条例执行,并严格遵守,合格证号 Scxk(皖)2017-001。实验小鼠被养在标准笼中,每笼不超过8只,12 h暗光循环保证昼夜节律,饲养期间不干预小鼠进食和饮水,动物房环境保持良好的通风和温湿度条件。自由进水和实物充分,室内温度保持18~25℃,小鼠的使用严格执行《中华人民共和国实验动物管理条例》。
1.1.2仪器 测氧仪(CYS-1型,购自南京新飞分析仪器公司);液氮罐(医用,成都金凤液氮容器有限公司);酶标仪(南京德铁实验公司)。
1.1.3 试剂 压缩氧气(浓度大于99. 9%) 、压缩氮气(浓度大于99. 99% ,高纯氮气) 都是由合肥市医用氧气厂提供;谷丙转氨酶(glutamie-pyruvic transaminase,ALT)(长春汇力公司)、谷草转氨酶(glutamic-Oxalacetie transaminase AST);(长春汇力公司);Caspase3 antibody、Caspase9 antibody(博奥森生物技术有限公司)。白介素-l(interleukin-1,IL-1),白介素-6(interleukin-6,IL-6)(北方生物公司)。
1.2方法
1.2.1慢性间歇性低氧模型的制备和分组 小鼠在饲养一周后进行实验,随机分成Sham组、CIH组,每组均为8只。该实验的原理是利用氮气稀释原理,对照该实验室先前的造模方法,将实验组小鼠轻轻放入含有测氧仪探头的低氧舱内,实时显示数据,通过测氧仪探头监测氧浓度,通过两个旋钮调节氧气和氮气气体流量,氧浓度始终控制在6~21%范围内。氧气和氮气由两个旋钮阀门控制,一个循环时间为9 min,先充入氮气4 min ,使低氧舱内的氧浓度下降到约6% ,保持约 40 s ;随即充入氧气5 min ,氧浓度恢复至最高约21%,保持约 40 s,循环往复周期,每天8 h( 9∶00 am~5∶00 pm) 共28d。造模第28d之后,将小鼠处死,进行下一步实验。
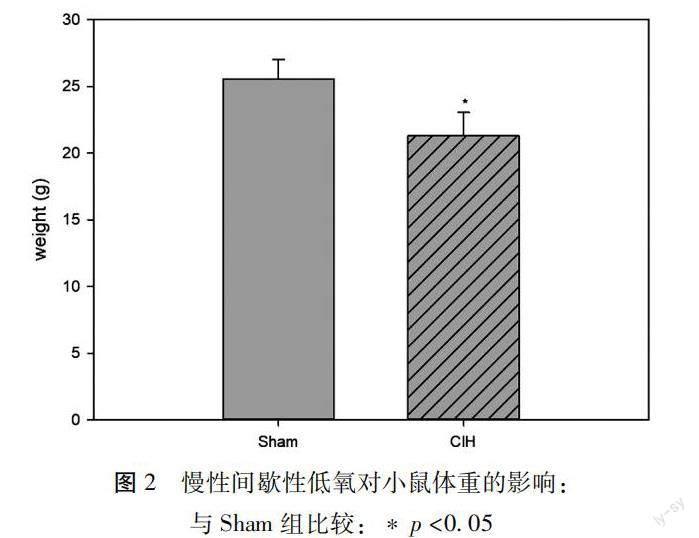
1.2.2体重的测定 低氧模型制备完成之后,首先进行小鼠体重测量。
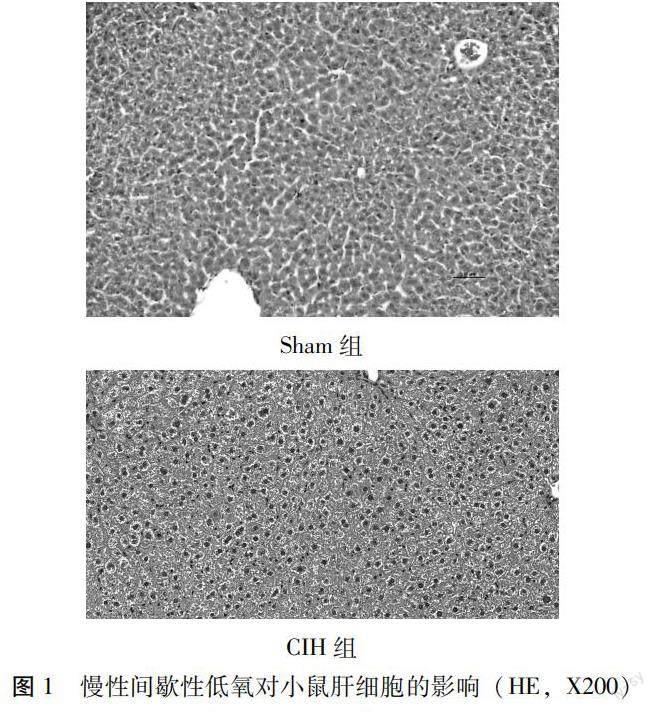
1.2.3 组织学观察小鼠的肝脏 小鼠的肝组织被清水洗涤之后,用滤纸包裹吸干,多聚甲醛对其进行冲洗,同时准备含有多聚甲醛溶液的试管,在其中固定,实验室脱水机脱水之后,石蜡包埋技术将肝组织包埋成蜡块以备后期观察,将肝脏蜡块标本切成4μm 薄片,随即放入温水中任其自由展开,展开后用载玻片捞出,放入90℃烘烤箱中,约20 min后进行脱蜡,准备染色并封片,用光学显微镜下放大200倍观察肝脏部病理改变,同时截图留存。
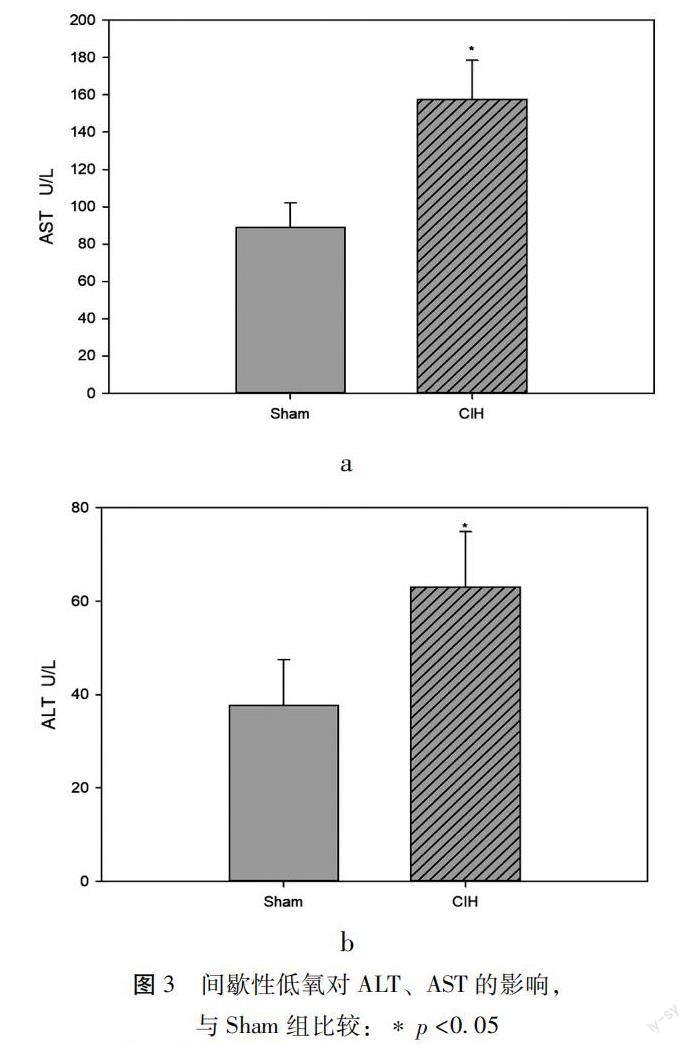
1.2.4 血清指标的检测 实验结束后,采用眼球取血,提前加入抗凝剂,离心后提取血清,ALT和AST水平采用化学法测定,放射免疫分析法检测测定IL-1、IL-6水平,具体操作参照相应试剂盒说明。
1.2.5 小鼠肝脏凋亡蛋白的测定 小鼠处死后,在冰盘上取出肝脏,取适量肝脏组织与对应剂量的RIPA裂解液在研钵器中充分研磨,裂解液的成分为:150 mol/L NaCl、50 mol/L Tris·base、1% NP-40、50 mol/L NaF、1% PMSF,充分研磨成匀浆后,放在4℃冰箱里,10min离心,用枪头提取上清液,分别装于准备好的EP管中,临时保存于-20℃冰箱中。
1.4统计学处理 实验结果x-±s表示,用SPSS 26.0软件对数据做统计分析两组之间的比较采用配对t检验,多组之间的比较选用单因素方差分析(ANOVA),p<0.05为差异有统计学意义。
2结果
2.1慢性间歇性低氧对小鼠肝细胞结构的影响 正常组在显微镜下肝脏组织细胞形态正常,排列整齐,大小规整,细胞无明显变性及坏死情况。显微镜下低氧组肝脏组织中肝细胞肿大及空泡化明显,细胞排列紊乱无序,有细胞出现变性及坏死,有炎症细胞聚集现象。
2.2慢性间歇性低氧对小鼠体重的影响 与Sham组相比,间歇性低氧28d后,CIH组小鼠体重[(25.53±1.49)vs(21.28±1.77),p< 0.05,]明显减轻,见图 2。
2.3慢性间歇性低氧对小鼠肝脏生化血清指标的影响 肝脏生化血清指标显示CIH组ALT水平[(37.63±9.89)vs(63.06±11.79),p<0.05],AST水平[(88.74±13.56)vs(157.56±20.96),p<0.05]显著高于Sham组,见图3。
2.4 慢性间歇性低氧对凋亡蛋白的影响 与Sham组相比,间歇性低氧28d后,CIH组凋亡蛋白Caspase-3 和Caspase-9的蛋白表达上调,见图4。
2.5 慢性间歇性低氧对小鼠肝脏生化血清指标IL-1、IL-6的变化
血清指标显示CIH组IL-1水平[(94.13±24.07)vs(134.06±21.02),p<0.05],IL-6水平[(61.99±7.66)vs(140.06±20.30),p<0.05]显著高于Sham组,见图5。
3讨论
OSAS以CIH最为典型病理生理学特征之一,是一种危险性比较高的疾病类型,OSAS可引起高血压、糖尿病和代谢综合征等多种疾病。根据最新研究调查显示:大概35~45%的肥胖患者伴有OSAS,超过4%的普通人群也患有OSAS[7]。实验发现经过间歇性低氧處理28 d后,CIH组肝脏组织中肝细胞肿大及空泡化明显,细胞排列紊乱无序,有细胞出现变性及坏死,有炎症细胞聚集现象,显微镜下CIH组肝组织形态学病理改变受损严重,白介素-1(IL-1)、白介素-6(IL-6)、谷丙转氨酶(ALT)、谷草转氨酶(AST)水平显著升高;凋亡蛋白Caspase3 和Caspase9的表达上调,结果提示慢性间歇性低氧引起肝损伤,机制可能与凋亡蛋白上调相关。间歇性低氧一段时间后小鼠体重降低,由于低氧环境对小鼠产生应激反应,小鼠减少摄食,导致体重减轻。有关文献研究发现:间歇性缺氧可通过诱导脂代谢紊乱导致脂肪肝的发生,脂代谢紊乱导致脂肪肝的发生同低氧水平呈正相关[8-9]。CIH的最典型特征是机体不断发生的血氧去饱和,同时ROS产生的重要来源也可以是组织氧利用度的振荡不断变化,机体在过氧化物与抗氧化物的相互失衡可产生过量的ROS,ROS的产生引起氧化应激反应,氧化应激可通过DNA损伤、细胞功能障碍、诱导凋亡、信号通路的激活等一系列途径加重肝损伤。细胞内线粒体作为维持细胞基本功能的关键细胞器,很容易不同程度上受到氧化应激的影响,线粒体功能异常会进一步促进内源性的 ROS 产生[10],氧化损伤与细胞凋亡有很大关系,氧化损伤与肝损伤密切相关,Caspase-9是诱导细胞凋亡经过线粒体途径的主要指标之一,Caspase-9被激活后促进慢性间歇性低氧诱导肝细胞凋亡,Caspase-3在各种凋亡方式中扮演了执行小分子,所以它被认为是细胞凋亡的标志,同时Caspase-9被激活后引起一系列反应,下游Caspase-3被激活,通过线粒体途径诱导细胞凋亡,从而导致肝损伤[11-13]。OSAS对肝脏的损伤主要是病理性改变,表现为肝脏出现不同程度的损伤、炎症、纤维化等[14]。HIF是在缺氧情况下机体内重要转录因子,分为α亚基和β亚基,α亚在低氧环境下,一般结构稳定,而在常氧环境下不稳定而降解,与β亚基结合而发挥相应作用,缺氧时,由于HIF-1αm RNA表达增加,增加HIF-1α活性及相关蛋白稳定性,重新获得氧气后HIF-1α蛋白降解,HIF-1α和其结合序列多种基因作用来完成细胞缺氧反应性的调节[15]。
细胞发生凋亡的过程中,有Caspase依赖机制,也有非Caspase依赖机制。陈素艳等[16]对缺血再灌注模型取样后,检测脑组织凋亡相关蛋白Caspase-9和Caspase-3m RNA水平,提示凋亡蛋白Caspase-9和Caspase-3 m RNA的水平上调在48 h达到顶值,然后不断下降,研究表明缺血再灌注模型大鼠神经损伤与凋亡蛋白上调密切相关,凋亡蛋白Caspase是凋亡中重要的分子。本研究发现,小鼠慢性间歇性低氧28 d后,间歇性低氧组肝组织形态学病理改变受损严重,白介素-1(IL-1)、白介素-6(IL-6)、谷丙转氨酶(ALT)、谷草转氨酶(AST)水平显著升高,凋亡蛋白Caspase3 和Caspase9的表达上调,提示慢性间歇性低氧引起肝损伤,机制可能与凋亡蛋白上调相关。凋亡蛋白Caspase3 和Caspase9可能参与慢性间歇性低氧引起肝损伤。
参考文献:
[1]Liu JN,Zhang JX,Lu G,et al.The effect of oxidative stress in myocardial cell injury in mice exposed to chronic in—termittent hypoxia[J].ChinMedJ,2010,123(1):74.
[2]Lavie L. Oxidative stress in obstructive sleep apnea and intermittent hypoxia-revisited-the bad ugly and good: implications to the heart and brain[J]. Sleep medicine reviews, 2015,20(3):27.
[3]Meléndez GC, Mc Larty JL, Levick SP, et al. Interleukin 6 mediates myocardial fibrosis, concentric hypertrophy, and diastolic dysfunction in rats[J]. Hypertension (Dallas, Tex. : 1979), 2010,56(2):225.
[4]Zhao L, Cheng G, Jin R, et al. Deletion of Interleukin-6 Attenuates Pressure Overload-Induced Left Ventricular Hypertrophy and Dysfunction[J]. Circulation research, 2016,118(12):1918.
[5]张香红.间歇性低氧诱导大鼠心肌损伤及依达拉奉的干预作用[D].兰州:兰州大学,2021.
[6]Paschetta E,Belci P,A1isi A,et a1.OSAS-related infla-matory mechanisms of liver injury in nonalcoholic fatty liverdisease[J].Mediators Inflamm,2015,20(5):815721.
[7]杨胜昌,陈玲玲,傅天,等. 氢气对慢性间歇性低氧大鼠肝脏氧化应激损伤的改善作用[J].中国应用生理学杂志, 2018,34(1);61.
[8]Karkinski D,Georgievski O,Dzekova-Vidimliski P,et a1.Obstructive Sleep Apnea and Lipid Abnormalities[J].Open Access Maced J Med Sci,2017,5(1):19.
[9]范風云,沈婉婷,郑青青,等. 低氧性肺动脉高压小鼠体内脂质水平的变化[J].中国应用生理学杂志,2016,32(5):463.
[10]Han D, Gu X, Gao J, et al. Chlorogenic acid promotes the Nrf2/HO-1 anti-oxidative pathway by activating p21(Waf1/Cip1) to resist dexamethasone-induced apoptosis in osteoblastic cells [J]. Free radical biology & medicine, 2019, 137(6): 1.
[11]Wasilewski m,Scorrano L.The changing shape of mitochondrial apoptosis[J].Trends in Endocrino logy and Metabolism,2009,20(6):287.
[12]孙琳,李侠,赵玉军.细胞凋亡机制在无机汞致肾脏损害中作用的研究进展[J].工业卫生与职业病,2020,46(4):341.
[13]Wu P B,Song Q,Yu YJ,et al.Effect of metformin on mitochondrial pathway of apoptosis and oxidative stress in cell model of nonalcoholic fatty liver disease[J].Chinese Journal of Hepatology,2020, 28(1):64.
[14]马克. TGR5在胆盐引起的肝内胆管结石病肝内胆管纤维化中的作用及机制初探[D].遵义:遵义医科大学,2022.
[15]Wenger RH.Cellular adaptation to hypoxia:O2-sensing proteinhydroxylases,hypoxia-inducible transcription factors,and O2-regulated gene expression[J].FASEB J,2002,16(3):1151.
[16]陈素艳,张振香,高峰,等.常压氧疗对大鼠脑缺血再灌注后脑组织Caspase-9及Caspase-3 m RNA表达的影响[J].郑州大学学报(医学版),2014,49(2):203.
(责任编辑 胡安娜)

