混合酵母发酵对皇冠梨酒酚类、抗氧化性和风味物质的影响
陈江魁,殷春燕,张献忠,杨明建
(邯郸学院生命科学与工程学院,河北 邯郸 056005)
我国梨的产量位居世界第一位,是仅次于柑橘、苹果的第三大水果[1]。除作为食用水果外,梨也是果酒的原料之一,目前已有多款梨酒产品投入市场,但与葡萄酒、苹果酒等相比,梨酒因香味不足等问题导致消费者的认可度不高[2]。皇冠梨为中早熟品种,产量高、品质好,是我国种植的主要梨品种之一,除鲜食外由于缺乏适当的产业加工而难以延长产业链,皇冠梨虽有成为梨酒的潜力,但其产品仍有口味清淡、品质不佳的缺点[3]。
多酚是果酒重要物质之一,赋予果酒多样的口感特征。梨酒中的熊果苷、绿原酸、儿茶素等主要多酚类物质对产品的感官质量,特别是风味、颜色、苦涩感有较大影响;此外多酚的化学结构使它们具有特定的生物活性,一些研究[4]显示梨多酚具有诸如抗氧化、抑菌、抗动脉硬化等功能。有机酸是梨酒中另一重要组分,其大多来源于梨果本身,也有一些产生于发酵过程,酒精饮料中的有机酸含量对风味的平衡也有很大影响,另外有机酸可充当多酚的增效剂,有助于口感的收殓性。果酒的风味还与酵母等微生物有密切联系[5]。酵母包括酿酒酵母(Saccharomyces cerevisiae,Sc)和非酿酒酵母,后者常用于改善产品的风味、提升果酒综合品质。酿酒酵母与非酿酒酵母共同发酵可以显著改善果酒的品质,例如有研究表明贝酵母(S.bayanus)[6]通过改善风味化合物(如乙酸酯、高级醇等)的组成提高了苹果酒的感官特性;非酿酒酵母发酵可以改变果酒的有机酸及酚类谱图[7];最近有研究,德尔布有孢圆酵母(Torulaspora delbrueckii,Td)有助于提高己酸乙酯等的含量,对果酒质量产生积极的影响[8-9]。
因此,本研究选用市场常用的Sc与Td混合发酵皇冠梨酒,以Sc单菌发酵作为对照,分别对发酵过程中的有机酸、酚类物质、抗氧化活性和挥发性化合物进行检测,探究混合酵母发酵对产品质的影响,期望提升皇冠梨酒中乙酸酯类、乙酯类及高级醇等的含量,进而丰富梨酒风味,解决口味清淡问题,为增加皇冠梨的产品附加值提供支持。
1 材料与方法
1.1 材料与试剂
皇冠梨采摘于河北魏县。
Sc、焦亚硫酸钾 法国SOFRALAB公司;Td(CICC 33295)北京生物保藏中心;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)北京诺博莱德科技有限公司;福林-酚、硝酸铝、甲醇、乙腈(均为分析纯)上海麦克林生化科技股份有限公司;有机酸标准物草酸、酒石酸、奎宁酸、苹果酸、乳酸、乙酸、柠檬酸 阿拉丁生化科技公司;酚类标准物没食子酸、阿魏酸、原儿茶酸、绿原酸、儿茶素、表儿茶素、芦丁、熊果苷 美国Sigma-Aldrich公司。
1.2 仪器与设备
BioFlo/CelliGen 115型3 L发酵罐 德国Eppendorf公司;T6紫外-可见分光光度计 北京普析通用公司;e2695高效液相色谱仪、2489紫外-可见光检测器 美国Waters公司;Clarus 680-Clarus SQ 8T型气相色谱-质谱联用仪、Elite Wax气相色谱柱(30 m×0.25 mm,0.25 μm)美国珀金埃尔默公司;65 μm PDMS/DVB固相微萃取头、固相微萃取手柄 美国Supelco公司。
1.3 方法
1.3.1 皇冠梨酒发酵工艺
根据实验室前期的工作基础及参考袁晓龙等[10]混合酵母发酵鸭梨的优化条件,确定工艺条件。
工艺流程:新鲜皇冠梨→浸泡、清洗→去梗、去芯、切块→榨汁→灭菌护色→调糖、调pH值→接种发酵→转罐→澄清。
操作要点:1)Sc活化:活性干酵母直接加入10 倍体积的梨汁中,30 ℃静置25 min;Td活化:接种至5 °Bé麦芽汁液体培养基中活化24 h;然后在不同梨汁含量的液体培养基依次转接进行驯化,以1%接种量依次转接至30%梨汁+70%麦芽汁液体培养基、70%梨汁+30%麦芽汁液体培养基、100%梨汁中,分别于28 ℃、120 r/min条件下培养24 h,活菌数达到1×108CFU/mL以上时备用。2)灭菌护色采用巴氏法,新鲜榨取的梨汁2 L,使用市售蔗糖调节初始可溶性固形物为22 °Bx,转至灭菌后的发酵罐中在80 ℃条件下保持5 min;接种活化后的Td2%,24 ℃培养24 h后再接种活化后的Sc2%。发酵时间共6 d,此工艺下,发酵所得梨酒乙醇体积分数11.2%,可溶性固形物含量为4.5 °Bx,酒体果香淡雅,感官评分高。
以Sc和Td混合发酵梨酒为Sc+Td组,Sc单菌发酵梨酒为Sc组,不接种发酵梨汁为空白。
1.3.2 乙醇体积分数和可溶性固形物的测定
乙醇体积分数测定参考GB 5009.225—2016《酒中乙醇浓度的测定》;可溶性固形物含量测定参考NY/T 2637—2014《水果和蔬菜可溶性固形物含量的测定 折射仪法》。
1.3.3 皇冠梨酒测试样品准备
发酵期内间隔1 d取样,发酵液经6000 r/min离心10 min后,收集上清液20 mL,按照1∶1的比例用乙酸乙酯提取3 次,混合有机相于真空旋转蒸发仪中35 ℃蒸至近干,干燥物溶于20 mL乙醇中,作为分析用测定样品。
1.3.4 酚类物质总量测定
1.3.41 总酚(total polyphenols,TP)含量测定
采用福林-酚法[11]。以没食子酸为标准物质,用1000 mg/L的母液分别配制0、5.0、10.0、15.0、20.0、25.0 mg/L没食子酸标准溶液。分别吸取1 mL标准溶液,加入1 mL福林-酚试剂、2 mL 12% Na2CO3溶液,用蒸馏水定容至10 mL,混合物随后在黑暗中温育1 h,在765 nm波长处测定吸光度,得到标准曲线和回归方程。以测定样品代替没食子酸标准溶液,根据吸光度计算梨酒发酵液中TP 质量浓度,结果以没食子酸当量(mg/L)表示。
1.3.42 总黄酮(total flavonoids,TF)含量测定
使用亚硝酸钠-硝酸铝比色法,参考Pu Yunfeng等[12]的方法并稍作修改。以芦丁为标准物质,配制200 μg/mL标准贮备液,分别吸取0、0.2、0.4、0.8、1.2、1.6、2.0 mL标准贮备液于10 mL具塞试管中,加入60%乙醇溶液补足至5 mL,然后加5%亚硝酸钠溶液0.3 mL,静置6 min;再加入10%硝酸铝溶液0.3 mL,静置6 min;最后加入4%氢氧化钠溶液4 mL,并用60%乙醇溶液定容至刻度,静置12 min,在510 nm波长处测定吸光度。以测定样品代替标准溶液,根据回归方程计算TF质量浓度,结果以芦丁当量(mg/L)表示。
1.3.5 有机酸与酚类物质测定
采用高效液相色谱法测定梨酒发酵过程中有机酸和酚类物质的含量,外标法定量。
测定条件:测定样品用0.45 μm极性滤膜过滤到1 mL的进样瓶中,在反相C18色谱柱(4.6 mm×250 mm,5 μm)上分离,进样量10 μL,用紫外检测器在210 nm波长处测定有机酸含量[13],流动相为0.01 mol/L KH2PO4-H3PO4(pH 2.7)(A)和甲醇(B),溶剂A与B的比例为97∶3,流速为0.6 mL/min。用紫外检测器在280 nm波长处测定酚类化合物含量[14],1%甲酸(A)和100%乙腈(B)的梯度分别为:0~5 min,95% A、5% B;5~25 min,88%~70% A、12%~30% B;25~40 min,70%~55% A、30%~45% B;40~50min,55%~95% A、45%~5% B;50~60 min,95% A、5% B;60 min后,溶剂B降至2%,流速1.0 mL/min。
1.3.6 抗氧化活性测定
参考GB/T 39100—2020《多肽抗氧化性测定 DPPH和ABTS法》,以DPPH自由基清除率评价梨酒的抗氧化活性。
实验组:3.0 mL DPPH自由基溶液和1.0 mL测定样品;对照组:3.0 mL无水乙醇和1.0 mL测定样品;空白组:3.0 mL DPPH自由基溶液和1.0 mL乙醇。各组分混匀后,避光反应30 min,于波长517 nm处测定其吸光度。
式中:A1为实验组的吸光度;A2为对照组的吸光度;A3为空白组的吸光度。
1.3.7 挥发性风味物质分析
采用气相色谱-质谱对梨酒的风味挥发物进行测定[15]。将10 mL梨酒(4500 r/min离心10 min后取上清液)和1 g NaCl加入到25 mL玻璃瓶中,插入萃取头对挥发性风味物质进行萃取,50 ℃吸附平衡15 min。GC进样解吸1.5 min,载气为氦气,流速为1 mL/min。以2-辛醇为内标,采用半定量法计算各挥发性组分的含量。
1.4 统计分析
2 结果与分析
2.1 发酵过程中乙醇体积分数和可溶性固形物的变化
如图1所示,随着发酵进行,两组发酵的可溶性固形物在1~5 d呈快速下降趋势,此阶段酵母发酵旺盛,营养物质消耗较快;5 d后趋于平缓,到6 d已由原来的22 °B x 分别降至(4.3±0.4)°B x(S c)和(4.5±0.4)°Bx(Sc+Td)。发酵液的乙醇体积分数在2~5 d上升明显,5 d后平缓。结合乙醇的生成、可溶性固形物消耗情况,主发酵为6 d较好,此时Sc单菌发酵的乙醇体积分数为(11.5±0.5)%,Sc+Td混合发酵的乙醇体积分数为(11.2±0.6)%,香气浓郁。
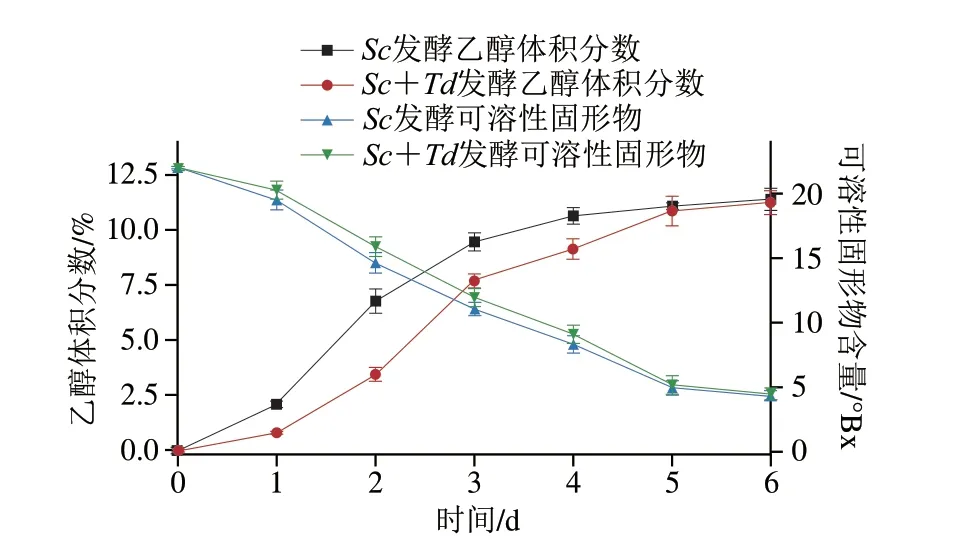
图1 发酵过程中乙醇体积分数和可溶性固形物含量的变化Fig.1 Changes in alcohol concentration and soluble solid contents during fermentation
2.2 发酵过程中TP和TF含量的变化
发酵前梨汁中TP质量浓度为(278.8±4.0)mg/L,如图2a所示,两组发酵过程中TP含量先上升后下降。具体地,TP质量浓度Sc+Td发酵第3天(302.0±3.3)mg/L、Sc发酵第2天(314.9±3.1)mg/L达到峰值。TF含量的变化(图2b)与TP类似,TF质量浓度Sc+Td发酵第3天达到高峰(129.0±1.3)mg/L,Sc发酵第2天达到最大值(135.6±1.9)mg/L。发酵结束后,Sc+Td组TP含量增加至(290.4±2.5)mg/L,而TF减少至(104.3±2.6)mg/L,Sc组TP和TF含量都减少(分别为(249.2±2.7)、(90.0±2.3)mg/L)。Sc+Td组的TP、TF含量分别比Sc组高16.5%和15.9%。

图2 梨酒发酵过程中TP(a)和TF(b)含量变化Fig.2 Changes of TP (a) and TF (b) contents during pear wine fermentation
已有研究表明酚类物质含量与乙醇发酵过程中酵母菌的酶反应或代谢活动有关[16],共接种发酵可以增加葡萄酒中酚类物质[17],所以上述现象的主要原因是皇冠梨汁在发酵前期,由于酵母菌作用,某些大分子聚合物逐渐被微生物分解为小分子酚类物质,使TP和TF质量浓度不断增加[18],酵母菌代谢产生的酶也可以分解植物组织细胞壁,释放生物活性物质,随着发酵过程的进行,TP和TF的减少是由于自身氧化或与其他物质反应引起[19]。相比Sc单菌发酵,Sc+Td混合发酵的TP和TF含量有明显提高。TP和TF含量的改变可能是梨酒抗氧化性能变化的原因,本实验也进一步研究了酵母菌发酵前后梨汁中酚类物质分布和抗氧化活性的变化。
2.3 发酵过程中有机酸和单体酚类含量的变化
2.3.1 有机酸含量的变化
有机酸是影响梨酒感官性能的一类重要物质,保证了其风味、口感和色泽的平衡。梨酒中的有机酸主要来源于梨果本身,也有一些是酵母菌发酵过程产生。
采用高效液相色谱测定了梨酒中7 种有机酸发酵前后变化,见表1,与梨汁相比,两组发酵梨酒中苹果酸、乳酸、乙酸含量增加,草酸、酒石酸、柠檬酸含量减少,总酸含量表现为增加。苹果酸是梨汁中的主要有机酸,其初始质量浓度最高,在发酵过程中,苹果酸可以在酵母细胞中合成,也可以由酵母菌的三羧酸循环,利用苹果酸分解产生乙醇、异丁醇和乳酸等物质[20]。乳酸是糖酵解的终产物,可以通过丙酮酸的还原或苹果酸的转化而合成的,其口感比苹果酸柔和很多,表1显示,在原梨汁中乳酸含量很少,发酵过程中形成了乳酸,在发酵后的梨酒中质量浓度分别达到(47.58±1.15)(Sc发酵)、(51.17±2.20)mg/100 mL(Sc+Td发酵),Sc+Td组乳酸含量稍高。
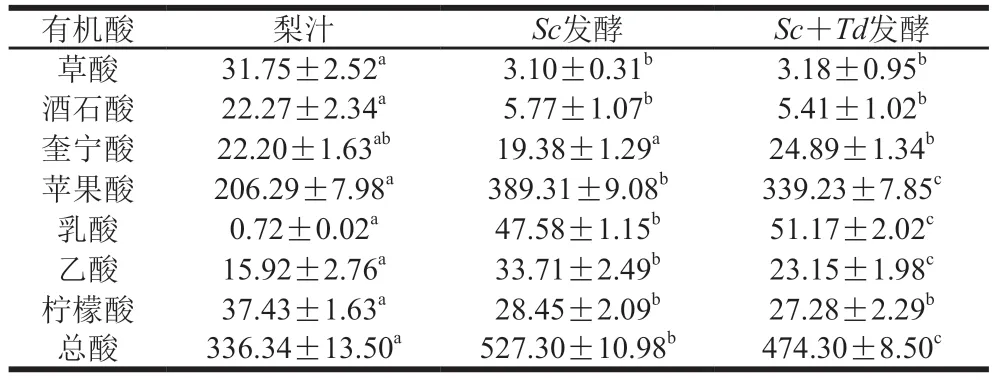
表1 酵母菌发酵梨汁中有机酸质量浓度Table 1 Concentrations of organic acids in pear juice and wine mg/100 mL
对比两组发酵,Sc+Td组较Sc组梨酒的总酸含量低了10.05%(计53.00 mg/100 mL),尤其是苹果酸降低了50.08 mg/100 mL,而乳酸增加了3.59 mg/100 mL,这对改善梨酒“酸味”、增加其柔和度有积极影响。原因可能是单酵母(Sc)发酵产酸能力较强,而混合酵母发酵的酯化性能高于单菌发酵,有效降低了有机酸而增加了酯类物质含量。
2.3.2 单体酚化合物含量变化
果酒中的酚类化合物有一定的“骨架”作用,使果酒口感丰富,同时也是主要的抗氧化物质。酚类化合物的化学结构较多样,根据已报到确定的梨中酚类化成分[21-23],测定了8 种主要的酚类化合物,即4 种酚酸(没食子酸、原儿茶酸、阿魏酸、绿原酸)、3 种黄酮(儿茶素、表儿茶素、芦丁)、1 种酚苷(熊果苷)在皇冠梨酒发酵过程中的变化。
从表2可以看出,在两组发酵过程中,原儿茶酸的含量逐渐上升,儿茶素和阿魏酸的含量呈下降趋势,没食子酸在Sc组的含量逐渐降低,在Sc+Td组中的变化不显著,其他酚类物质含量在两组发酵过程中呈现出先上升后下降的趋势。发酵结束时,与梨汁相比,Sc发酵梨酒中原儿茶酸的含量高于梨汁中含量,芦丁的含量无显著差异,其他酚类低于梨汁中的含量;Sc+Td组中原儿茶酸、表儿茶素的含量显著增加,芦丁、没食子酸的含量无显著差异,其他物质低于梨汁中的含量。相比于Sc单菌发酵,Sc+Td混合发酵显著提高了7 种酚类物质的含量(除原儿茶酸外)。
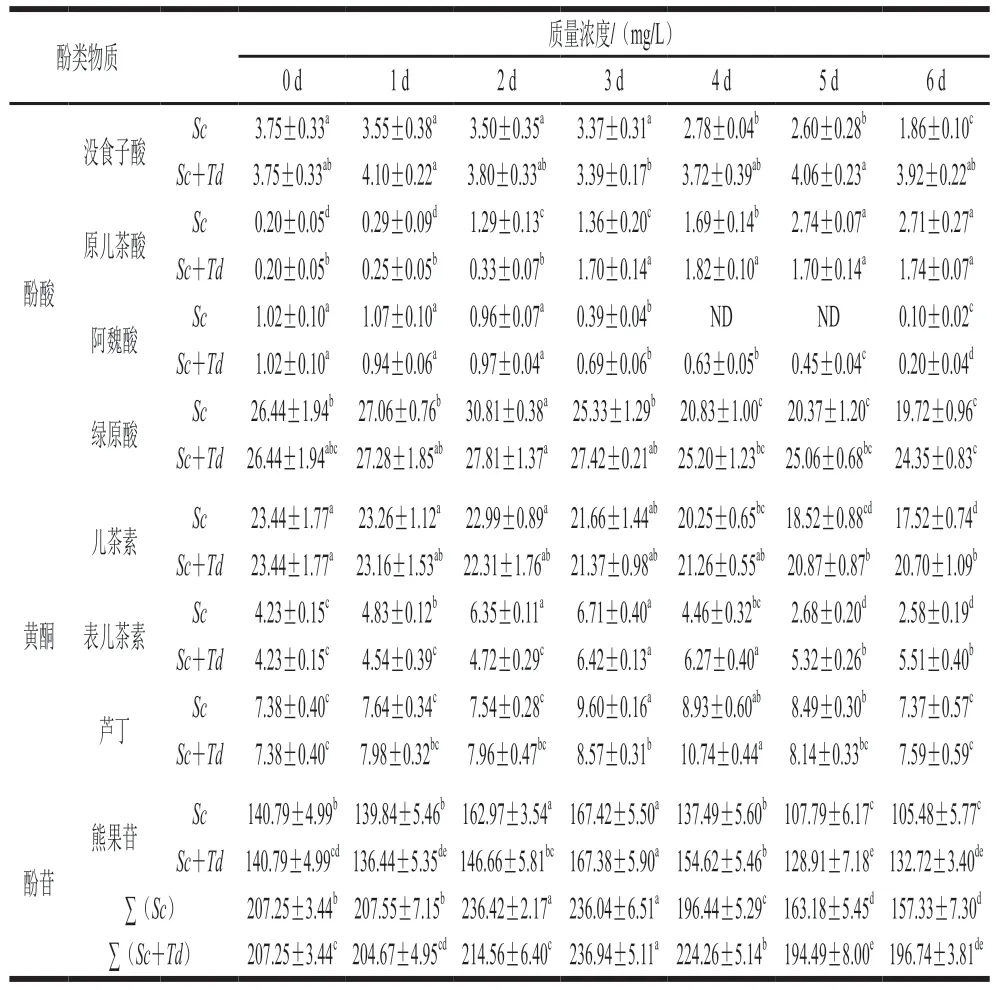
表2 Sc和Sc+Td发酵过程中单体酚含量的变化Table 2 Changes in individual phenol contents in pear wine during fermentation with Sc and Sc+Td
从含量上看,熊果苷和绿原酸是梨汁和梨酒中主要的酚类化合物。熊果苷在开始发酵时质量浓度为(140.79±4.99)mg/L,发酵结束后减少至(105.48±5.77)mg/L(Sc发酵)和(132.72±3.40)mg/L(Sc+Td发酵);而绿原酸是发酵过程中变化最大酚酸,从开始发酵时的(26.44±1.94)mg/L,到发酵结束后其含量下降至(19.72±0.96)mg/L(Sc发酵)和(24.35±0.83)mg/L(Sc+Td发酵),绿原酸的降低多是由于多酚氧化酶存在引起的酸降解作用[24]。发酵过程中,儿茶素的含量减少,说明其在发酵过程中发生了氧化降解,另据报道,儿茶素可被代谢为原儿茶酸[25]而减少。阿魏酸是制造一些芳香族化合物的前体,发酵过程中可转化成4-乙烯基愈创木酚、香兰酸等,导致其含量下降[26]。Td生香酵母分泌的糖苷酶可逆向分解没食子酸与六元糖醇反应形成的酯(糖苷形式),进而防止了混合发酵中没食子酸的损失[27]。8 种酚类物质总量在发酵过程中也呈现先上升后下降趋势,与TP和TF的变化趋势较为一致。
2.4 发酵过程中抗氧化活性的变化
梨酒中的TP和TF是主要的抗氧化活性物质。采用DPPH自由基清除率评价抗氧化活性在发酵过程中的变化。如图3所示,DPPH自由基清除率呈现出先上升后下降的趋势,与发酵过程中TP 和TF含量变化趋势一致。
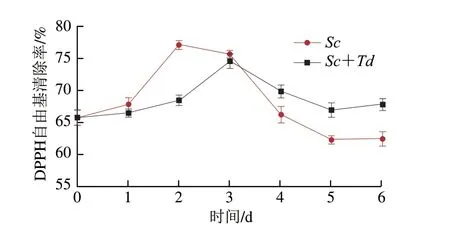
图3 Sc和Sc+Td发酵梨汁过程中DPPH自由基清除率变化Fig.3 Changes in DPPH radical scavenging capacity in pear juice fermented by Sc or Sc+Td
发酵前梨汁的DPPH自由基清除率为65.8%,Sc+Td组在发酵3 d达到最大清除率74.5%,略低于Sc组在2 d达到的最大清除率77.1%;在发酵完成的梨酒中,Sc+Td组的自由基清除率为67.8%,大于Sc组的62.6%,也高于原梨汁的自由基清除率,这与TP 或TF含量不一致,表明在梨酒的发酵过程中酚类化合物的组成也对抗氧化活性产生影响。酚类物质的抗氧化活性与其结构有关[28],特有的酚羟基结构,通过提供较高活度的氢与自由基反应而具备抗氧化活性,羟基的位置(如邻位结构)和羟基的数量也影响抗氧化能力[29-30]。
如图4所示,DPPH自由基清除率与TP、熊果苷、表儿茶素含量有强正相关性(P<0.01),相关系数分别为0.91、0.91、0.9;与TF、绿原酸含量也呈正相关(P<0.01),相关系数分别为0.79、0.74。表儿茶素分子含有邻位的羟基基团,熊果苷分子有4 个酚羟基基团,绿原酸分子结构具有邻二酚羟基,都具有较强的自由基清除能力。
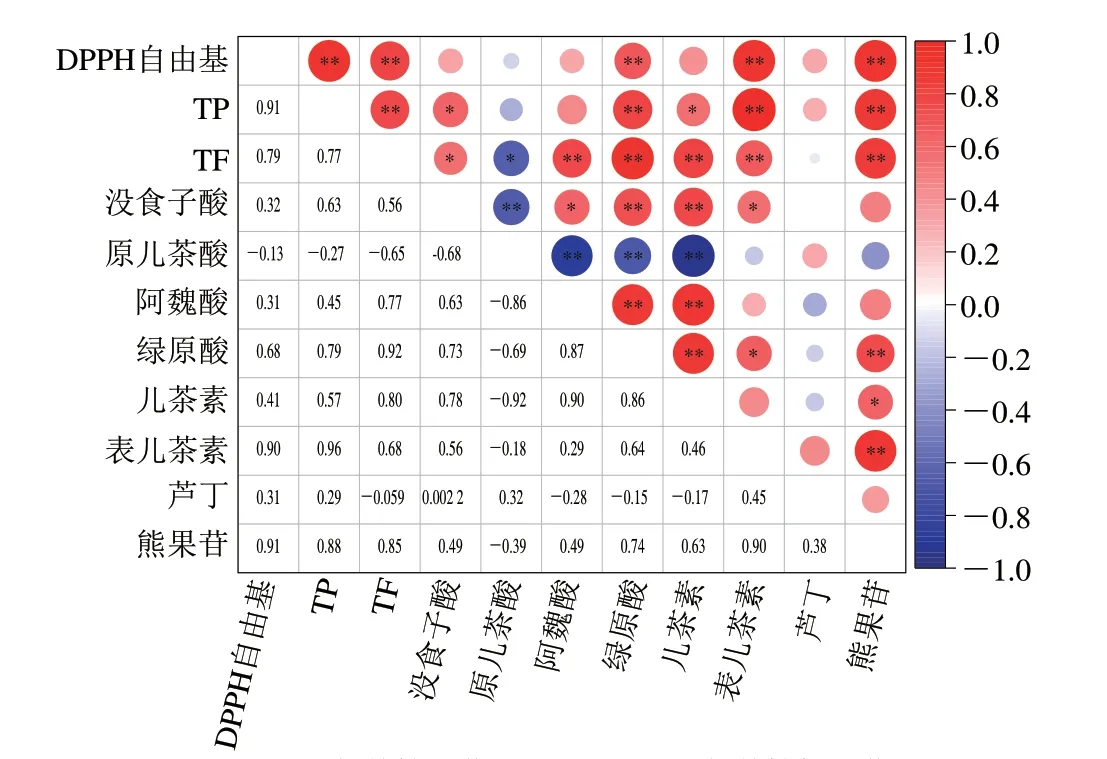
图4 酚类化合物和抗氧化活性的Pearson校正系数热图Fig.4 Heatmap of Pearson correction coefficients between phenolic profile and antioxidant activity
2.5 挥发性风味化合物分析
采用顶空固相微萃取和气相色谱-质谱联用技术对单菌发酵和混合发酵酒的皇冠梨酒挥发性物质含量进行分析,选取主要的30 种成分进行比较(表3),其中酯类13 种、醇类11 种、酸类4 种、其他类2 种。

表3 Sc和Sc+Td发酵皇冠梨酒中主要挥发性风味成分比较Table 3 Comparison of the major volatile flavor compounds in crown pear wine fermented by Sc and Sc+Td
果酒中的酯类和醇类物质是最重要的风味化合物,酯类带来怡人的香气,适量醇类物质赋予果酒醇厚的口感,增加香气的协调性。如表3所示,皇冠梨酒中酯类主要以乙酸酯类为主,具有草莓味、香蕉味、梨等果香和甜花香味,在Sc组和Sc+Td组中分别占总酯类含量的73.9%和79.6%,主要为乙酸乙酯、乙酸己酯、乙酸异丁酯、乙酸异戊酯和乙酸苯乙酯,在混合发酵中均高于单菌发酵,说明Td发酵可以产生更多的酯类物质。
梨酒中的醇类物质除来源于果实外,更多是由发酵产生。两组发酵中的异戊醇、3-甲基-1-丁醇、苯乙醇含量较高,占醇类物质的90%以上。相比单菌发酵,混合发酵增加了β-香茅醇,同时2-甲基-1-丁醇、3-甲基-1-丁醇、苯乙醇4 种高级醇含量有明显提高,正丁醇、异戊醇、己醇、1-辛醇、芳樟醇含量下降,但醇类物质整体增多,尤其是醇类含量较高的3-甲基-1-丁醇、苯乙醇。
混合发酵梨酒的酸类挥发性物质质量浓度显著低于单菌发酵,这与前面有机酸的变化相一致。Sc+Td组梨酒中4-乙烯基愈创木酚含量高于Sc发酵,它具有独特的发酵香气,具有明显的辨识度,是多种酒类产品的重要风味物质[31]。
从风味化合物的组成和含量分析,Sc+Td发酵增加了皇冠梨酒整体风味丰度,说明非酿酒酵母Td的发酵改变了梨酒的风味谱系[32]。
3 结论
研究了Sc与Td混合发酵皇冠梨酒过程中酚类物质、抗氧化活性的变化及对梨酒风味化合物的影响。与Sc单酵母发酵相比,梨酒的总酸含量降低(尤其是苹果酸),但乳酸含量有增加,可以提高梨酒的乳香和果香[33];混合发酵梨酒中TP和TF含量略有增加,对DPPH自由基清除率有一定积极作用,单体酚中与DPPH自由基清除率呈强正相关的熊果苷、表儿茶素含量都有提高。挥发性风味化合物在混合发酵中更为丰富,尤其是具有多种果香味的乙酸酯类物质,有利于改善梨酒的平淡风味。

