基于MAPK/NF-κB 通路探究苦参碱对酒精性脂肪性肝炎大鼠的影响
黄 丹,周素芳,蔡 金,张淇华,王 毅,张泰魏
(1.贵州中医药大学第一附属医院中医经典科,贵州 贵阳 550001; 2.贵州中医药大学微生态研究中心,贵州 贵阳 550001)
酒精性脂肪性肝炎 (alcoholic fatty liver disease,AFLD) 是一种因长期大量饮酒引起的肝脏疾病,可能导致非常严重的健康问题,如肝硬化、肝癌等[1]。炎症、脂质沉积、肝细胞凋亡等因素促进了AFLD 的发展[2]。目前,限制饮酒仍然是最有效的治疗AFLD 的方法,而直接治疗AFLD 的有效药物很少[3]。因此,迫切需要开发新的有效药物来治疗AFLD。苦参碱是从苦参中提取的生物活性成分,其具有治疗慢性肝病、抗病毒、抗炎等作用,而不会引起明显的毒性或副作用[4]。已有研究报道,苦参碱可减轻肝组织病理损伤,进而对非酒精性脂肪性肝炎大鼠发挥保护作用[5]。而苦参碱对AFLD 大鼠炎症反应、脂质沉积、肝细胞凋亡的影响尚不明确。相关研究显示,抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK) /核转录因子κB (nuclear factor kappa B,NF-κB) 通路可改善非酒精性脂肪性肝炎大鼠炎症反应[6]。而苦参碱能否通过调控MAPK/NF-κB 通路抑制AFLD 大鼠炎症反应、脂质沉积、肝细胞凋亡尚不可知。因此,本研究主要探究苦参碱对AFLD 大鼠炎症反应、脂质沉积、肝细胞凋亡的影响以及其作用机制。
1 材料
1.1 动物 8 周龄雄性SD 大鼠144 只,体质量310 ~320 g,均购自第三军医大学实验动物中心[实验动物生产许可证号SCXK (渝) 2022-0002],饲养于贵州中医药大学实验中心动物房[实验动物使用许可证号SYXK (黔)2021-0005],且所有动物实验均获得贵州中医药大学动物实验伦理委员会批准(批准号20210003)。
1.2 试剂与药物 苦参碱(规格5 g,批号20220506)、TUNEL 细胞凋亡检测试剂盒(批号20220209) 购自北京伊塔生物科技有限公司; 强肝胶囊(批号20211213) 购自石家庄东方药业股份有限公司; MAPK 激动剂Anisomycin(批号20211125) 购自武汉博欧特生物科技有限公司。谷草转氨酶(aspartate transaminase,AST) (批号20221003)、谷丙转氨酶(glutamic pyruvic transaminase,ALT) (批号20220925) 检测试剂盒均购自上海晶抗生物工程有限公司;白细胞介素(interleukin,IL) -1β (批号20221114)、IL-6(批号20220306)、肿瘤坏死因子-α (tumor necrosis factor α,TNF-α) (批号20220806) ELISA 试剂盒均购自伊艾博(武汉) 科技股份有限公司; 油红O 溶液(批号20211228)购自浙江麦飞生物科技有限公司; 兔源一抗甲状腺激素反应基因(thyroid hormone response gene,THRSP)(批号ab156982)、BCL2 相关X 蛋白(BCL2-associated X protein,Bax)(批号ab32503)、应激活化蛋白激酶 (c-Jun Nterminal kinase,JNK) (批号ab112501)、细胞外调节蛋白激酶1/2 (extracellular regulated protein kinase 1/2,ERK1/2) (批号ab184699)、p38 (批号ab59461)、NF-κB p65(批号ab239882)、p-JNK (批号 ab131499)、p-ERK1/2(批号ab126445)、p-p38 (批号ab4822)、p-NF-κB p65(批号ab239882)、GAPDH (批号ab8245)、辣根过氧化物酶(HRP) 标记的羊抗兔二抗(批号ab289875) 均购自英国Abcam 公司。
2 方法
2.1 AFLD 大鼠模型的构建及分组 给予大鼠正常饮食8周,按照每天15 mL/kg 的剂量灌胃给予40% 乙醇,构建AFLD 模型[7]。按照随机数字表法将SD 大鼠随机分为对照组,模型组,苦参碱低、中、高剂量组,强肝胶囊组,Anisomycin 组,苦参碱+Anisomycin 组,每组18 只。除对照组大鼠给予正常饮食且灌胃等体积的生理盐水外,其余各组大鼠均构建AFLD 大鼠模型。建模成功后,苦参碱低、中、高剂量组和强肝胶囊组大鼠分别灌胃给予22.22、44.44、66.66 mg/kg 苦参碱[8]及0.35 g/kg 强肝胶囊[9],且腹腔注射等体积生理盐水; Anisomycin 组[10]大鼠腹腔注射10 μL 5 μmol/L Anisomycin,且灌胃给予等量生理盐水;苦参碱+Anisomycin 组大鼠灌胃66.66 mg/kg 苦参碱且腹腔注射10 μL 5 μmol/L Anisomycin; 对照组和模型组大鼠均灌胃等量生理盐水,且腹腔注射等体积生理盐水,每天1次,持续6 周。
2.2 标本收集 末次处理24 h 后,麻醉大鼠,腹主动脉取血,离心,血清用于AST、ALT、IL-1β、IL-6、TNF-α 水平的检测; 血清收集完毕后,2%戊巴比妥钠麻醉并处死大鼠,收集大鼠肝脏组织,将肝脏组织分为3 份(每份包含每组6 只大鼠的肝脏组织),一份固定于4%多聚甲醛中用于HE、TUNEL 染色,一份冻存于-80 ℃中用于蛋白表达的检测,一份制作冰冻切片用于油红O 染色。
2.3 血清AST、ALT、IL-1β、IL-6、TNF-α 水平检测 严格按照相关试剂盒说明书检测大鼠血清AST、ALT、IL-1β、IL-6、TNF-α 水平。
2.4 HE 染色观察大鼠肝组织病理变化 肝组织在4% 多聚甲醛中固定过夜后,脱水并包埋在石蜡中,将包埋的肝组织切成5 μm 的薄片,切片经脱石蜡、再水化后行HE 染色,于BX51 显微镜下观察肝脏组织病理变化。
2.5 油红O 染色观察大鼠肝脏脂质沉积情况 将制备的冷冻肝组织切片在丙二醇中室温孵育2 min,油红O 溶液染色5 min,在85%丙二醇水溶液中进行调色,漂洗2 次并用苏木精染色1 min,冲洗后,于BX51 显微镜下对染色的组织进行观察。通过Image Pro Plus 6.0 软件评估油红O 染色吸光度值。
2.6 TUNEL 染色检测大鼠肝组织凋亡情况 将肝组织切片与TUNEL 试剂在37 ℃下避光孵育1 h。洗涤后用DAPI染色,于荧光显微镜下对切片进行观察。
2.7 Western blot 法检测大鼠肝组织THRSP、Bax、p-p38、p-JNK、p-ERK1/2、p-NF-κB p65 蛋白表达 使用RIPA 缓冲液在冰上裂解肝组织30 min,提取总蛋白,BCA 法检测总蛋白浓度。将蛋白样本经SDS-PAGE 电泳后转至PVDF膜,将PVDF 膜与一抗THRSP、Bax、p-p38、p-JNK、p-ERK1/2、p-NF-κB p65、p38、JNK、ERK1/2、NF-κB p65、GAPDH 在4 ℃下孵育过夜,加入对应二抗在室温下孵育1 h。通过Image Lab 5.0 软件测量蛋白条带灰度值。
2.8 统计学分析 通过SPSS 22.0 软件进行处理,数据以(±s) 表示,多组间比较采用单因素方差分析,进一步组间两两差异比较采用SNK-q检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 苦参碱对AFLD 大鼠血清AST、ALT 水平的影响 表1 显示,与对照组比较,模型组大鼠血清AST、ALT 水平升高(P<0.05); 与模型组比较,苦参碱各剂量组和强肝胶囊组大鼠血清AST、ALT 水平降低(P<0.05),且苦参碱的作用呈剂量依赖性,Anisomycin 组大鼠血清AST、ALT 水平升高(P<0.05); 与苦参碱高剂量组比较,苦参碱+Anisomycin 组大鼠血清AST、ALT 水平升高 (P<0.05)。
表1 各组大鼠血清AST、ALT 水平比较(U/L,±s,n=18)
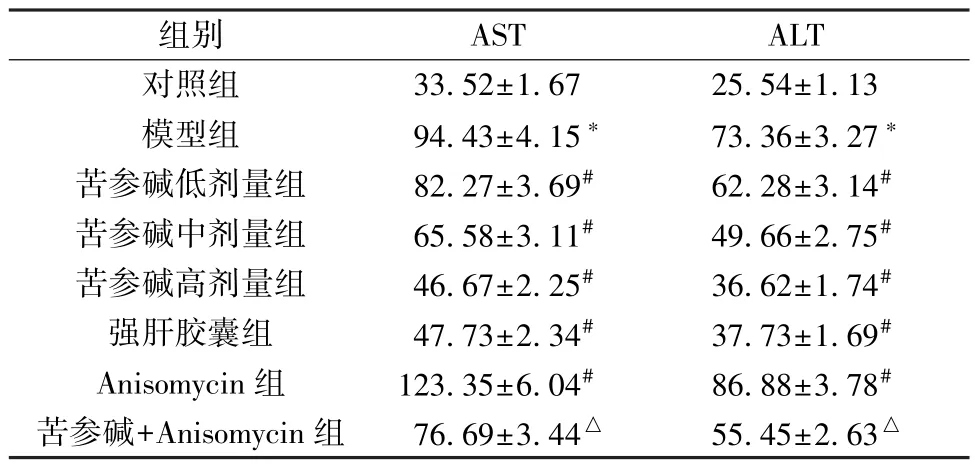
表1 各组大鼠血清AST、ALT 水平比较(U/L,±s,n=18)
注: 与对照组比较,*P<0.05; 与模型组比较,#P<0.05; 与苦参碱高剂量组比较,△P<0.05。
组别ASTALT对照组33.52±1.6725.54±1.13模型组94.43±4.15*73.36±3.27*苦参碱低剂量组82.27±3.69#62.28±3.14#苦参碱中剂量组65.58±3.11#49.66±2.75#苦参碱高剂量组46.67±2.25#36.62±1.74#强肝胶囊组47.73±2.34#37.73±1.69#Anisomycin 组123.35±6.04#86.88±3.78#苦参碱+Anisomycin 组76.69±3.44△55.45±2.63△
3.2 苦参碱对AFLD 大鼠血清IL-1β、IL-6、TNF-α 水平的影响 表2 显示,与对照组比较,模型组大鼠血清IL-1β、IL-6、TNF-α 水平升高(P<0.05); 与模型组比较,苦参碱各剂量组和强肝胶囊组大鼠血清IL-1β、IL-6、TNF-α 水平降低 (P<0.05),且苦参碱的作用呈剂量依赖性,Anisomycin 组大鼠血清IL-1β、IL-6、TNF-α 水平升高(P<0.05); 与苦参碱高剂量组比较,苦参碱+Anisomycin 组大鼠血清IL-1β、IL-6、TNF-α 水平升高(P<0.05)。
表2 各组大鼠血清IL-1β、IL-6、TNF-α 水平比较(pg/mL,±s,n=18)

表2 各组大鼠血清IL-1β、IL-6、TNF-α 水平比较(pg/mL,±s,n=18)
注: 与对照组比较,*P<0.05; 与模型组比较,#P<0.05; 与苦参碱高剂量组比较,△P<0.05。
组别IL-1βIL-6TNF-α对照组81.15±3.5442.27±1.7931.15±1.87模型组357.72±15.59*161.28±7.33*205.58±11.34*苦参碱低剂量组303.42±12.28#123.36±4.59#169.65±7.33#苦参碱中剂量组216.65±10.14#94.45±3.86#103.67±4.88#苦参碱高剂量组123.34±5.77#57.78±2.63#59.84±2.54#强肝胶囊组125.03±5.69#58.85±2.53#60.62±3.01#Anisomycin 组429.96±18.82#219.94±10.34#264.45±12.26#苦参碱+Anisomycin 组255.67±10.36△115.52±4.66△138.39±6.18△
3.3 苦参碱对AFLD 大鼠肝组织病理变化的影响 图1 显示,对照组肝脏结构正常,无病理征象; 模型组肝组织呈现明显的脂肪变性,主要表现为脂肪滴增多,肝细胞变大,且存在大量炎性细胞浸润; 与模型组比较,苦参碱各剂量组和强肝胶囊组肝组织脂肪变性程度有不同程度减轻,Anisomycin 组大鼠肝组织脂肪变性程度加重; 与苦参碱高剂量组比较,苦参碱+Anisomycin 组大鼠肝组织脂肪变性程度加重。
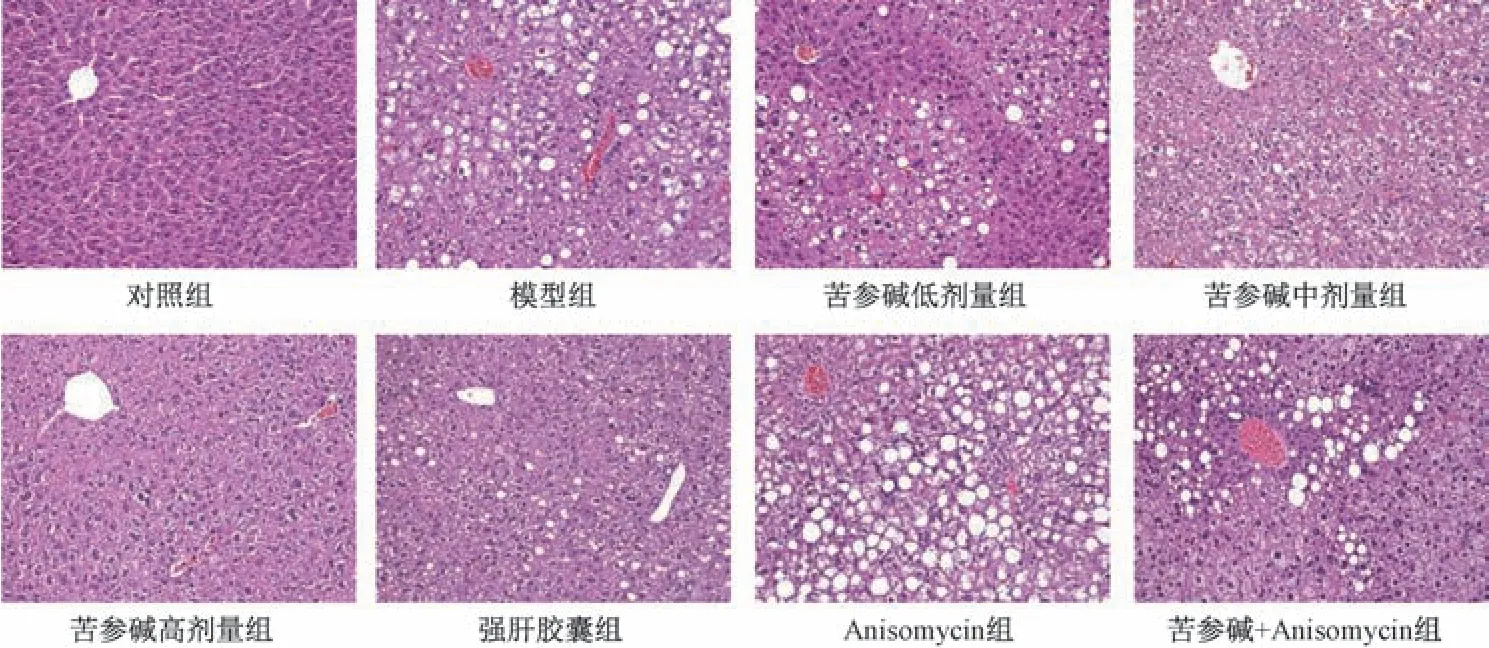
图1 各组大鼠肝组织HE 染色(×200)
3.4 苦参碱对AFLD 大鼠肝脏脂质沉积的影响 图2、表3显示,与对照组比较,模型组大鼠油红O 染色面积增加,吸光度值升高(P<0.05),表明肝组织脂质沉积加剧; 与模型组比较,苦参碱各剂量组和强肝胶囊组大鼠油红O 染色面积有不同程度减少,吸光度值降低(P<0.05),表明肝组织脂质沉积减轻,且苦参碱的作用呈剂量依赖性,Anisomycin 组大鼠油红O 染色面积增加,吸光度值升高(P<0.05); 与苦参碱高剂量组比较,苦参碱+Anisomycin组大鼠油红O 染色面积增加,吸光度值升高(P<0.05)。
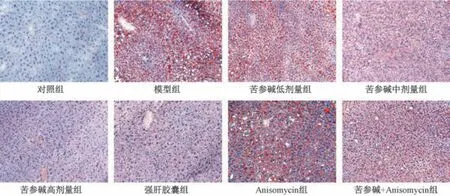
图2 大鼠肝组织油红O 染色(×200)
表3 各组大鼠油红O 染色吸光度值比较(±s,n=6)
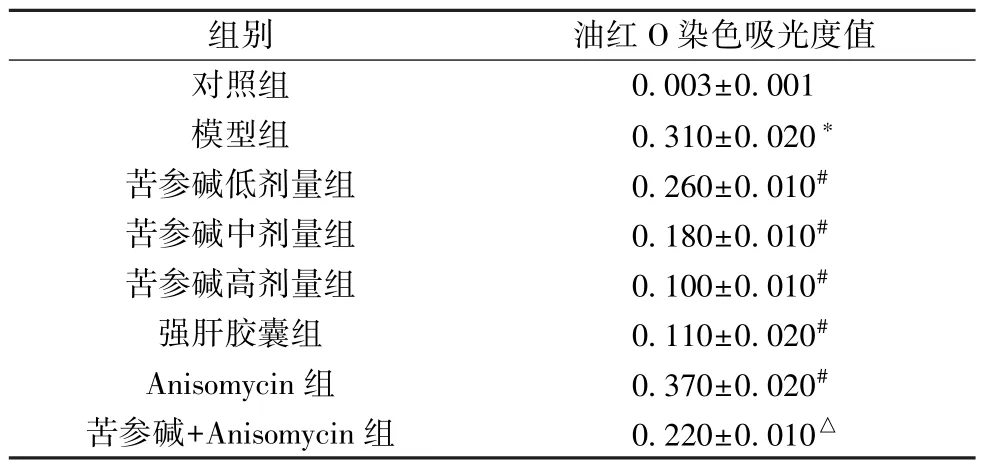
表3 各组大鼠油红O 染色吸光度值比较(±s,n=6)
注: 与对照组比较,*P<0.05; 与模型组比较,#P<0.05; 与苦参碱高剂量组比较,△P<0.05。
组别油红O 染色吸光度值对照组0.003±0.001模型组0.310±0.020*苦参碱低剂量组0.260±0.010#苦参碱中剂量组0.180±0.010#苦参碱高剂量组0.100±0.010#强肝胶囊组0.110±0.020#Anisomycin 组0.370±0.020#苦参碱+Anisomycin 组0.220±0.010△
3.5 苦参碱对AFLD 大鼠肝组织细胞凋亡的影响 图3、表4 显示,与对照组比较,模型组大鼠肝组织细胞凋亡率升高(P<0.05); 与模型组比较,苦参碱各剂量组和强肝胶囊组大鼠肝组织细胞凋亡率降低(P<0.05),且苦参碱的作用呈剂量依赖性,Anisomycin 组大鼠肝组织细胞凋亡率升高 (P<0.05); 与苦参碱高剂量组比较,苦参碱+Anisomycin 组大鼠肝组织细胞凋亡率升高(P<0.05)。

图3 大鼠肝组织细胞凋亡TUNEL 染色(×200)
表4 各组大鼠肝组织细胞凋亡率比较(±s,n=6)

表4 各组大鼠肝组织细胞凋亡率比较(±s,n=6)
注: 与对照组比较,*P<0.05; 与模型组比较,#P<0.05; 与苦参碱高剂量组比较,△P<0.05。
组别细胞凋亡率/%对照组3.25±0.12模型组20.53±0.54*苦参碱低剂量组16.64±0.62#苦参碱中剂量组11.45±0.53#苦参碱高剂量组6.72±0.31#强肝胶囊组6.79±0.28#Anisomycin 组27.72±1.24#苦参碱+Anisomycin 组13.35±0.53△
3.6 苦参碱对AFLD 大鼠肝组织THRSP、Bax 及MAPK/NF-κB 通路相关蛋白表达的影响 图4、表5 显示,与对照组比较,模型组大鼠肝组织THRSP、Bax、p-p38、p-JNK、p-ERK1/2、p-NF-κB p65 蛋白表达升高(P<0.05); 与模型组比较,苦参碱各剂量组和强肝胶囊组大鼠肝组织THRSP、Bax、p-p38、p-JNK、p-ERK1/2、p-NF-κB p65 蛋白表达降低(P<0.05),且苦参碱的作用呈剂量依赖性,Anisomycin组THRSP、Bax、p-p38、p-JNK、p-ERK1/2、p-NF-κB p65蛋白表达升高(P<0.05); 与苦参碱高剂量组比较,苦参碱+Anisomycin 组大鼠肝组织THRSP、Bax、p-p38、p-JNK、p-ERK1/2、p-NF-κB p65 蛋白表达升高(P<0.05)。

图4 各组大鼠肝组织THRSP、Bax、p-p38、p-JNK、p-ERK1/2、p-NF-κB p65 蛋白条带图
表5 各组大鼠肝组织THRSP、Bax 及MAPK/NF-κB 通路相关蛋白表达比较(±s,n=6)
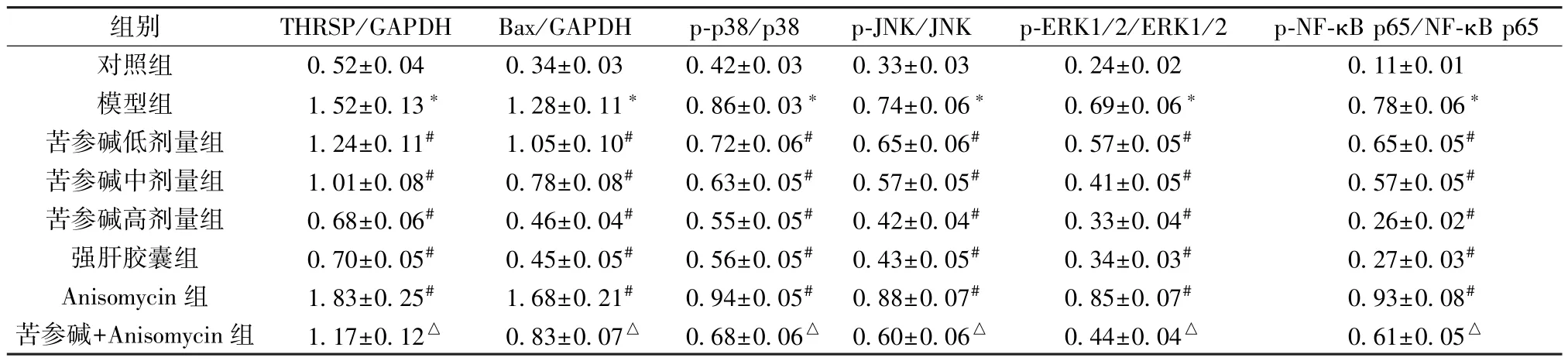
表5 各组大鼠肝组织THRSP、Bax 及MAPK/NF-κB 通路相关蛋白表达比较(±s,n=6)
注: 与对照组比较,*P<0.05; 与模型组比较,#P<0.05; 与苦参碱高剂量组比较,△P<0.05。
组别THRSP/GAPDHBax/GAPDHp-p38/p38p-JNK/JNKp-ERK1/2/ERK1/2p-NF-κB p65/NF-κB p65对照组0.52±0.040.34±0.030.42±0.030.33±0.030.24±0.020.11±0.01模型组1.52±0.13*1.28±0.11*0.86±0.03* 0.74±0.06*0.69±0.06*0.78±0.06*苦参碱低剂量组1.24±0.11#1.05±0.10#0.72±0.06#0.65±0.06#0.57±0.05#0.65±0.05#苦参碱中剂量组1.01±0.08#0.78±0.08#0.63±0.05#0.57±0.05#0.41±0.05#0.57±0.05#苦参碱高剂量组0.68±0.06#0.46±0.04#0.55±0.05#0.42±0.04#0.33±0.04#0.26±0.02#强肝胶囊组0.70±0.05#0.45±0.05#0.56±0.05#0.43±0.05#0.34±0.03#0.27±0.03#Anisomycin 组1.83±0.25#1.68±0.21#0.94±0.05#0.88±0.07#0.85±0.07#0.93±0.08#苦参碱+Anisomycin 组1.17±0.12△0.83±0.07△0.68±0.06△ 0.60±0.06△0.44±0.04△0.61±0.05△
4 讨论
过量饮酒会导致代谢紊乱、肝脏脂质沉积和炎症,最终导致AFLD 的发展[11]。AST、ALT 是目前最常用的肝功能检测指标,其升高的程度与肝细胞受损的程度成正比[12]; 酒精可引起促炎细胞因子IL-1β、IL-6、TNF-α 的分泌,进而加重肝损伤[13]; 饮酒会增加脂肪酸的摄取和脂肪生成,并减少脂肪酸氧化,从而导致肝脏脂质沉积,THRSP 是一种重要的脂肪生成基因,它调节脂肪细胞和肝脏中脂肪的生成,促进脂肪堆积[14-15]; 此外,肝细胞凋亡参与了AFLD 的进展,Bax 作为细胞凋亡相关标记物,具有促进细胞凋亡的作用[16-17]。本研究成功诱导建立AFLD 大鼠模型,结果显示,与对照组比较,模型组大鼠肝功能异常、存在炎症反应、脂质沉积及肝细胞大量凋亡等现象。提示开发能够抑制炎症反应、脂质沉积及肝细胞大量凋亡的药物可能是治疗AFLD 的有效策略之一。
苦参碱是一种天然存在的生物碱,是苦参和山豆根等中草药的生物活性成分,具有抗癌、抗炎、抗氧化、抗病毒、抗菌、抗纤维化、保肝等特性[18]。苦参碱注射液可以改善肝功能,进而对急性酒精性肝损伤小鼠发挥保护作用[19]; 苦参碱可抑制硫代乙酰胺诱导的大鼠肝纤维化,改善其肝功能[20]。本研究显示,苦参碱可改善AFLD 大鼠肝功能,抑制炎症反应、脂质沉积及肝细胞凋亡,且呈剂量依赖性。强肝胶囊是一种能够改善慢性肝炎的中成药,本研究以此作为阳性药物,结果显示苦参碱高剂量组与强肝胶囊组对应指标变化差异无统计学意义,提示苦参碱有可能成为治疗AFLD 的潜在有效药物。
MAPK 通路的激活涉及p38、ERK1/2 和JNK 的磷酸化。多项研究表明,MAPK 信号通路参与了NF-κB 的激活[21-22]。最新研究显示,抑制MAPK/NF-κB 通路可保护小鼠肝脏免受缺血/再灌注损伤[23]; 抑制MAPK/NF-κB 通路可改善对乙酰氨基酚诱导的小鼠急性肝损伤[24]。本研究显示,与模型组比较,Anisomycin 组MAPK/NF-κB 通路蛋白表达升高,大鼠炎症反应、脂质沉积、肝细胞凋亡及肝组织病理损伤加剧,表明MAPK/NF-κB 信号通路确实参与了AFLD 的进展。此外,本研究还发现,苦参碱可呈剂量依赖性地抑制p-p38、p-JNK、p-ERK1/2、p-NF-κB p65 蛋白表达,推测苦参碱可能通过抑制MAPK/NF-κB 信号通路抑制AFLD 大鼠炎症反应、脂质沉积及肝细胞凋亡。为了验证该推测,本研究在高剂量苦参碱作用的基础上给予MAPK 激动剂Anisomycin 干预AFLD 大鼠,结果显示Anisomycin 减弱了高剂量苦参碱对AFLD 大鼠炎症反应、脂质沉积及肝细胞凋亡的抑制作用。
综上所述,苦参碱可能通过抑制MAPK/NF-κB 信号通路抑制AFLD 大鼠炎症反应、脂质沉积及肝细胞凋亡。苦参碱对AFLD 大鼠的保护作用可能还涉及其他通路,本研究尚未探讨,这是本研究的不足之处,后期将会进一步深入探究。

