UPLC-Q-TOF-MS/MS法定性和HPLC法定量分析菟丝子饮片成分
欧余航,张 宽,周 菲,许榕倩,吴金栋
(1.福建中医药大学附属第三人民医院,福建 福州 350108;2.福建中医药大学附属第二人民医院,福建 福州 350003)
菟丝子为旋花科植物南方菟丝子Cuscuta australisR. Br.或菟丝子Cuscuta chinensisLam.的干燥成熟种子。菟丝子产地分布广泛,具有补益肝肾、固精缩尿、安胎等功效,目前临床常用于治疗头晕耳鸣、腰膝酸软、阳痿遗精、胎动不安等症状[1-2]。菟丝子中主要含有黄酮类、有机酸、多糖、生物碱和氨基酸等多种物质成分[3-4],其中黄酮、酚酸类等有效成分已证实具有抗衰老、抗氧化、保肝益肾增强免疫等作用[5-6]。
中药菟丝子来源广泛,质量参差不齐。《中华人民共和国药典》[1]以金丝桃苷(C21H20O12)含量不得少于干燥菟丝子样品0.1%作为菟丝子饮片含量测定的质控标准;有文献采用建立高效液相色谱(HPLC)指纹图谱法,对比样品与指纹图谱的相关性及差异性对菟丝子饮片质量进行评价[7],但对于其中主要成分鉴别及含量测定并未进行明确检测。本研究采用超高效液相色谱串联四极杆飞行时间质谱法(UPLC-Q-TOF-MS/MS)对菟丝子饮片中分离度高、含量较大的成分进行定性分析,并建立上述成分HPLC 含量测定方法,进一步为菟丝子饮片的评价与质量控制提供数据依据。
1 仪器与材料
1.1 仪器 1290 Infinity Ⅱ液相色谱仪(美国Agilent Technologies 公司)和micro TOF Ⅱ[布鲁克(北京)科技有限公司];戴安U3000 高效液相色谱仪[赛默飞世尔科技(中国)有限公司];AL04 型万分之一电子天平[梅特勒托利多科技(中国)有限公司];SB-5200DT 超声波提取器(宁波新芝生物科技股份有限公司)。
1.2 材料 菟丝子饮片购于安徽省万生中药饮片有限公司(产地:内蒙古),经福建中医药大学曾建伟副研究员鉴定为菟丝子Cuscuta chinensisLam.干燥成熟种子。对照品绿原酸(纯度96.1%)、异槲皮苷(纯度97.2%)、金丝桃苷(纯度94.7%)、咖啡酸(纯度99.7%)均购自中国食品药品检定研究院(批号:110753-202018、111809-201804、111521-201809、110885-201703);对照品紫云英苷(纯度98%,上海源叶生物科技有限公司,批号:B21704)。甲醇、乙腈、磷酸和甲酸均为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 色谱及质谱条件
2.1.1 HPLC 色谱条件 大连依利特SinoChrom ODS-BP C18色谱柱(4.6 mm×250 mm,5 µm);流动相:乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱:0~20 min,7%~12%A;20~50 min,12%~15%A;50~60 min,15%~17%A;60~70 min,17%~17%A;70~90 min,17%~20%A;90~100 min,20%~30%A;流速1 mL/min;紫外检测波长360 nm;柱温25 ℃;进样量10 µL。
2.1.2 UPLC-Q-TOF-MS/MS 条件 Acclaim UPLC RSLC 120 C18色谱柱(2.1 mm×100 mm,2.2 µm);流动相:乙腈(A)-0.01%甲酸水溶液(B),梯度洗脱:0~8 min,7%~7%A;8~20 min,7%~12%A;20~25 min,12%~15%A;25~30 min,15%~17%A;30~37 min,17%~20%A;37~42 min,20%~30%A;流速0.3 mL/min;进样量2 µL;柱温30 ℃。质谱条件:电喷雾离子源(ESI);扫描方式为正(+)、负(-)离子模式;气体流速10 L/min;源电压3.5 kV;气体流速10 L/min;喷雾干燥器温度350 ℃;压力30 psi;MSbreaking电压1.0 V;扫描范围100~1 500 U。
2.2 溶液制备
2.2.1 供试品溶液制备 菟丝子饮片粉碎,过四号筛,精密称取菟丝子饮片(批号:200501)0.5 g,置于三角锥形瓶中,精密量取70%甲醇溶液50 mL 置于锥形瓶中,密封称重后浸泡过夜,复称后用70%甲醇溶液补足重量,置超声提取器中超声30 min(功率250 W,频率50 kHz),置水浴锅上挥干溶剂,70%甲醇溶液复溶,溶液定容至5 mL量瓶。静置30 min,取上清液过0.22 µm 微孔滤膜,取续滤液,即得供试品溶液。
2.2.2 对照品贮备液制备 精密称取绿原酸、咖啡酸、异槲皮苷、金丝桃苷、紫云英苷对照品适量,分别置于量瓶中,加入适量甲醇超声溶解后,再加甲醇定容,分别配置成浓度为0.216 0、0.200 0、0.208 0、1.452 0、0.200 0 mg/mL 的绿原酸、咖啡酸、异槲皮苷、金丝桃苷、紫云英苷对照品贮备液,并置冰箱(2~8 ℃)保存。
2.2.3 混合对照品溶液制备 精密吸取“2.2.2”项下对照品贮备液:绿原酸500 µL、咖啡酸70 µL、异槲皮苷200 µL、金丝桃苷70 µL、紫云英苷300 µL,置同一量瓶,混合后配制成浓度分别为94.74、12.28、36.49、89.16、52.63 µg/mL 的绿原酸、咖啡酸、异槲皮苷、金丝桃苷、紫云英苷混合对照品溶液。
2.3 UPLC-Q-TOF-MS/MS 定性分析 按“2.2.1”项下方法制备供试品溶液,按“2.1.2”项下UPLCQ-TOF-MS/MS 条件进样检测,得到菟丝子饮片基准峰色谱图,见图1。对对照品、供试品溶液进行UPLC-Q-TOF-MS/MS 分析,将得到化合物的[M+H]+、[M-H]-与文献[8-11]中化合物进行信息比对,收集菟丝子饮片中所含化合物,汇总各化合物的名称、分子式、分子量及化合物结构式等信息,计算正、负离子模式下的常见离子形态的精确质荷比。最终从菟丝子饮片中鉴定出5 个主要成分,与对照品比对确认,经Mass calculator 验证,见表1。
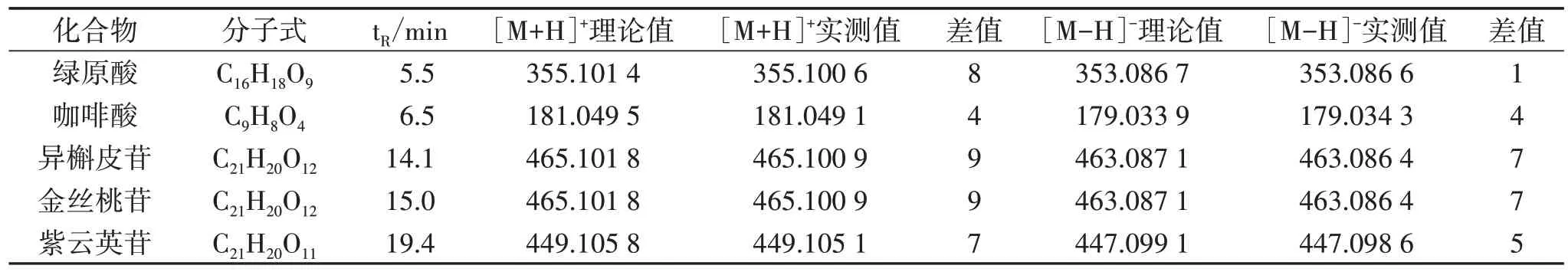
表1 菟丝子饮片UPLC-Q-TOF-MS/MS 质谱分析结果
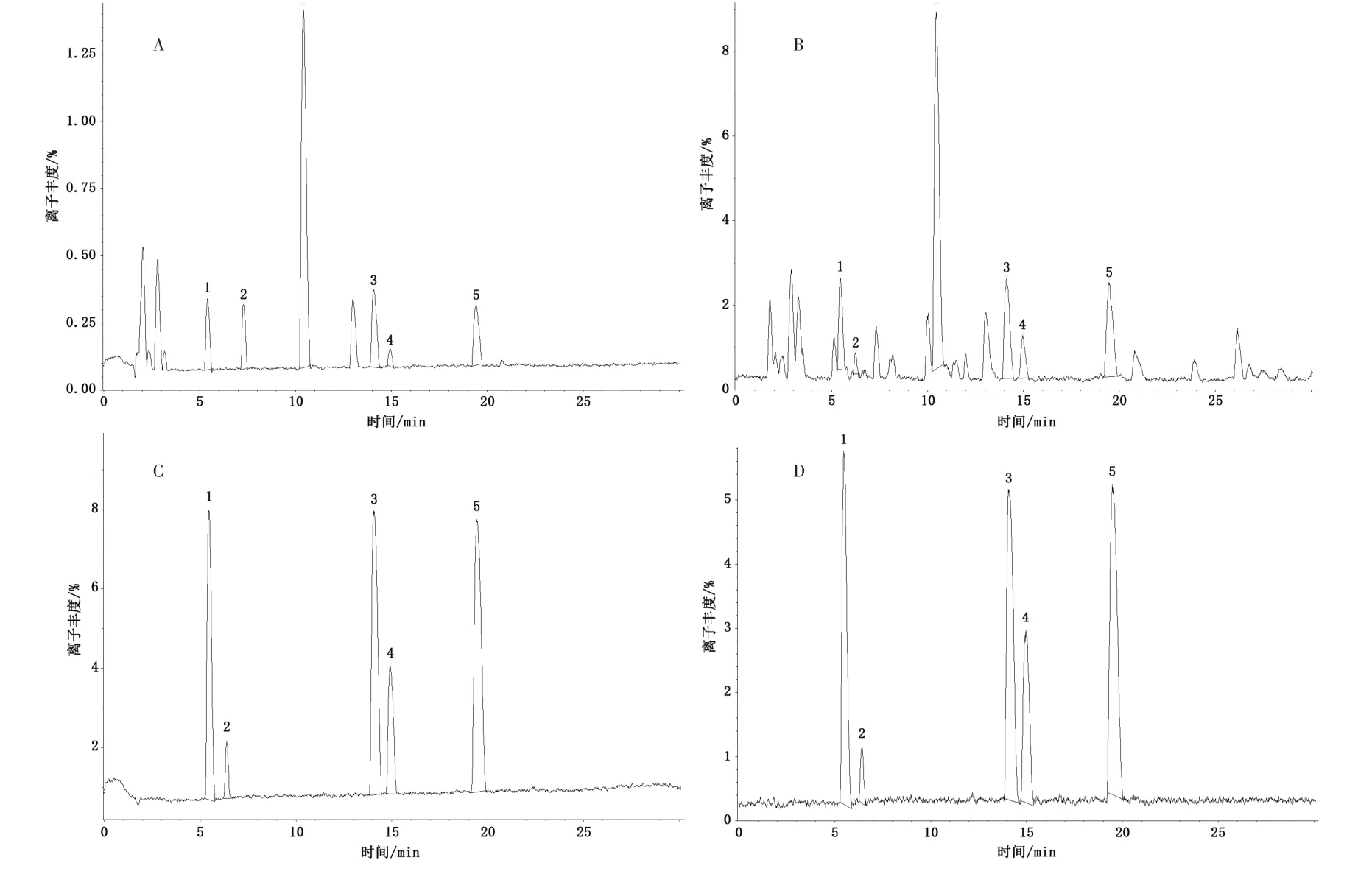
图1 菟丝子饮片基准峰色谱图
2.4 HPLC 定量分析
2.4.1 专属性试验 分别精密吸取空白溶剂、混合对照品溶液及供试品溶液,按“2.1.1”项下色谱条件进样分析,见图2。供试品溶液与对照品溶液色谱峰的保留时间一致,且空白溶剂在相应保留时间无干扰,表明该方法专属性良好。
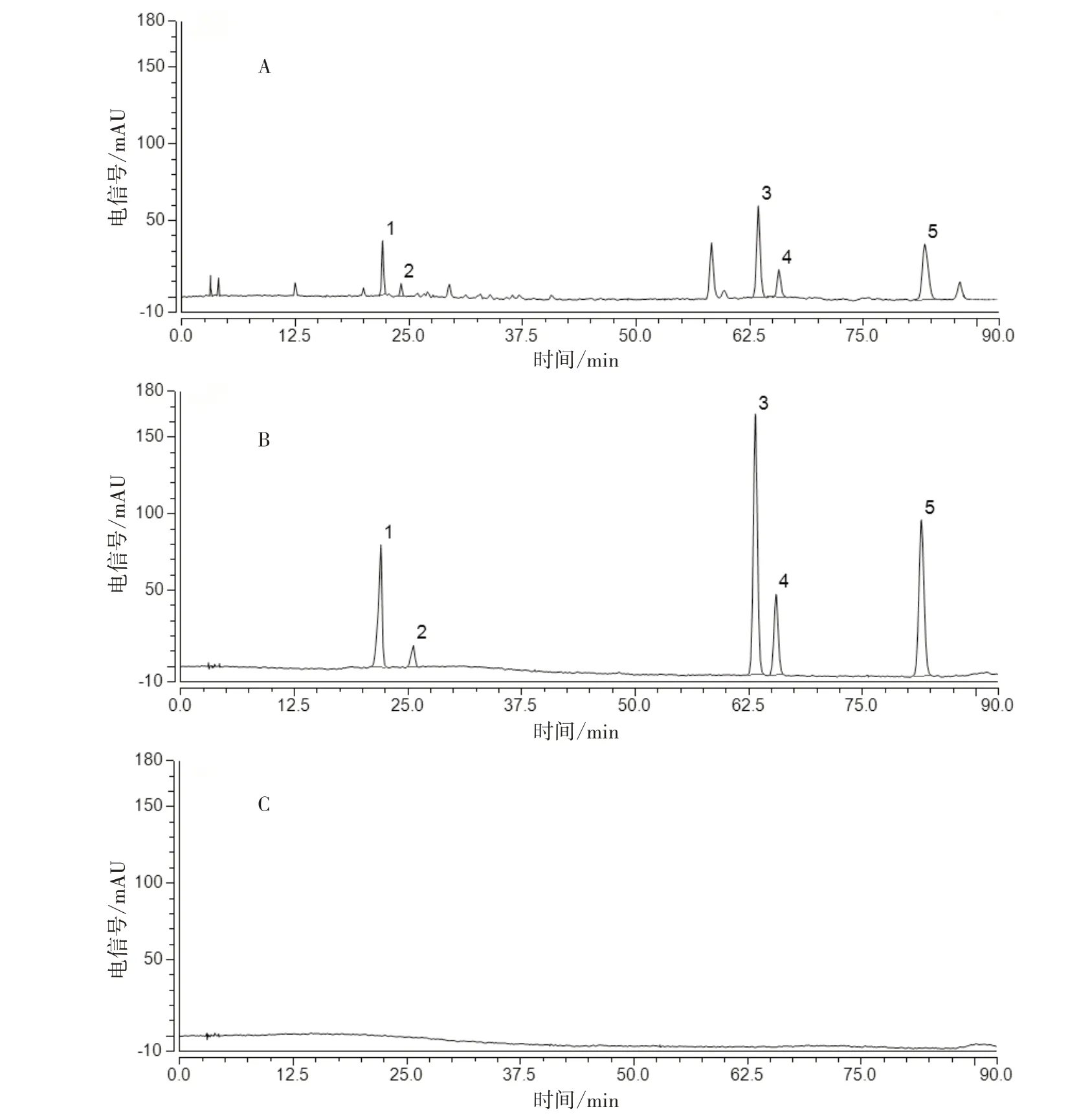
图2 菟丝子饮片HPLC 图谱
2.4.2 线性范围考察 分别精密吸取“2.2.3”项下混合对照品溶液各2.5、5、10、20、40 µL,按“2.1.1”项下色谱条件进样分析,测定峰面积。以进样浓度(µg/mL)为横坐标X,色谱峰面积(A)为纵坐标Y,结果如表2 所示。

表2 菟丝子5 个成分回归方程及线性范围
2.4.3 精密度试验 精密称定菟丝子饮片粉末(批号:200501)约0.5 g,按“2.2.1”项下方法制备供试品溶液,按“2.1.1”项下色谱条件进行测定,连续进样6 次。结果绿原酸、咖啡酸、异槲皮苷、金丝桃苷、紫云英苷的峰面积RSD 分别为0.74%、0.40%、0.49%、0.86%、0.76%,说明该色谱条件下仪器精密度良好。
2.4.4 稳定性试验 取“2.4.3”项下供试品溶液,分别于0、1、2、4、8、12、24 h 按“2.1.1”项下色谱条件进样测定。结果绿原酸、咖啡酸、异槲皮苷、金丝桃苷、紫云英苷的峰面积RSD 分别为0.79%、0.93%、0.77%、0.82%、0.75%,表明供试品溶液在24 h 内稳定性良好。
2.4.5 重复性试验 精密称取菟丝子饮片粉末(批号:200501)6 份(约0.5 g/份),按“2.2.1”项下制备供试品溶液,依次进样检测,计算样品中各组分含量。结果绿原酸、咖啡酸、异槲皮苷、金丝桃苷、紫云英苷的平均含量分别为0.691 3、0.061 4、0.528 5、1.107 3、0.629 9 mg/g,RSD 分别为0.49%、0.63%、1.04%、0.48%、0.53%,表明该方法的重复性良好。
2.4.6 加样回收率试验 精密称取菟丝子饮片粉末(批号:200501)6 份(0.5 g/份),分别精密加入与样品含量近似相等的混合对照品溶液,按“2.2.1”项下方法制备供试品溶液,最终用70%甲醇定容于10 mL 量瓶。按“2.1.1”项下色谱条件进样检测,计算各组分的加样回收率和RSD。见表3。
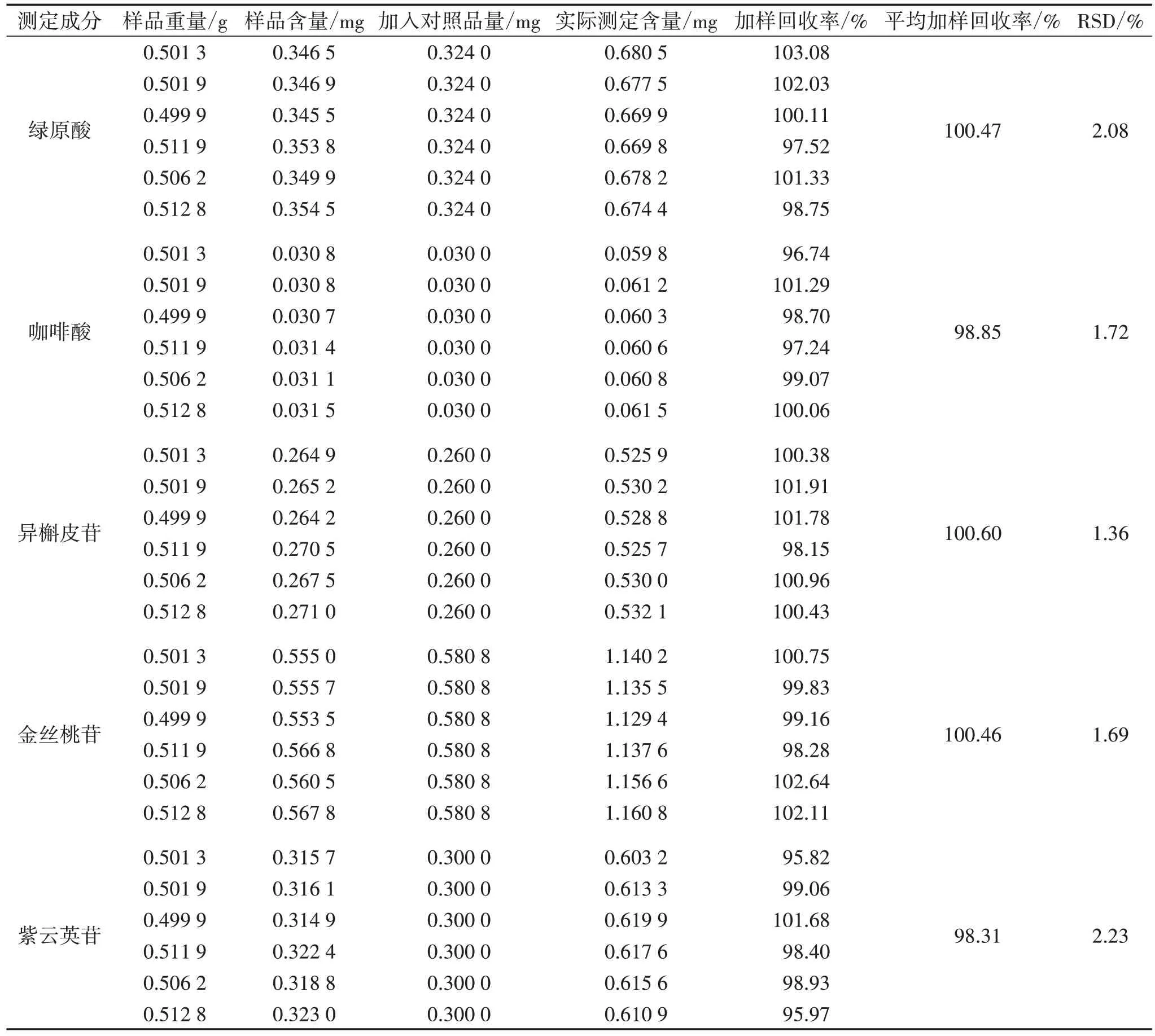
表3 加样回收试验结果
2.4.7 样品含量测定 取10个批次菟丝子饮片粉末(批号:200501、210401、210701、2003004、2007007、2011010、200901、200701、210601、201202),每个批次平行取样3 份,分别按“2.2.1”项下方法制备供试品溶液,取混合对照品溶液及供试品溶液各10 µL分别进样,测定峰面积,按外标法计算不同批次样品含量,各个批次样品间各成分的含量差异较大。见表4。
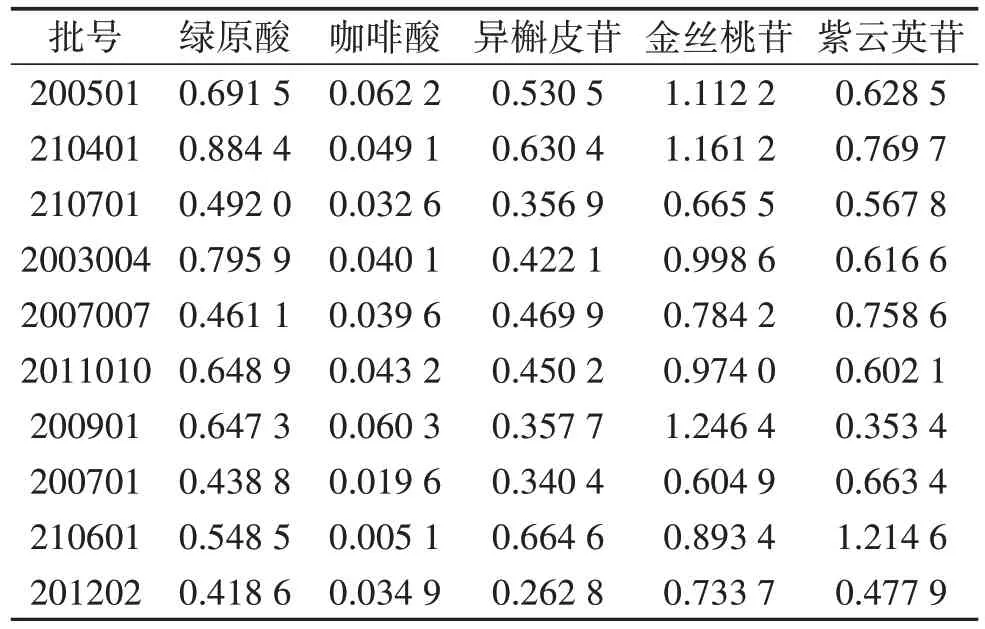
表4 10 批次菟丝子饮片5 个成分平均含量测定结果 mg/g
3 讨 论
中药成分复杂多样,有效成分难以全部明确,如何在成分不完全明确情况下对中药进行质量评价显得十分重要。目前研究对于菟丝子的成分分析,或通过HPLC 法比较保留时间一致性对成分进行定量测定[12];或通过质谱检测对菟丝子成分进行定性分析[13],但未建立定量方法。本文通过质谱对菟丝子饮片中化学成分进行分析,通过数据库、软件对化学成分精确分子量、保留时间、碎片离子峰等信息进行比对,从中选择含量较高且有文献报道明确药理活性的5 个化学成分,进一步通过对照品绿原酸、咖啡酸、异槲皮苷、金丝桃苷、紫云英苷对结果进行验证,保留时间、碎片离子峰等吻合,且通过质谱定性可排除保留时间相同但不同化学成分的干扰。在质谱基础上,再应用HPLC 法建立菟丝子饮片中5 个成分的含量测定方法,为研究菟丝子的药效物质基础提供依据。
本实验所测10 批样品的5 个成分含量,批次间差异较大,黄酮苷中金丝桃苷、紫云英苷含量最高与最低相差近1 倍;咖啡酸的含量波动变化最大。根据样品的含量测定结果,菟丝子饮片中黄酮苷的含量较大,又以金丝桃苷的含量最高。若以2020 版《中华人民共和国药典》作为评价标准,仅有3 份样品合格。但本研究旨在寻找一种可检测菟丝子饮片多种成分的快速、灵敏、准确方法,以期为菟丝子饮片质量控制提供更全面的评价,由于在流动相比例、检测波长及样品前处理等方面与《中华人民共和国药典》中的方法均有差异,因此不能简单将其结合本研究的检测结果作为直接评价样品是否合格的依据。
本研究采用UPLC-Q-TOF-MS 对菟丝子饮片中的成分进行定性分析,根据定性分析结果,建立了绿原酸、咖啡酸、异槲皮苷、金丝桃苷、紫云英苷5 个成分的HPLC 含量测定方法,并采用该方法对10 批样品进行定量检测,结果稳定可靠,重现性良好,可为进一步提高该药材的质量标准提供参考。

