医源性因素早发性卵巢功能不全家兔模型建立
闫 丽, 金格雅,2, 王恺悦, 王喜良, 于月新
1.北部战区总医院 生殖医学科,辽宁 沈阳 110016;2.中国医科大学研究生院,辽宁 沈阳 110122
早发性卵巢功能不全(premature ovarian insufficiency,POI)是指女性在40岁以前出现卵巢功能衰退,是女性不孕的主要原因之一[1]。POI患者促性腺激素水平升高(促卵泡生成素>25 U/L)、雌激素水平下降,主要表现为月经异常(稀发或闭经)[2],诱发更年期症状,如潮热、盗汗、失眠等,增加心血管疾病和骨密度降低的风险[3]。有研究表明,POI在我国的发病率约1%[4],其受到遗传、免疫、化疗等医源性因素、环境、心理因素的影响,发病率逐年增长且患病群体年轻化[5-6]。目前,POI发病机制还不明确,缺乏有效的治疗手段和药物,因此,找到安全且有效的治疗方案成为亟待解决的问题。建立动物模型是研究发病机制及治疗效果的常用方法,根据不同的发病机制,POI的动物模型制备方法主要有化学损伤药物造模法[7-8]、半乳糖代谢造模法[9]、基因敲除造模法等[10-11]。化疗损伤药物模型是研究POI的经典模型。化疗药物环磷酰胺造价低,可用于治疗恶性肿瘤、系统性红斑狼疮、肾病综合征等[5,12-13]。环磷酰胺通过促进卵巢颗粒细胞凋亡并对不同发育阶段的卵泡造成损伤,使卵泡发育受阻,引起性激素水平变化,进而导致卵巢功能障碍[14]。本研究通过比较不同剂量的环磷酰胺对新西兰白兔卵巢功能的影响,探究建立化疗损伤性POI家兔模型的最佳给药方案,以期为临床研究提供一种安全、可靠的模型构建方案。现报道如下。
1 材料与方法
1.1 实验动物 普通级雌性未交配新西兰白兔32只,5月龄,体质量2.7~2.9 kg,由青岛康大生物科技有限公司提供[ SCXK(鲁)2020-0003],饲养于北部战区总医院实验动物部,给予全价营养饲料,保持室温在20℃~24℃,相对湿度在45%~50%,模拟正常昼夜生理节律,每天光照12 h,自由饮水和进食。所有动物实验均按照本院实验中心的规范要求,符合动物伦理委员会指导原则(伦理批号第2020-08号)。
1.2 主要试剂及设备 注射用环磷酰胺购自德国Baxter Oncology GmbH公司(注册证号H20160467),0.2 g/瓶,注射前用生理盐水配成40 mg/ml新鲜水溶液备用;兔雌二醇酶联免疫检测试剂盒、兔促卵泡生成素酶联免疫检测试剂盒均购自上海江莱生物(货号JL22071、JL22073);乌拉坦购自上海麦克林生化科技有限公司(货号U820333);蛋白提取试剂盒Protein Ext Mammalian Total Protein Extraction Kit购自全式金公司(货号DE101-01);BCA蛋白定量试剂盒购自天根公司(货号PA115);Bax、Bcl2、Tubulin蛋白抗体均购自Proteintech公司(货号50599-2-lg、12789-1-AP、11224-1-AP);Goat HRP anti-Mouse购自invitrogen公司(货号31460);BY-600A型离心机购自北京白洋医疗器械有限公司;Leica RM225切片机、Leica EG1150包埋机均购自德国Leica Biosysterms Nussloch GmbH公司;BX51显微镜购自日本Olympus公司;聚丙烯酰胺凝胶电泳槽购自日本Bio-craft(货号BE-230);半干转膜仪购自美国Bio-Rad。
1.3 动物分组及实验干预 根据临床上环磷酰胺化疗的用药方案,分为小剂量持续治疗组和大剂量冲击治疗组,适应性喂养1周后,采用随机数字表法将32只新西兰兔分成4组,每组各8只。A组为正常对照组;B组50 mg/kg腹腔注射环磷酰胺1 d,8 mg/kg连续注射14 d;C组50 mg/kg连续腹腔注射环磷酰胺3 d;D组100 mg/kg连续腹腔注射环磷酰胺3 d。模型组家兔雌二醇水平降低、促卵泡生成素升高且与正常对照组比较,差异有统计学意义(P<0.05),卵巢卵泡数目显著减少表明POI模型构建成功。
1.4 动物取材及处理 各组家兔造模3周后,耳缘静脉取血,收集于5 ml采血管中。随后经耳缘静脉注射过量20%乌拉坦溶液致兔安乐死,取家兔双侧卵巢,一侧卵巢置于冻存管中,置于-80℃冰箱冻存,另一侧卵巢放入10%中性甲醛溶液中固定至少24 h。血液标本室温下静置2 h后,3 000 r/min离心10 min,将上层血清分装至1.5 ml离心管,每管300 μl,置于-80℃冰箱保存。
1.5 家兔体质量及卵巢指数 造模开始后,观察家兔的活动情况、进食量及兔毛脱落情况。每周对家兔进行称重并记录,造模结束后,取两侧卵巢,小心剥离多余脂肪组织,测量卵巢长径并用电子天平称湿重,计算卵巢指数。
卵巢指数=(卵巢湿重/体质量)×100%
1.6 卵巢组织学形态及卵泡数目 卵巢组织经10%中性甲醛溶液固定后,进行石蜡包埋,切成4 μm切片,HE染色后,在光镜下观察卵巢组织形态,计数各级卵泡[4],计算闭锁卵泡/卵泡总数的比值(闭锁卵泡占比)。原始卵泡定义为卵母细胞被一层鳞状颗粒细胞包围;初级卵泡的卵母细胞被一层立方颗粒细胞包围;次级卵泡由一层以上的立方颗粒细胞包围,尚未形成囊腔;早期的窦卵泡开始出现囊腔,排卵前的窦卵泡出现明显的层级云颗粒细胞层;闭锁卵泡的卵母细胞萎缩,形态不规则,透明带深染。各级卵泡分类见图1。
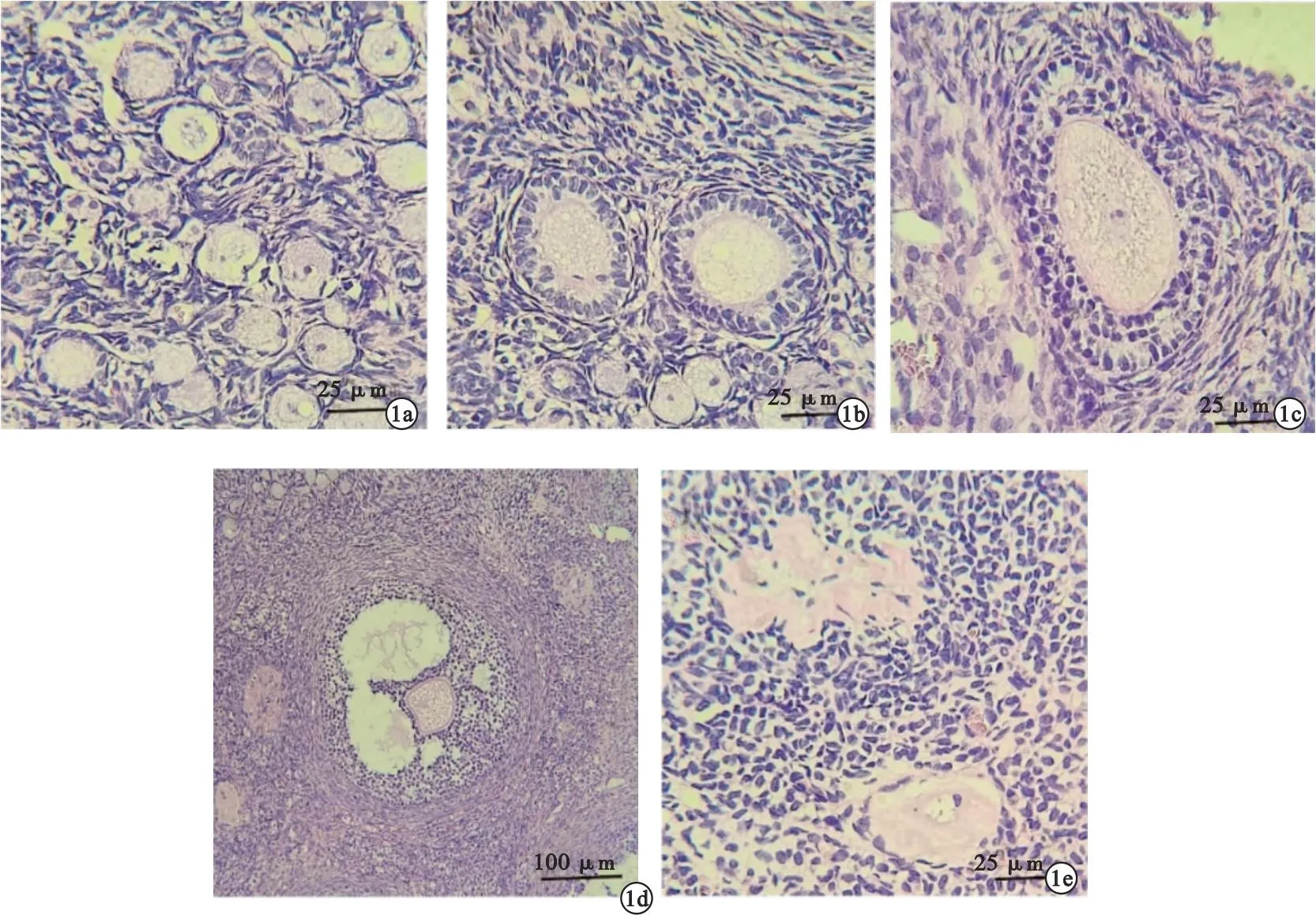
图1 各级卵泡分类(a.原始卵泡;b.初级卵泡;c.次级卵泡;d.窦卵泡;e.闭锁卵泡)
1.7 血清激素水平检测 血清样本采用酶联免疫吸附实验法检测促卵泡生成素、雌二醇的水平,按照试剂盒说明书操作。(1)标准品的稀释。(2)加样:分别设置空白孔、标准孔、待测样品孔。加样体积为50 μl,样品使用样品稀释液稀释5倍加样。(3)每孔加入50 μl Biotin-抗体工作液。(4)37℃温浴1 h后洗涤。(5)加酶:每孔加入100 μl酶结合物工作液,37℃温浴30 min后洗涤。(6)显色:加入底物(TMB)90 μl,37℃避光温浴30 min。(7)终止:每孔加入50 μl终止液。(8)在450 nm波长处测各孔的吸光度值。
1.8 卵巢组织蛋白检测 按照试剂盒说明书,提取卵巢组织中的Bax和Bcl2蛋白[5]并进行免疫印迹分析。具体步骤如下:冻存组织取出后,加入1 ml组织裂解液,使用匀浆器快速研磨使其裂解,随后进行蛋白定量,通过SDS-PAGE凝胶电泳分离蛋白,半干转的方式转至PVDF膜,5%牛奶室温封闭1 h,孵育一抗4℃过夜,TBST洗涤3次,每次10 min,孵育二抗室温1 h,TBST洗涤3次,每次10 min,ECL化学发光液进行显影并分析结果。
2 结果
2.1 4组家兔状态比较 除A组外,给药3 d后,剩余3组家兔均出现不同程度脱毛;B组兔毛枯燥暗淡,少量脱落,进食未受影响;C组和D组家兔精神萎靡,进食减少,面部毛发脱落严重,C组在建模2周后有所恢复,D组内有2只家兔在给药5 d后死亡。
2.2 4组家兔体质量比较 造模前,A、B、C、D组家兔体质量比较,差异均无统计学意义(P>0.05);经腹腔注射环磷酰胺造模3周后,C组和D组家兔体质量均低于A组,差异有统计学意义(P<0.05)。见表1。
表1 4组家兔体质量比较
2.3 4组家兔卵巢长径及卵巢指数比较 经腹腔注射环磷酰胺造模3周后,C组和D组家兔卵巢长径均短于A组,卵巢指数均小于A组,差异有统计学意义(P<0.05)。见表2。
表2 4组家兔卵巢长径和卵巢指数比较
2.4 4组家兔各级卵泡计数及闭锁卵泡占比比较 A组卵巢卵泡数量多,各级卵泡颗粒细胞排列规则,多为生长卵泡,闭锁卵泡数量少;B组原始和初级卵泡数量少于A组(P<0.05),窦卵泡形态不规则,闭锁卵泡数量多于A组(P<0.05);C组、D组卵泡总数减少,原始卵泡、初级卵泡、次级卵泡、窦卵泡数量少于A组(P<0.05),次级卵泡的颗粒细胞排列杂乱,窦卵泡形态不规则,异常卵泡增多,闭锁卵泡数量多于A组(P<0.05)。C组和D组闭锁卵泡占比高于A组,差异有统计学意义(P<0.05)。见表3。
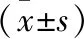
表3 4组家兔各级卵泡计数和闭锁卵泡占比比较
2.5 4组家兔血清雌二醇及促卵泡生成素水平比较 经腹腔注射环磷酰胺造模3周后,C组和D组雌二醇水平低于A组,促卵泡生成素水平高于A组,差异有统计学意义(P<0.05)。见表4。
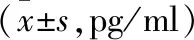
表4 4组家兔血清雌二醇和促卵泡生成素水平比较
2.6 4组家兔卵巢组织Bax及Bcl2蛋白表达水平比较 与A组比较,B、C、D组Bax蛋白表达上调(P<0.05),Bcl2蛋白表达下调(P<0.05)。见图2。
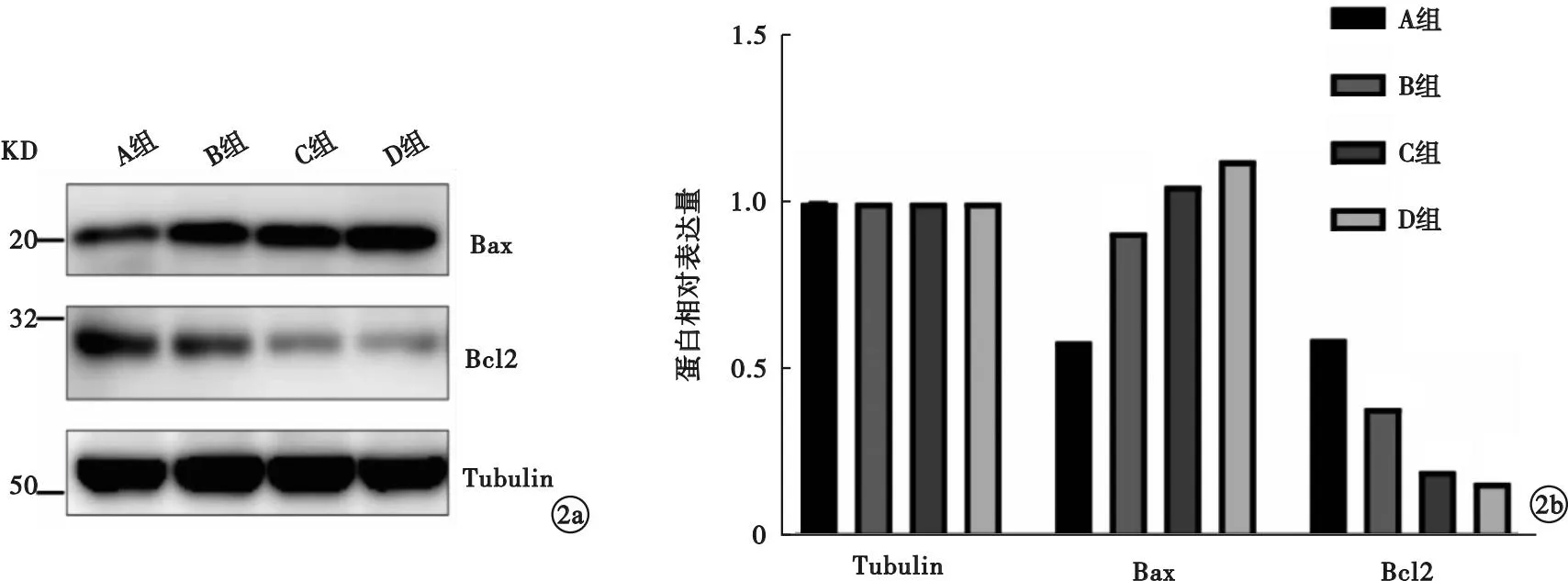
图2 4组家兔卵巢组织Bax和Bcl2蛋白表达水平比较
3 讨论
卵巢功能衰退是一种常见的妇科内分泌疾病,常引起原发或继发不孕、低雌激素症状,如潮热、多汗、性欲减退等,不仅会引起女性生殖内分泌功能障碍,还严重影响育龄妇女的身心健康和生活质量[15]。POI是卵巢早衰的早期阶段,如果在卵巢损伤更严重之前实施有效的治疗措施,能够避免或延缓卵巢早衰的发生。
建立稳定的动物模型是治疗研究的重要前提,目前,实验研究采用各种方法造模。有学者发现,切除新生小鼠的胸腺后,绝大多数的小鼠出现自身免疫性卵巢炎症及卵巢早衰[16]。在使用D-半乳糖建立卵巢早衰模型时,小鼠动情周期出现紊乱,卵泡减少,与临床患者卵泡丢失、闭锁、不排卵症状相符[9]。有研究表明,敲除小鼠PTEN基因后,小鼠原始卵泡减少,促卵泡生成素激素水平升高[10]。有研究通过腹腔注射环磷酰胺建立POI大鼠模型,单次注射50 mg/kg后、每天8 mg/kg连续注射8 d得到了理想模型,大鼠卵巢功能明显衰退,卵巢组织学及内分泌变化均最接近临床卵巢早衰患者[17]。
大多数研究选用大鼠或小鼠建立动物模型,本研究使用新西兰白兔模拟化疗药物损伤卵巢模型,因为家兔卵巢组织更大,各级卵泡数量更多,卵母细胞更接近人类的大小。耳缘静脉采血方便,对动物损伤小,符合动物伦理学要求,还可进行不同时间点激素水平的监测。本研究通过3种不同的给药剂量建立POI模型,相较于A组,B组家兔原始和初级卵泡数量减少,闭锁卵泡数量增多,但体质量、卵巢长径、卵巢指数、激素水平、各级卵泡数量变化差异无统计学意义,表明这种给药剂量对家兔整体影响较小,对卵巢的破坏较轻,无法用于建模。C组兔毛部分脱落,体质量下降较为平稳,卵巢受损严重,卵巢指数、卵泡数量、雌二醇和促卵泡生成素激素水平与A组比较差异明显,更加符合POI的自然变化情况,更适宜建立POI模型。D组家兔卵巢受损情况严重,虽然激素水平、卵泡数量与A组具有显著差异,但家兔状态较差,进食量少,兔毛脱落严重,耐受性差,不适合用于造模进行后续研究。
综上所述,50 mg/kg连续腹腔注射环磷酰胺3 d是建立化疗损伤性POI家兔模型的最佳浓度,该方法简便易行,卵巢损伤较稳定,动物耐受性好,能够用于评估POI不同治疗方案的预后效果,为临床研究提供理论支持。

