起病于儿童期1型、2型糖尿病相关基因特征及关键途径鉴别比较
高 伟, 梁琳琅, 于 浩, 宋 威, 陈若然, 乔 冰
北部战区总医院 1.内分泌科;2.心血管内科,辽宁 沈阳 110016
近年来,儿童、青少年糖尿病(diabetes mellitus,DM)的发病率逐年增长。2015年,约有193 000例年龄<20岁的患者被诊断患有糖尿病[1-2]。1型糖尿病(type 1 diabetes mellitus,T1DM)被称为胰岛素依赖型DM和青少年发病型DM[3]。其特征是胰腺β细胞产生的胰岛素不足或缺乏,可能是由β细胞的破坏导致的。2型糖尿病(type 2 diabetes mellitus,T2DM)的特征是胰岛素抵抗,胰腺β细胞仍然产生胰岛素,但细胞对胰岛素产生抗性,不能利用循环葡萄糖[4-5]。儿童和青少年中未确诊的DM可导致医疗急症,如糖尿病酮症酸中毒、严重低血糖、昏迷,甚至死亡[6],起病机制目前尚不清楚。本研究针对不同数据集进行挖掘,以寻找儿童期DM发病的关键基因和信号途径,为早期筛查发现DM和探寻治疗靶点提供依据。现报道如下。
1 材料与方法
1.1 数据来源 下载GEO数据库(https://www.ncbi.nlm.nih.gov/geo)中DM数据集:儿童GSE9006和成人GSE7014。GSE9006选取GPL96平台,健康对照24例,T1DM样本43例,从其中20例T1DM患者中获得了1个月和4个月的随访样本;T2DM样本12例。GSE7014中,健康对照6例,T1DM 10例,T2DM 20例。
1.2 研究方法
1.2.1 差异基因筛选 差异基因筛选采用limma、GEOquery和Biobase等R包,令DM与健康对照组织的数据相比对,筛选校正后P<0.05,并且上调表达基因log2FC>1.0,下调表达基因log2FC<-1.0。
1.2.2 GO分析及KEGG分析 GO分析和KEGG分析由DAVID数据库(https://david.ncifcrf.gov/tools.jsp)筛选得到,利用R中的ggplot2包绘图。
1.2.3 蛋白质互作网络构建 将鉴别出的差异基因输入STRING数据库(https://string-db.org)构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,随后利用Cytoscape 3.8.2软件进行网络分析并实现PPI网络图可视化。
1.2.4 核心网络及hub基因筛选 利用MCODE插件对PPI网络提取核心网络,依据网络规模设定degree和k-core值。选取核心网络中自由度最大者为hub基因。
2 结果
2.1 差异基因筛选 儿童T1DM刚确诊时筛出差异基因25个,其中,表达上调2个,下调23个;确诊1个月时,筛出差异基因25个,其中,表达上调12个,下调13个;确诊4个月时,筛出差异基因46个,其中,表达上调27个,下调19个。儿童T1DM共筛选出差异基因88个,其中,表达上调36个,下调52个。儿童T2DM筛选出差异基因68个,其中,表达上调33个,下调35个。成人T1DM筛选出差异基因972个,其中,表达上调207个,下调765个。成人T2DM筛选出差异基因1 267个,其中,表达上调305个,下调962个。见图1。
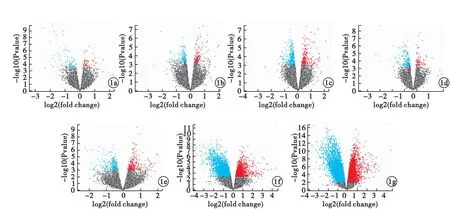
图1 差异表达基因火山图(a.GSE9006-T1DM-刚确诊时;b.GSE9006-T1DM-确诊1个月时;c.GSE9006-T1DM-确诊4个月时;d.GSE9006-T1DM;e.GSE9006-T2DM;f.GSE7014-T1DM;g.GSE7014-T2DM)
2.2 差异基因比较 1型间差异基因比较:儿童DM刚确诊与确诊1个月时比较,共有差异表达基因1个,EGR2。确诊1个月与确诊4个月时比较,共有差异表达基因7个,分别是EGR2、HLA-DRB6、DDIT4、KLF10、SIK1、JUN和CD69。儿童期与成人期比较,共有差异表达基因9个,分别是ESR1、DDIT4、FAM46C、SIK1、NFIB、SPTBN1、LBP、SERPINA3和MAFF。
2型间差异基因比较:儿童DM与成人DM比较,共有差异基因7个,分别为PTPRD、NAMPT、SGK1、CYP1B1、PLXNC1、MAF和SPTBN1。
1、2型间差异基因比较:儿童期共有差异基因19个,成人期共有差异基因773个。
2.3 差异基因的GO功能富集分析及KEGG通路分析 儿童T1DM和T2DM共同的GO分子功能富集在:RNA聚合酶Ⅱ启动子转录的正向调节;炎症反应;免疫应答。儿童T1DM特有的GO功能:信号转导;RNA聚合酶Ⅱ启动子转录负调控;G蛋白偶联受体信号通路。儿童T2DM型特有的GO功能:细胞黏附;血管生成;蛋白质磷酸化。见图2a、b。
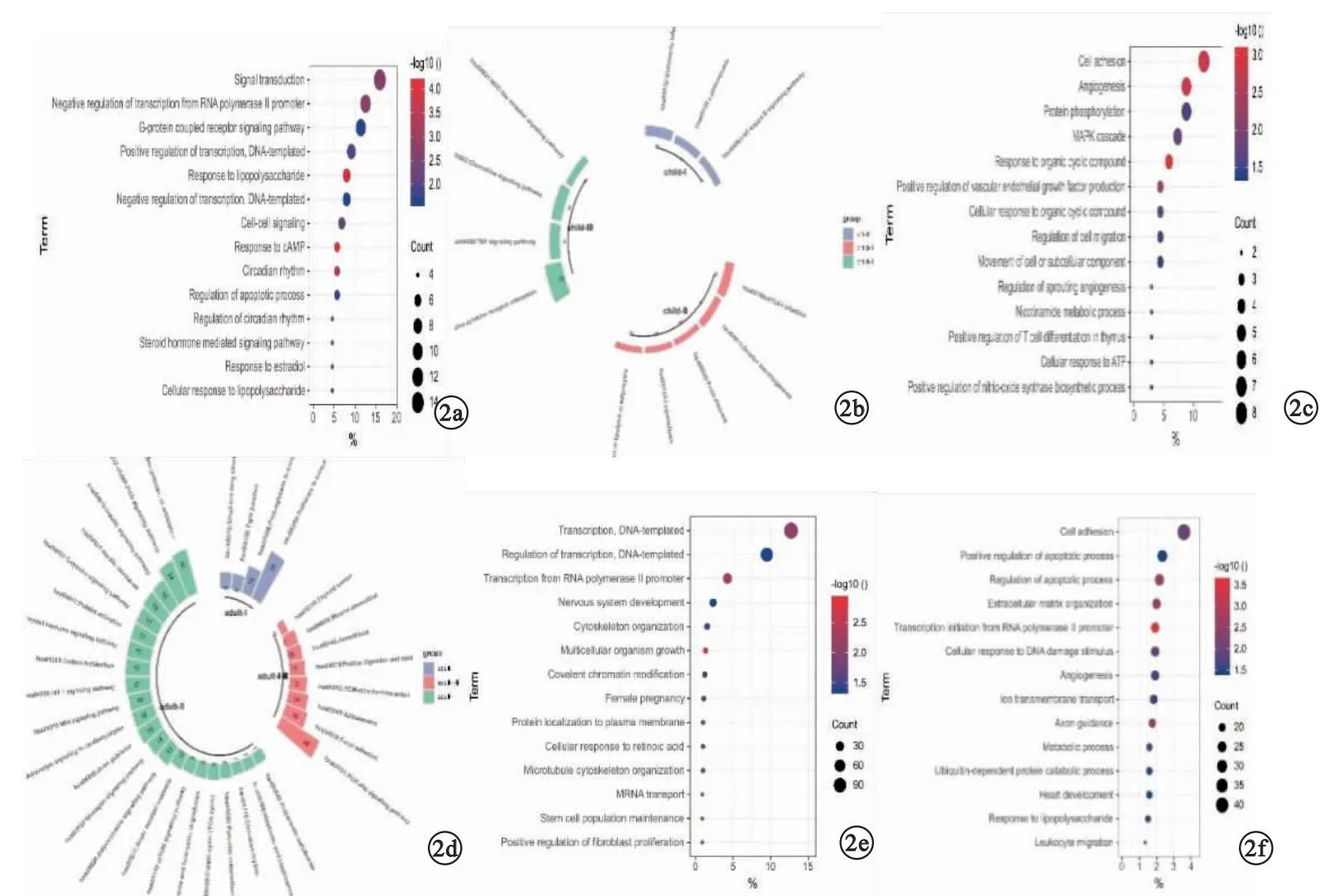
图2 差异基因的GO功能富集分析及KEGG通路分析(a.儿童期T1DM特有GO功能富集;b.儿童期T2DM特有GO功能富集;c.儿童期KEGG分析;d.成人期T1DM特有GO功能富集;e.成人期T2DM特有GO功能富集;f.成人期KEGG分析)
儿童T1DM和T2DM共同的KEGG信号通路为:细胞因子-细胞因子受体相互作用;TNF信号通路;趋化因子信号通路。儿童T1DM特有的KEGG通路为:沙门氏菌感染;NF-κb信号通路。儿童T2DM特有的KEGG信号通路为:HTLV-1感染;类固醇生成;脂肪细胞脂肪分解的调节。见图2c。
成人T1DM和T2DM共同GO分子功能富集在:RNA聚合酶Ⅱ启动子转录的正、负向调节;凋亡过程。成人T1DM特有GO功能富集在:DNA为模板的转录及调控;RNA聚合酶Ⅱ启动子转录;神经系统发育。成人T2DM特有GO功能主要富集在:细胞黏附;凋亡的调控;细胞外基质。见图2d、e。
成人T1DM和T2DM共同的KEGG信号通路为:PI3K-Akt信号通路;黏附;剪接体;细胞外基质-受体相互作用等。成人T1DM特有的KEGG信号通路为:癌症信号通路;癌症中蛋白聚糖。成人T2DM特有的KEGG信号通路为:抗生素的生物合成;cGMP-PKG信号通路;胰岛素信号通路。见图2f。
2.4 PPI网络构建及核心网络hub基因筛选 儿童T1DM网络有56个节点,131条边,取子网络后有11个节点,排除与T2DM共有的基因后,自由度最大的基因为趋化因子配体1(chemokine C-X-C motif ligand 1,CXCL1)。儿童T2DM网络有33个节点,59条边,取子网络后有6个节点,排除与T1DM共有的基因后,自由度最大的基因为趋化因子2(chemokine C-C motif ligand 2,CCL2)。成人T1DM网络有804个节点,3 246条边,degree≥25且k-core≥15取核心子网络。成人T2DM网络有1 104个节点,6 320条边,degree≥25且k-core≥15取核心子网络。见图3。
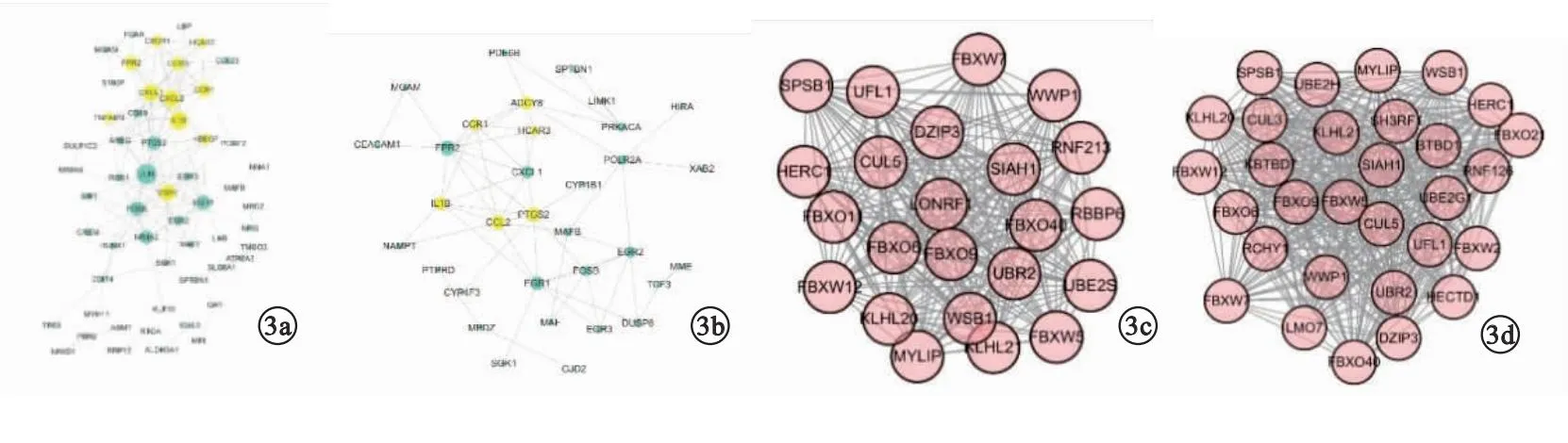
图3 PPI网络构建及核心网络筛选(a.GSE9006-T1DM;b.GSE9006-T2DM;c.GSE7014-T1DM;d.GSE7014-T2DM)
2.5 hub基因预测的受试者工作特征曲线 儿童期T1DM和T2DM的hub基因CXCL1和CCL2的受试者工作特征(receiver operating characteristic,ROC)曲线显示两者分别对儿童期T1DM和T2DM有良好的预测和诊断能力,曲线下面积分别为0.85、0.77。见图4。
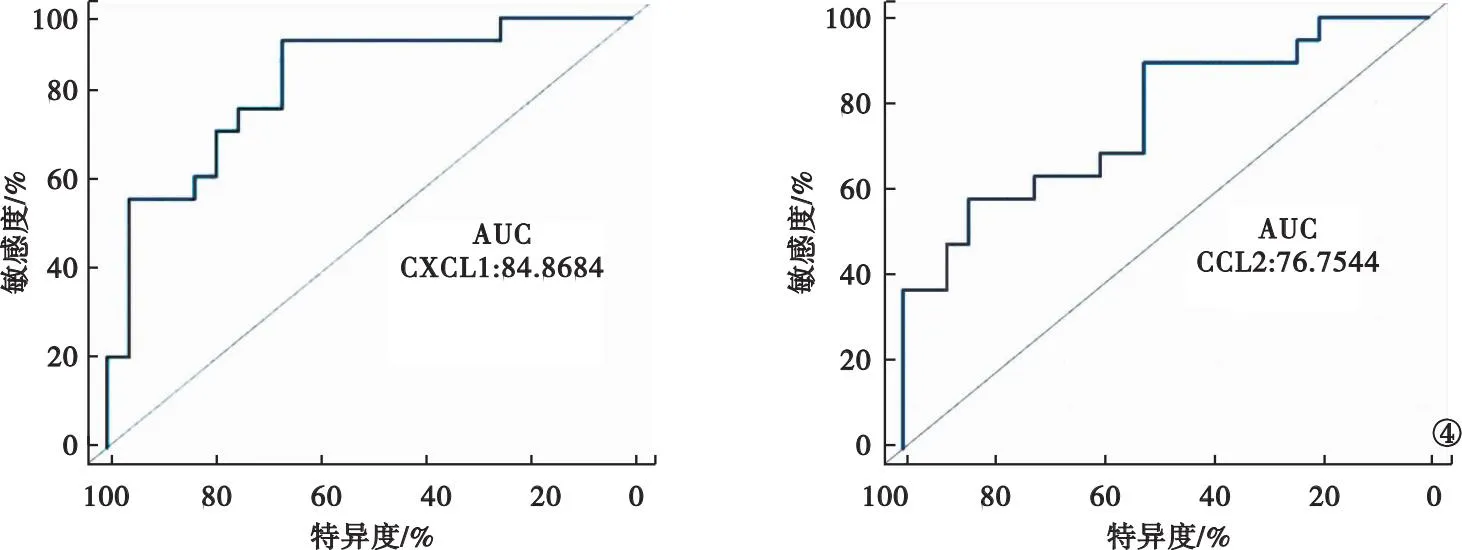
图4 hub基因ROC曲线
3 讨论
儿童DM的发病机制有多种研究,但多基因参与调控网络中核心基因的确定仍然存在争论。本研究旨在对GSE9006和GSE7014数据进行分析比较,以筛选出针对儿童期DM起病有诊断和预测作用的基因。
本研究GO和KEGG分析发现,不同DM时期亚型间有较多相同的分子功能和信号转导通路。核心网络建立后提取hub基因发现,儿童期T1DM和T2DM的hub基因分别为CXCL1和CCL2,计算ROC曲线下面积证明其对DM有良好的预测和诊断能力。CXCL1和CCL2在成人期DM对应的亚型中均不是差异表达基因,说明儿童期DM和成人期DM的hub基因并不相同,不同时期发病的DM致病机制也不尽相同。儿童期T1DM、T2DM的hub基因CXCL1和CCL2可作为鉴别诊断标志物,既可预测发病可能,对于儿童期DM基因筛查检测具有重要意义;同时也是潜在的治疗靶点。
T1DM是一种异质性自身免疫性疾病,免疫系统因素在T1DM的发病机制中起重要作用[7]。趋化因子作为免疫系统的重要成员,有4个亚家族,分别是CC、CXC、CX3C和C[8]。CXCL1具有促进炎症和诱导炎症的作用,同时,还有协助运输白细胞,促进血管生成和辅助新生血管形成的作用[9]。Hakimizadeh等[10]研究发现,与对照组比较,T1DM患者血浆趋化因子CXCL1水平升高且与T1DM并发症密切相关,发生并发症的T1DM患者的趋化因子水平升高。Takahashi等[11]研究表明,与对照组T2DM受试者比较,T1DM受试者血清CXCL1显著升高,是一个很好的T1DM标记物,可能表明易发生自身免疫性疾病。Darakhshan等[12]研究发现,与正常健康产妇相比较,妊娠DM产妇的母亲及新生儿血清中CXCL1表达水平显著升高,推测CXCL1可能与儿童T1DM遗传致病有关。
T2DM患者常伴有许多生理和心理上的并发症,Herder等[13]研究表明,T2DM患者高CCL2水平与较低的抑郁症发生率相关,而在T1DM中则不存在这种关联。Jourdan等[14]研究发现,胰岛炎症促进β细胞丢失和T2DM发生,趋化因子CCL2高表达是炎症巨噬细胞极化的标志。Dabrowska-Zamojcin等[15]研究了接受肾移植并接受钙调神经磷酸酶抑制剂治疗的患者,发现移植后DM发展的危险性与CCL2 rs1024611 G等位基因数呈显著正相关,并揭示了这种多态性是移植后DM的独立危险因素,说明CCL2不但是T2DM产生的关键基因,并且其单核苷酸多态性影响DM发展进程。
综上所述,通过生物信息学分析发现,儿童期T1DM、T2DM的CXCL2和CCL2基因可能是儿童DM的hub基因,具有诊断和预测发病的作用。

