香椿中3个水通道蛋白基因(TsAQP)的克隆和表达分析
赵胡 沈程 郝庆萍 刘艳红 季春艳 石潇瀑





赵 胡,沈 程,郝庆萍,等. 香椿中3个水通道蛋白基因(TsAQP)的克隆和表达分析[J]. 江苏农业学报,2023,39(8):1635-1645.
doi:10.3969/j.issn.1000-4440.2023.08.003
收稿日期:2022-11-27
基金项目:安徽省高等学校自然科学基金重点项目(KJ2021A0683);阜阳师范大学-阜阳市2021年度市校合作科技专项(SXHZ202107);2020年度高校优秀拔尖人才培育资助项目(gxgwfx2020049);阜阳师范大学自然科学重点项目(2020FSKJ01ZD)
作者简介:赵 胡(1977-),男,安徽六安人,博士,副教授,主要从事植物分子生物学研究。(E-mail)zhaohu8196@sina.com
通讯作者:石潇瀑,(E-mail)tiramisu.shi@163.com
摘要:水通道蛋白(Aquaporins,AQP)能够促进水分和小分子物质在膜上的运输,维持细胞水分平衡。本研究利用香椿转录组数据,克隆到3个香椿水通道蛋白基因(TsAQP),即 TsPIP1-5 (GenBank登录号MT501152)、TsPIP2-5 (GenBank登录号MT501153)和 TsTIP2-1 (GenBank登录号MT501154)。利用生物信息学和实时荧光定量PCR(qRT-PCR)技术,结合生理表型分析,研究TsPIP1-5、TsPIP2-5和TsTIP2-1蛋白性质、表达模式和在香椿芽采后贮藏中的功能。结果表明:從转录组数据中鉴定出的20个TsAQP可分为5类;TsPIP1-5、TsPIP2-5和TsTIP2-1是通过跨膜区定位于膜的疏水性稳定蛋白,含磷酸化位点,无信号肽; TsPIP1-5、TsPIP2-5 和 TsTIP2-1 在根、茎和叶中均有表达且有一定的器官差异性; TsPIP1-5、TsPIP2-5 和 TsTIP2-1 在香椿芽低温贮藏过程中表达量提高,暗示TsAQP在香椿芽采后脱水过程中有调控作用。本研究结果为进一步研究香椿中TsAQP基因的功能和作用机制奠定了基础。
关键词:香椿;水通道蛋白;基因克隆
中图分类号:S644.4 文献标识码:A 文章编号:1000-4440(2023)08-1635-11
Cloning and expression analysis of three aquaporin genes (TsAQP) in Toona sinensis
ZHAO Hu1,2 SHEN Cheng1,2 HAO Qing-ping1,2 LIU Yan-hong3 JI Chun-yan3 SHI Xiao-pu1
(1.Biology and Food Engineering College, Fuyang Normal University, Fuyang 236037, China;2.Engineering Technology Research Center of Anti-aging Chinese Herb, Fuyang 236037, China;3.College of Information Engineering, Fuyang Normal University, Fuyang 236041, China)
Abstract:Aquaporins (AQP) facilitate the transport of water and small molecules across membranes and maintain water balance of cells. Three aquaporin genes in Toona sinensis (TsAQP) TsPIP1-5 (GenBank accession number MT501152) TsPIP2-5 (GenBank accession number MT501153), and TsTIP2-1 (GenBank accession number MT501154), were cloned based on transcriptome sequencing. Using a combination of bioinformatics and real-time fluorescence quantitative PCR (qRT-PCR), we studied the physiological phenotypes, protein properties, expression patterns, and function of TsPIP1-5, TsPIP2-5 and TsTIP2-1 during post harvest storage of Toona sinensis buds. The results indicated that 20 TsAQP proteins identified from the transcriptome data could be classified into five subfamilies. TsPIP1-5, TsPIP2-5 and TsTIP2-1 were hydrophobic stable proteins located on the membrane through the transmembrane region, containing phosphorylation sites and no signal peptide. Different expression levels of TsPIP1-5, TsPIP2-5 , and TsTIP2-1 were detected in the roots, stems and leaves with certain organ differences. The expression levels of TsPIP1-5, TsPIP2-5 and TsTIP2-1 increased during cold storage of Toona sinensis buds, suggesting that they played a regulatory role in the process of post harvest dehydration. The results of this study lay a foundation for further research on function and regulatory mechanisms of TsAQPs in Toona sinensis.
Key words:Toona sinensis;aquaporin;gene cloning
水通道蛋白(Aquaporin,AQP)是在生物体膜上的具有选择性运输水分子功能的通道蛋白。AQP不仅运输水分,在气体、硼、硅、活性氧(ROS)和阳离子等小分子物质的运输上也发挥多种生理作用[1-3]。AQP的相对分子质量一般为2.3×104~3.1×105。X射线晶体学测定结果表明,AQP具有高度保守的结构特征[4-5]。AQP有5个环状结构(A~E环)和6个跨膜结构相互连接,其中B环和D环连接胞浆内,A环、C环、E环连接胞浆外[5]。AQP蛋白形成的中央水通道由跨膜结构、B环、E环共同组成,AQP的典型结构基序Asn-Pro-Ala(NPA)位于B环和E环[6]。
AQP在植物中广泛分布且表现出较高的多样性,根据蛋白质多肽链的氨基酸线性排列顺序和蛋白质在细胞结构上的定位,AQP可划分为7个亚类[7-8]:(1)具有质膜定位的PIP蛋白,进一步又可细分为PIP1类和PIP2类;(2)具有液泡膜定位的TIP蛋白;(3)类根瘤菌26膜内在蛋白NIP;(4)小分子碱性膜蛋白SIP;(5)类GlpF膜蛋白GIP;(6)未分类的X蛋白XIP;(7)混合蛋白HIP。大豆中, NIP类水通道蛋白GmNOD26定位于根系固氮菌周膜[9-10]。非豆科植物中, NIP定位于质膜或内质网[11-13]。已知成员数较少的SIP主要定位在内质网[14], XIP主要定位在质膜[15]。此外,GIP和HIP亚类只存在于苔藓中[7-8]。从非维管植物到维管植物,所有陆生植物均存在PIP、TIP、NIP和SIP亚类[16],其中,大部分NIP和SIP对小分子有机物和矿物质有良好的渗透性,而对水分子的转运活性和专一性较低[17-19],植物细胞水分的跨膜运输主要依赖于PIP和TIP[20-24]。
香椿[Toona sinensis(A.Juss.)Raen]可作为树木用于园林绿化,其嫩芽(香椿芽)更多作为蔬菜用于鲜食[25]。采后失水是香椿芽采后衰老劣变的原因之一[26]。AQP是调控植物水分运输和维持细胞内水分平衡的重要基因[27-29]。目前,在分子层面上对香椿的AQP还有待进一步了解。本研究首先在香椿转录组数据基础上筛选出香椿AQP编码基因(TsAQP)并进行同源性分析;其次,在主要负责水分运输的 PIP1、PIP2和TIP 亚类中各选取转录丰度较高且在香椿芽采后贮藏过程中表达量变化显著的1个基因,通过PCR扩增分别获得 TsPIP1-5、TsPIP2-5 和 TsTIP2-1 的基因序列,并对其编码的蛋白质进行生物信息学分析;最后,探究 TsPIP1-5、TsPIP2-5 和 TsTIP2-1 在香椿不同器官以及香椿芽采后贮藏过程中的表达模式。本试验的目的是为解析水通道蛋白参与调控香椿芽采后失水和衰老的机制提供理论依据。
1 材料与方法
1.1 植物材料及培养条件
选用的香椿品种为黑油椿,2021年4月18日在安徽省太和县香椿种植园采集香椿芽。为保证香椿芽材料遗传背景一致,全部香椿芽均采自10年生的同株母树。选取长约15 cm生长良好的嫩芽样品,放入装有冰袋的塑料箱中,迅速带回实验室。新鲜香椿芽洗净并晾干后放入4 ℃冰箱贮藏,分别于贮藏的第0 d、3 d和5 d取样(每个取样点设置3组重复,每组重复由3~5个芽头组成),液氮速冻,用于4 ℃贮藏期间TsAQP基因表达量的检测。
选取生活力和萌发率一致的香椿种子,栽培于实验室专用的塑料盆中。生长条件设置为温度20 ℃,光照度800~1 000 lx,光周期为12 h光照,12 h黑夜,相对湿度控制在65%左右。待第二对叶片展开,分别取来自3~5株小苗的根、茎和叶片组成1个生物学重复(共3组生物学重复),液氮速冻贮藏备用,用于检测TsAQP基因在不同器官中表达量。
1.2 香椿采后失水试验
将采摘后的香椿芽每组选取3~5个芽头,将其分别放入100 μmol/L HgCl2溶液和蒸馏水(对照)中浸泡10 min后冲洗3~5遍,晾干表面水分,在4 ℃的冰箱里贮藏。分别在贮藏的第0 d、3 d和5 d的同一时间对香椿芽进行形态观察。
1.3 香椿水通道蛋白家族分析
对从转录组数据中获得的20个TsAQP,利用MEGA 5软件以邻接法(Neighbor-joining method)分析氨基酸序列和同源性[30-31]。
1.4 RNA提取和cDNA合成
用试剂盒[天根生化科技(北京)有限公司产品,货号DP441]提取香椿幼苗不同部位的总RNA;1 000 ng总RNA用于反转录得到cDNA,反转录试剂盒为天根生化科技(北京)有限公司产品,货号KR103。
1.5 TsPIP1-5、TsPIP2-5和TsTIP2-1 基因克隆
從转录组筛选到的TsAQP中选取主要负责水分运输的 PIP1、PIP2 和TIP亚类中转录丰度较高且在香椿芽采后贮藏过程中表达量变化显著的 TsPIP1-5、TsPIP2-5和TsTIP2-1 ,设计并合成基因特异性引物(表1)进行PCR扩增。将PCR扩增得到的目的产物和线性化的克隆载体pMD18-T[宝日医生物技术(北京)有限公司产品]按一定比例(参照试剂盒说明书)混合连接。连接后的产物转化大肠杆菌(E.coli DH5α)并送至生工生物工程(上海)股份有限公司测序。测序后分析比对碱基序列。
1.6 TsPIP1-5、TsPIP2-5和TsTIP2-1蛋白生物信息学分析
利用相关生物信息学在线软件(表2)对3个TsAQP进行预测分析。
1.7 基因表達量检测
使用CFX96 Touch PCR仪(BIO-RAD伯乐生命医学产品公司产品)进行qRT-PCR反应,检测基因的相对表达量。采用荧光定量试剂盒FP205[天根生化科技(北京)有限公司产品]中的试剂进行试验。基因qRT-PCR特异性引物及内参基因引物见表1。利用SPSS 18.0软件,以ANOVA方式在P<0.05水平下进行基因相对表达量的差异性分析。绘图采用Origin 9软件。
2 结果与分析
2.1 香椿AQP同源性分析
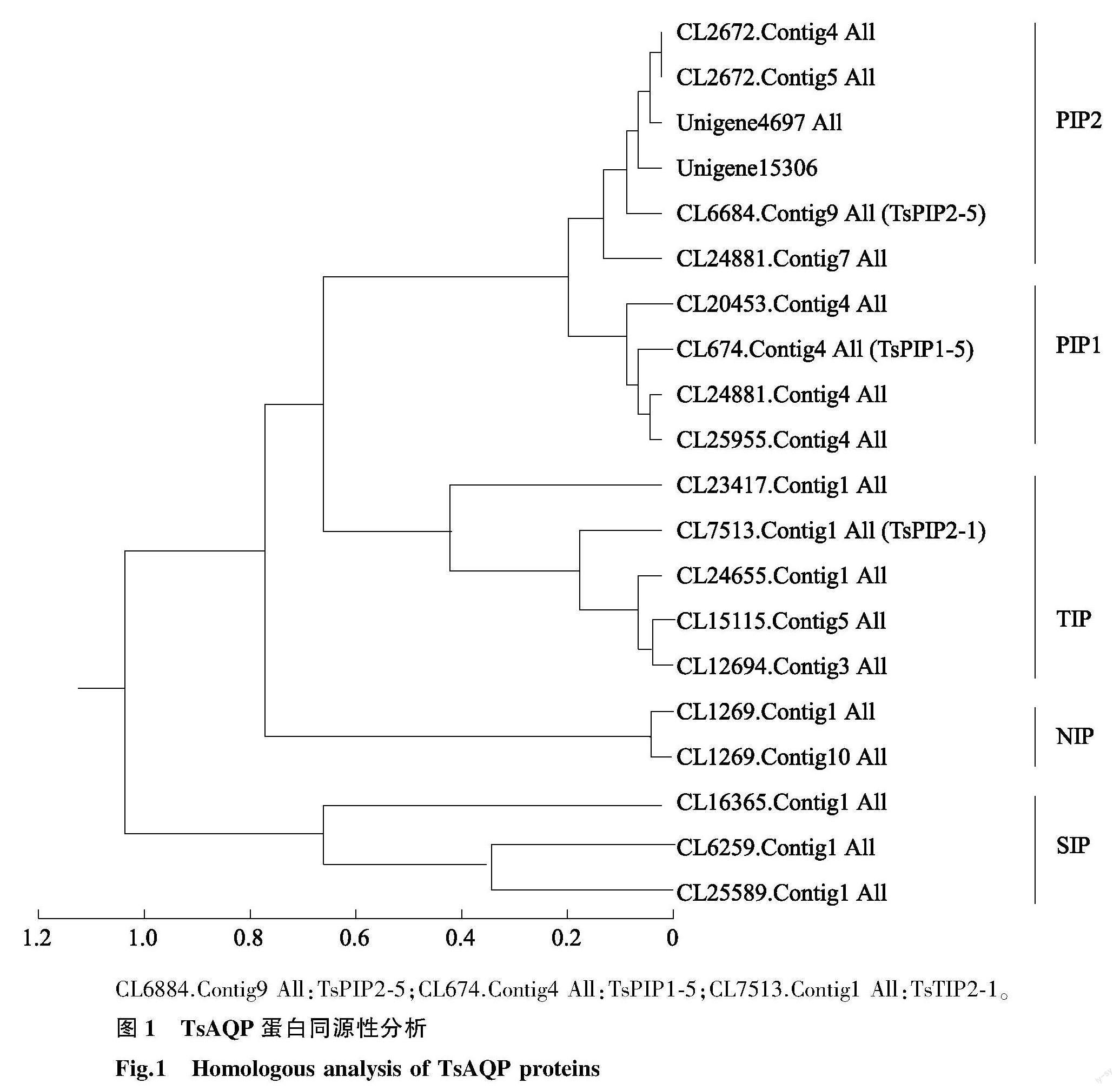
在转录组数据中共鉴定出20个TsAQP基因,对它们所编码的蛋白质进行同源性分析。如图1所示,20个TsAQP可分为5类,分别为PIP2(6个)、PIP1(4个)、TIP(5个)、NIP(2个)和SIP(3个)。
CL6884.Contig9 All:TsPIP2-5;CL674.Contig4 All:TsPIP1-5;CL7513.Contig1 All:TsTIP2-1。
2.2 香椿 TsPIP1-5、TsPIP2-5和TsTIP2-1 基因克隆
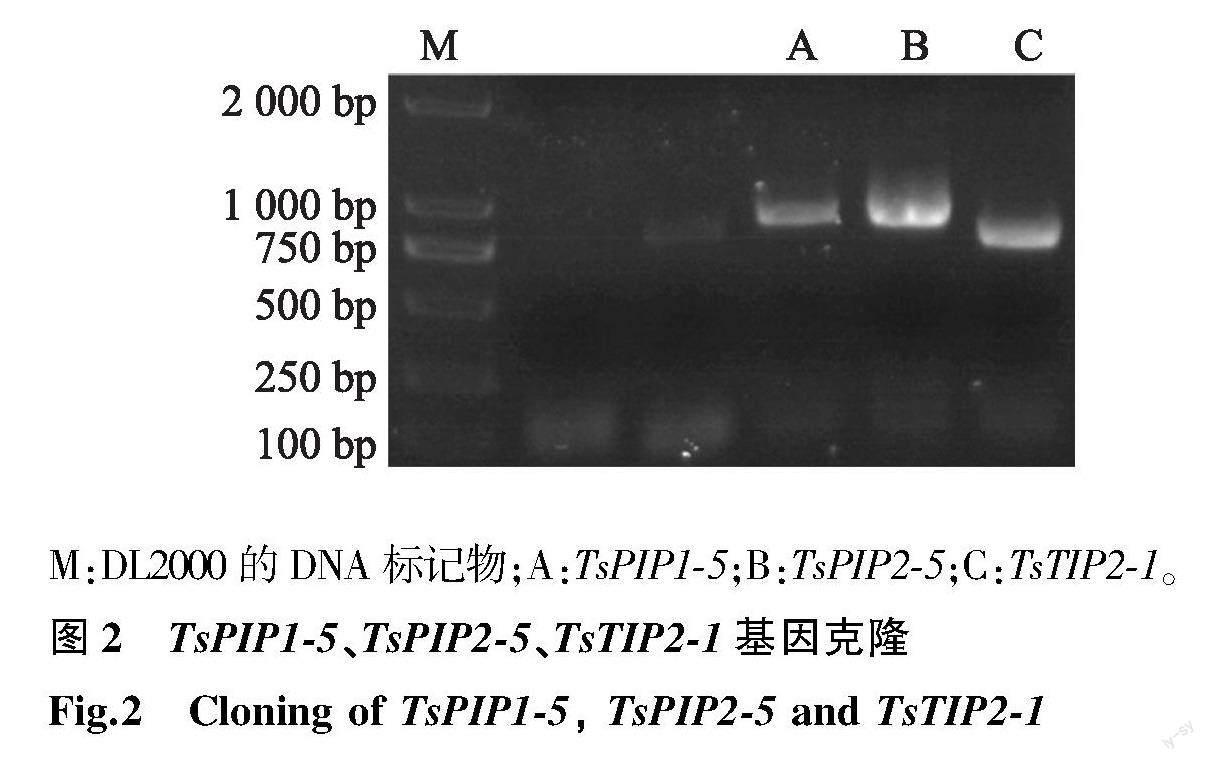
根据转录组数据,在 PIP1、PIP2 和TIP亚类中各选取1条转录丰度较高且在香椿芽采后贮藏过程中表达量变化显著的基因 TsPIP1-5、TsPIP2-5和TsTIP2-1 ,设计3对特异性引物(表1),以香椿嫩芽cDNA为模板,PCR扩增后电泳,分别得到 TsPIP1-5、TsPIP2-5和TsTIP2-1 的扩增条带(图2)。经DNA测序后,明确了3个基因完整的编码区序列(Coding sequence,CDS),并登录NCBI比对( TsPIP1-5 GenBank登录号MT501152; TsPIP2-5 GenBank登录号MT501153; TsTIP2-1 GenBank登录号MT501154)。TsPIP1-5蛋白是由867对碱基编码的288个氨基酸构成,TsPIP2-5蛋白是由858对碱基编码的285个氨基酸构成,TsTIP2-1蛋白是由744对碱基编码的247个氨基酸构成(图3)。
M:DL2000的DNA标记物;A:TsPIP1-5;B:TsPIP2-5;C:TsTIP2-1。
蛋白结构域分析结果显示,3个TsAQP均有1个内在蛋白(Major intrinsic proteins,MIP)的特征基序SGXHXNPAVTFG(图3),表明TsPIP1-5、TsPIP2-5和TsTIP2-1可参与小分子被动转运,促进水分子等在膜上的进出。其中,TsPIP1-5的MIP结构域位于氨基酸第46位至276位,TsPIP2-5的MIP结构域位于氨基酸第31位至264位,TsTIP2-1的MIP结构域位于氨基酸第15位至231位氨基酸(图3)。除此之外,TsPIP1-5、TsPIP2-5和TsTIP2-1各含有两个非常保守的NPA(Asn-Pro-Ala)基序(图3);TsPIP1-5、TsPIP2-5具有高等植物PIP所特有的两个保守基序GGGANXXXXGY和TGTGINPARSLGAA(图3A,图3B);TsTIP2-1具有TIP特有的NPARS基序(图3C)。
下划线(实线):MIP基序;下划线(虚线):PIP保守结构域;方框:TIP特有基序;阴影:NPA。
2.3 TsPIP1-5、TsPIP2-5和TsTIP2-1蛋白理化性质分析
如表3所示,TsPIP1-5、TsPIP2-5和TsTIP2-1的不稳定系数分别为28.14、31.86和27.19,不稳定系数均小于50,是稳定蛋白。TsPIP1-5、TsPIP2-5和TsTIP2-1亲水系数平均值均大于0,属于疏水蛋白,符合膜蛋白的特征。TsTIP2-1蛋白亲水性系数平均值为0.931,疏水性高于PIP类蛋白(TsPIP1-5蛋白亲水性系数为0.385,TsPIP2-5蛋白亲水性系数为0.518)。通过蛋白质的亚细胞定位预测,TsPIP1-5和TsPIP2-5定位于细胞膜,TsTIP2-1定位于液泡。
2.4 TsPIP1-5、TsPIP2-5和TsTIP2-1蛋白结构分析
无规则卷曲是TsPIP1-5、TsPIP2-5和TsTIP2-1蛋白多肽主链形成的最主要的结构,分别占比高达48.61%、40.35%和37.25%,其次含量较高的多肽主链结构是α-螺旋和延伸链,β-折叠占比较少(图4A~图4C)。其中,α-螺旋结构含量达到30%左右(TsPIP1-5为28.4%,TsPIP2-5为36.49%,TsTIP2-1为34.01%),延伸链结构含量达20%左右(TsPIP1-5为20.49%,TsPIP2-5为20.00%,TsTIP2-1为23.89%)(图4A~图4C)。TsPIP1-5、TsPIP2-5和TIP2-1蛋白的三维结构预测如图4D~图4F所示。
2.5 TsPIP1-5、TsPIP2-5和TsTIP2-1蛋白的跨膜区、磷酸化位点和信号肽分析
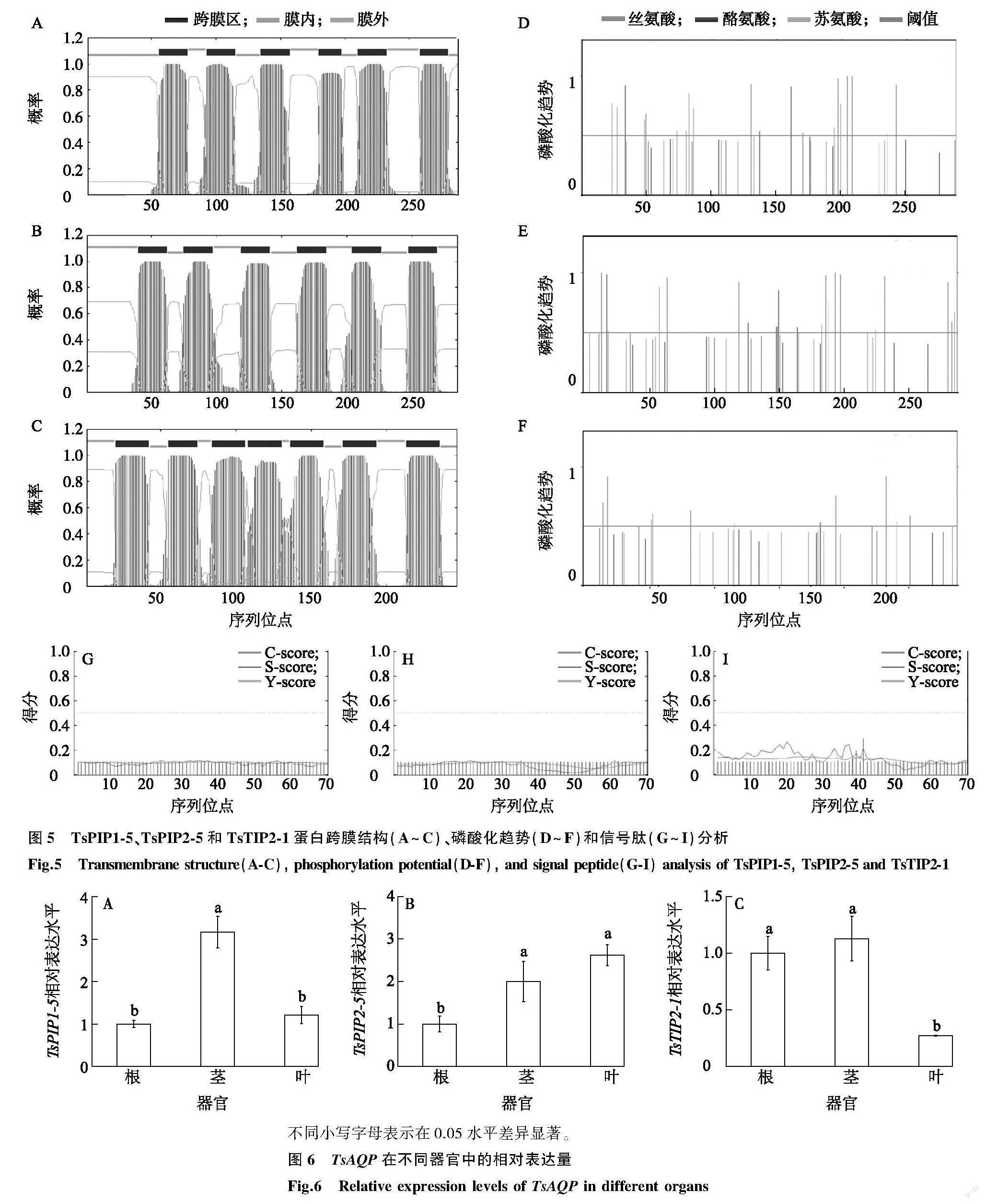
跨膜区预测结果显示,TsPIP1-5和TsPIP2-5存在6个跨膜区,TsTIP2-1存在7个跨膜区(图5A~图5C)。 磷酸化位点预测结果显示,保守的丝氨酸位点在3个TsAQPs中大量存在,其次為苏氨酸和酪氨酸位点(图5D~图5F),说明TsPIP1-5、TsPIP2-5和TsTIP2-1具有磷酸化的修饰机制。多个跨膜结构和磷酸化位点为蛋白质在膜上提供结构和功能的保障。分别对TsPIP1-5、TsPIP2-5和TsTIP2-1蛋白多肽链的前60位氨基酸位点进行分析,每一位点的得分(原始剪切位点C、信号肽S和综合剪切位点Y)均较低,最高值不超过0.5(图5G~图5I),说明3个蛋白质均无信号肽。结合跨膜区、信号肽和亚细胞定位结果,说明TsPIP1-5、TsPIP2-5和TsTIP2-1为定位于膜的非分泌蛋白质。
2.6 TsPIP1-5、TsPIP2-5和TsTIP2-1 基因在香椿幼苗中的表达
利用qRT-PCR检测了3个TsAQP在香椿幼苗的根、茎和叶中的转录水平。 TsPIP1-5、TsPIP2-5 和 TsTIP2-1 在根、茎、叶中均有表达。 TsPIP1-5 在茎中的表达量是根和叶片的3倍左右(图6A); TsPIP2-5 的相对表达量由植物地下部分向地上部分逐渐升高,在叶中的表达量显著高于根中(图6B); TsTIP2-1 则与 TsPIP2-5 相反,在叶中表达量最低,在根和茎中的表达量相近,在根和茎中的表达量是叶中的5倍左右(图6C)。
不同小写字母表示在0.05水平差异显著。
2.7 TsPIP1-5、TsPIP2-5和TsTIP2-1 基因在香椿芽贮藏过程中的作用
HgCl2可抑制水通道蛋白活性[20],本研究以100 μmol/L HgCl2处理香椿芽抑制水通道蛋白活性,研究TsAQP在香椿芽贮藏过程中的作用。在香椿芽低温贮藏过程中,叶片逐渐萎蔫,在第3 d和5 d时,对照组的叶片比100 μmol/L HgCl2处理组萎蔫程度更严重(图7A),说明水通道蛋白活性受抑制可延缓香椿芽采后失水。利用qRT-PCR检测香椿芽采后低温(4 ℃)贮藏过程中 TsPIP1-5、TsPIP2-5 和 TsTIP2-1 的表达情况。总体来说,随贮藏时间延长,3个TsAQP表达量上升,在采后0~3 d的时间内,表达量上升缓慢,采后3~5 d表达量上升迅速(图7B)。 TsPIP1-5 表达量在采后3 d是0 d的1.6倍,在采后5 d时是0 d的2.34倍(图7B)。 TsPIP2-5 和 TsTIP2-1 的表达量变化更为剧烈,在采后3 d时分别是0 d的8.07倍和4.63倍,在采后5 d时分别是0 d的30.79倍和16.13倍(图7B)。以上结果表明,水通道蛋白受抑制时,香椿芽采后失水速率降低,香椿芽采后失水与TsAQP活性有关; TsPIP1-5、TsPIP2-5 和 TsTIP2-1 基因在采后高量表达,表明 TsPIP1-5、TsPIP2-5 和 TsTIP2-1 可能在香椿芽采后失水及衰老过程中有重要调控作用。
A:香椿芽表型; B:TsAQP基因相对表达量。不同小写字母表示在0.05水平差异显著。
3 讨 论
3.1 香椿TsAQP基因及分类
植物AQP主要划分为7个亚类,其中PIP、TIP、NIP和SIP在所有植物中较为保守[32]。AQP基因家族表现出快速进化的迹象,因此不同物种的AQP多样性较高且不能必然区分物种之间的同源性[32]。在拟南芥、玉米、水稻、天山雪莲、香石竹中分别鉴定出35、36、33、33、10个AQP基因[22-23,32-34]。香椿芽是中国特色蔬菜,但其采后讯速失水劣变,保鲜期短成为制约香椿作为鲜食蔬菜发展的重要因素。植物中AQP是调控细胞水分平衡的重要蛋白质,而香椿中AQP的基本信息尚未明确。本研究在分析香椿转录组数据的基础之上共筛选出20个香椿TsAQP基因,分属于 PIP2、PIP1、TIP、NIP和SIP 5个亚类。利用分子克隆,获得 TsPIP1-5、TsPIP2-5 和 TsTIP2-1 的完整CDS序列,为深入研究TsAQP功能和香椿芽采后失水机制奠定基础。
3.2 TsPIP1-5、TsPIP2-5和TsTIP2-1蛋白可能通过磷酸化执行不同功能
蛋白质磷酸化是水通道蛋白执行功能的重要保证。丝氨酸磷酸化对水通道蛋白的水转运活性有促进作用[35]。对香椿TsPIP1-5、TsPIP2-5和TsTIP2-1蛋白磷酸化位点分析结果发现,3个TsAQP均含有较多的丝氨酸磷酸化位点。此外,在分析中发现,同一磷酸化位点可能被多个不同激酶结合。例如,TsPIP1-5蛋白丝氨酸磷酸化位点S27被预测有DNAPK、ATM、CK-Ⅱ、cdc2等激酶可结合,相似的情况也见于TsPIP2-5和TsTIP2-1磷酸化位点。由此推测,TsPIP1-5、TsPIP2-5和TsTIP2-1具有灵活的调控机制,不仅在水转运过程中发挥重要功能,也可能通过不同的磷酸化途径调控其他生命过程。
3.3 TsPIP1-5、TsPIP2-5和TsTIP2-1 的组织特异性表达及其作用
基因在不同器官和组织中的表达与它们的功能相关,具有不同水分转运活性的水通道蛋白在调节不同组织和细胞的水通量和维持水势方面可能发挥着不同作用[28,36-39]。例如,PIP和TIP在根中的高水平表达,与它们控制水的径向运输、调节渗透压有关[6,15,28,40-44]。PIP在叶肉细胞中的表达可维持细胞高水势,调控气孔开闭,促进CO2扩散,促进叶肉细胞生长[38,45-47]。不同植物的AQP基因在组织器官中的表达模式有所不同。例如,洋桔梗 EgPIP1;3 在茎中表达量最高[48],龙眼 DLPIP1 在根中的表达量明显高于其他组织器官[49],香石竹 DcaAQP4 在萼片和茎中有较高表达量 DcaAQP7 特异表达于茎和叶组织[34]。本试验中 TsPIP1-5 相对表达量最高的器官为茎; TsPIP2-5 在茎和叶中的相对表达量明显高于根; TsTIP2-1 则是在叶片中表达量最低。说明 TsPIP2-5 可能与叶片细胞水势维持、气孔运动、CO2同化等过程有关; TsTIP2-1 可能主要控制径向跨细胞水的运输和渗透调节。
3.4 TsPIP1-5、TsPIP2-5和TsTIP2-1 可能通过控制失水参与香椿芽采后衰老调控
植物遭遇水分胁迫时,水通道蛋白的表达及活性都受到精细复杂调控,确保细胞内外的水分平衡[50],主要表现在不同水通道蛋白对水分胁迫的反应有所差异[51-52]。水通道蛋白编码基因 GhPIP2;7 和 GhTIP2;1 可正向调节陆地棉对盐和渗透胁迫的耐受性[29];整合有盐生植物海蓬子(Salicornia bigelovii)水通道蛋白编码基因 SbPIP1 的转基因烟草更能耐受干旱胁迫[53];过表达 MusaPIP2;6 的香蕉更能適应盐生环境[54]。高盐碱的强渗透压条件下,海刀豆水通道蛋白编码基因 CrPIP1;1、CrPIP2;4和CrPIP2;6 表达量上调响应低水势胁迫[55]。然而也有结果显示,水通道蛋白编码基因的高表达不能直接提高植物对水分胁迫的抗性[56]。例如,将拟南芥水通道蛋白编码基因转化进烟草植株,可提高转基因植株在适宜条件下的生活力但无法提高植株对盐胁迫和生理脱水的耐受性[56]。由此看出,不同植物和不同类型的水通道蛋白对水分胁迫响应机制不同,这也体现了植物水通道蛋白的功能多样性。从水通道蛋白表达与植株吸水能力关系来看,正常水分条件下水稻水通道蛋白对水力传导度的贡献为79%,而水分胁迫条件下水通道蛋白对水力传导度的贡献增加至85%[57]。水分胁迫条件下,根系水通道蛋白活性与水力传导度、细胞膜水分通透能力同步下降[58]或同步增加[39]。由此可见,植株在水分胁迫发生时可能通过协同调节水通道蛋白活性和表达量,实现一定时间内或一定程度上对植株水分状况的调节。香椿芽采后品质劣变是生物学研究急需解决的问题之一[59-60]。
一直以来,人们从活性氧代谢、酶活系统、次生代谢物调节等角度对香椿芽采后衰老生理机制进行了大量研究。然而,果蔬在采后衰老过程中面临的另一个重要问题就是因脱水而导致离体器官水分平衡失调[26]。抑制水通道蛋白活性后香椿芽采后失水现象明显缓解,并且 TsPIP1-5、TsPIP2-5 和 TsTIP2-1 在采后贮藏过程中表达量逐渐提高,说明TsAQP在香椿芽采后失水过程中可能发挥了一定的调控作用。
4 结 论
香椿嫩芽采后易失水萎蔫,品質下降。本研究明确了 TsPIP1-5、TsPIP2-5 和 TsTIP2-1 基因序列及其编码蛋白质的基本理化性质;明确了 TsPIP1-5、TsPIP2-5 和 TsTIP2-1 在香椿幼苗不同器官中的表达情况。 TsPIP1-5 在茎中的表达量较高 TsPIP2-5 主要在茎和叶中表达量较高 TsTIP2-1 在叶中表达最低; TsPIP1-5、TsPIP2-5 和 TsTIP2-1 的表达量在采后贮藏过程中逐渐提高,表明 TsPIP1-5、TsPIP2-5 和 TsTIP2-1 在香椿嫩芽采后失水过程中发挥调控作用。本研究从3个TsAQP基因入手,探讨香椿嫩芽采后失水及其调控机制,为进一步研究香椿水通道蛋白的功能奠定基础,同时可为生产上改进香椿嫩芽采后贮藏保鲜技术提供新思路。
参考文献:
[1] MAUREL C, BOURSIAC Y, LUU D, et al. Aquaporins in plants [J]. Physiological Reviews,2015,95(4):1321-1358.
[2]BYRT C S, ZHAO M, KOURGHI M, et al. Non-selective cation channel activity of aquaporin AtPIP2;1 regulated by Ca2+ and pH [J]. Plant, Cell & Environment,2017,40(6):802-815.
[3]KOURGHI M, NOURMOHAMMANDI S, PEI J V, et al. Divalent cations regulate the ion conductance properties of diverse classes of aquaporins [J]. International Journal of Molecular Sciences,2017,18:2323.
[4]FUJIYOSHI Y, MITSUOKA K, DE-GROOT B L, et al. Structure and function of water channels [J]. Current Opinion in Structural Biology,2002,12(4):509-515.
[5]TRNROTH-HORSEFIELD S, WANG Y, HEDFALK K, et al. Structural mechanism of plant aquaporin gating [J]. Nature,2006,439(7077):688-694.
[6]MAUREL C, VERDOUCQ L, LUU D, et al. Plant aquaporins:membrane channels with multiple integrated functions [J]. Annual Review of Plant Biology,2008,59(1):595-624.
[7]ANDERBERG H I, DANIELSON J , JOHANSON U. Algal MIPs, high diversity and conserved motifs [J]. BMC Evolutionary Biology,2011,11:110.
[8]ANDERBERG H, KJELLBOM P, JOHANSON U. Annotation of selaginella moellendorffii major intrinsic proteins and the evolution of the protein family in terrestrial plants [J]. Frontiers in Plant Science,2012,3:33.
[9]FRANSSEN H J, NAP J P, BISSELING T. Biological nitrogen fixation [M]. New York:Chapman & Hall,1992:598-624.
[10]WEAVER C D, SHOMER N H, LOUIS C F, et al. Nodulin 26, a nodule-specific symbiosome membrane protein from soybean, is an ion channel [J]. Journal of Biological Chemistry,1994,269(27):17858-17862.
[11]MA J F, TAMAI K, YAMAJI N, et al. A silicon transporter in rice [J]. Nature,2006,440(7084):688-691.
[12]TAKANO J, WADA M, LUDEWIG U, et al. The arabidopsis major intrinsic protein NIP5;1 is essential for efficient boron uptake and plant development under boron limitation [J]. The Plant Cell,2006,18(6):1498-1509.
[13]MIZUTANI M, WATANABE S, NAKAGAWA T, et al. Aquaporin NIP2;1 is mainly localized to the Er membrane and shows root-specific accumulation in Arabidopsis thaliana [J]. Plant and Cell Physiology,2006,47(10):1420-1426.
[14]ISHIKAWA F, SUGA S, UEMURA T, et al. Novel type aquaporin SIPs are mainly localized to the ER membrane and show cell-specific expression in Arabidopsis thaliana [J]. FEBS Letters,2005,579(25):5814-5820.
[15]BIENERT G P, BIENERT M D, JAHN T P, et al. Solanaceae XIPs are plasma membrane aquaporins that facilitate the transport of many uncharged substrates[J]. The Plant Journal,2011,66(2):306-317.
[16]LI G, SANTONI V, MAUREL C. Plant aquaporins:Roles in plant physiology [J]. Biochimica et Biophysica Acta (BBA)-General Subjects,2014,1840(5):1574-1582.
[17]DANIELSON J , JOHANSON U. Unexpected complexity of the aquaporin gene family in the moss physcomitrella patens [J]. BMC Plant Biology,2008,8(1):45.
[18]JOHANSON U, GUSTAVSSON S. A new subfamily of major intrinsic proteins in plants [J]. Molecular Biology and Evolution,2002,19:456-461.
[19]NORONHA H, AGASSE A, MARTINS A P, et al. The grape aquaporin VvSIP1 transports water across the ER membrane [J]. Journal of Experimental Botany,2014,65(4):981-993.
[20]王文鋮,崔克辉. 非生物逆境对植物水孔蛋白表达调控的研究进展[J]. 植物生理学报,2016,52(4):423-430.
[21]KAMMERLOHER W, FISCHER U, PIECHOTTKA G P, et al. Water channels in the plant plasma membrane cloned by immunoselection from a mammalian expression system [J]. The Plant Journal,1994,6(2):187-199.
[22]CHAUMONT F O, BARRIEU F O, WOJCIK E, et al. Aquaporins constitute a large and highly divergent protein family in maize1 [J]. Plant Physiology,2001,125(3):1206-1215.
[23]JOHANSON U, KARLSSON M, JOHANSSON I, et al. The complete set of genes encoding major intrinsic proteins in arabidopsis provides a framework for a new nomenclature for major intrinsic proteins in plants [J]. Plant Physiology,2001,126(4):1358-1369.
[24]CHAUMONT F, TYERMAN S D. Aquaporins:Highly regulated channels controlling plant water relations [J]. Plant Physiology,2014,164(4):1600-1618.
[25]邢小艺,孙芳旭,郭轩佑. 香椿的综合利用价值浅析[J]. 现代园艺,2014,268(16):222.
[26]杨 慧,毛维林,赵守涣,等. 冰温结合开孔调湿包装对香椿嫩芽的保鲜效应[J]. 食品与机械,2017,33(9):121-125,140.
[27]WANG X, GAO F, BING J, et al. Overexpression of the Jojoba aquaporin gene, ScPIP1, enhances drought and salt tolerance in transgenic Arabidopsis [J]. International Journal of Molecular Sciences,2019,20:153.
[28]HACHEZ C, ZELAZNY E, CHAUMONT F. Modulating the expression of aquaporin genes in planta:A key to understand their physiological functions? [J]. Biochimica et Biophysica Acta (BBA)-Biomembranes,2006,1758(8):1142-1156.
[29]GUO A H, HAO J F, SU Y, et al. Two aquaporin gnes, GhPIP2;7 and GhTIP2;1, positively regulate the tolerance of upland cotton to salt and osmotic stresses [J]. Frontiers in Plant Science,2022,12:780486.
[30]SAITOU N, NEI M. The neighbor-joining method:A new method for reconstructing phylogenetic trees [J]. Molecular Biology and Evolution,1987,4(4):406-425.
[31]TAMURA K, DUDLEY J, NEI M, et al. MEGA4:Molecular evolutionary genetics analysis (MEGA) software version 4.0 [J]. Molecular Biology and Evolution,2007,24(8):1596-1599.
[32]SAKURAI J, ISHIKAWA F, YAMAGUCHI T, et al. Identification of 33 rice aquaporin genes and analysis of their expression and function [J]. Plant and Cell Physiology,2005,46(9):1568-1577.
[33]夏雯雯,李 錦,祝建波. 天山雪莲水孔蛋白基因(AQP)家族鉴定与生物信息学分析[J]. 江苏农业学报,2016,32(6):1244-1250.
[34]孔维龙,胡 瑞,包满珠,等. 香石竹水孔蛋白的克隆及表达分析[J]. 园艺学报,2017,44(3):515-527.
[35]NIITTYL T, FUGLSANG A T, PALMGREN M G, et al. Temporal analysis of sucrose-induced phosphorylation changes in plasma membrane proteins of arabidopsis [J]. Molecular & Cellular Proteomics,2007,6(10):1711-1726.
[36]SCHFFNER A R. Aquaporin function, structure, and expression:are there more surprises to surface in water relations? [J]. Planta,1998,204:131-139.
[37]SUGA S, MURAI M, KUWAGATA T, et al. Differences in aquaporin levels among cell types of radish and measurement of osmotic water permeability of individual protoplasts [J]. Plant Cell Physiology,2003,44(3):277-286.
[38]PRADO K, MAUREL C. Regulation of leaf hydraulics:From molecular to whole plant levels [J]. Frontiers in Plant Science,2013,4:255.
[39]HACHEZ C, VESELOV D, YE Q, et al. Short-term control of maize cell and root water permeability through plasma membrane aquaporin isoforms [J]. Plant Cell & Environment,2012,35(1):185-198.
[40]ALEXANDERSSON E, FRAYSSE L, SJVALL-LARSEN S, et al. Whole gene family expression and drought stress regulation of aquaporins [J]. Plant Molecular Biology,2005,59(3):469-484.
[41]TYERMAN S, BOHNERT H J, MAUREL C, et al. Plant aquaporins:Their molecular biology, biophysics and significance for plant water relations [J]. Journal of Experimental Botany,1999,50(SI):1055-1071.
[42]MAUREL C, JAVOT H,LAUVERGEAT V, et al. Molecular physiology of aquaporins in plants [J]. International Review of Cytology,2002,215:105-148.
[43]LUU D, MAUREL C. Aquaporins in a challenging environment:molecular gears for adjusting plant water status [J]. Plant Cell & Environment,2005,28(1):85-96.
[44]FORREST K L, BHAVE M. Major intrinsic proteins (MIPs) in plants:a complex gene family with major impacts on plant phenotype [J]. Functional & Integrative Genomics,2007,7(4):263-289.
[45]BESSE M, KNIPFER T, MILLER A J, et al. Developmental pattern of aquaporin expression in barley (Hordeum vulgare L.) leaves [J]. Journal of Experimental Botany,2011,62(12):4127-4142.
[46]SAKURAI J, AHAMED A, MURAI M, et al. Tissue and cell-specific localization of rice aquaporins and their water transport activities [J]. Plant and Cell Physiology,2008,49(1):30-39.
[47]HEINEN R B, YE Q, CHAUMONT F. Role of aquaporins in leaf physiology [J]. Journal of Experimental Botany,2009,60(11):2971-2985.
[48]丁岳煉, 林燕飞,何生根,等. 半定量RT-PCR法分析水孔蛋白基因 EgPIP1;3 在洋桔梗切花中的表达[J]. 仲恺农业工程学院学报,2012,25(1):6-10.
[49]陈 虎,何新华,罗 聪,等. 龙眼水通道蛋白基因( DLPIP1 )的克隆与表达分析[J]. 果树学报,2012,29(2):225-230.
[50]RODRíGUEZ-GAMIR J, XUE J, CLEARWATER M J, et al. Aquaporin regulation in roots controls plant hydraulic conductance, stomatal conductance, and leaf water potential in Pinus radiata under water stress [J]. Plant Cell & Environment,2019,42(2):717-729.
[51]VANDELEUR R K, MAYO G, SHELDEN M C, et al. The role of plasma membrane intrinsic protein aquaporins in water transport through roots:diurnal and drought stress responses reveal different strategies between isohydric and anisohydric cultivars of grapevine [J]. Plant Physiology,2009,149(1):445-460.
[52]SHATIL-COHEN A, ATTIA Z, MOSHELION M. Bundle-sheath cell regulation of xylem-mesophyll water transport via aquaporins under drought stress:a target of xylem-borne ABA? [J]. Plant Journal,2011,67:72-80.
[53]SUN X B, DENG Y M, LIANG L J, et al. Overexpression of a PIP1 gene from salicornia bigelovii in tobacco plants improves their drought tolerance [J]. Journal of the American Society for Horticultural Science,2017,142(4):235-245.
[54]SHAREENA S, UPENDRA K S S, THUMBALLI R. Constitutive and stress-inducible overexpression of a native aquaporin gene ( MusaPIP2;6 ) in transgenic banana plants signals its pivotal role in salt tolerance [J]. Plant Molecular Biology,2015,88(1/2):41-52.
[55]LIN R, ZHENG J, PU L, et al. Genome-wide identification and expression analysis of aquaporin family in Canavalia rosea and their roles in the adaptation to saline-alkaline soils and drought stress [J]. BMC Plant Biology,2021,21(1):333.
[56]AHARON R, SHAHAK Y, WININGER S, et al. Overexpression of a plasma membrane aquaporin in transgenic tobacco improves plant vigor under favorable growth conditions but not under drought or salt stress [J]. Plant Cell,2003,15:439-447.
[57]GRONDIN A, MAULEON R, VADEZ V, et al. Root aquaporins contribute to whole plant water fluxes under drought stress in rice (Oryza sativa L.)[J]. Plant Cell & Environment,2016,39(2):347-365.
[58]NORTH G B, MARTRE P, NOBEL P S. Aquaporins account for variations in hydraulic conductance for metabolically active root regions of Agave deserti in wet, dry, and rewetted soil [J]. Plant Cell & Environment,2004,27(2):219-228.
[59]趙 勤. 木本蔬菜香椿芽贮藏保鲜研究进展[J]. 贵州林业科技,2008,36(3):55-58.
[60]王 清,刘 涛. 香椿贮藏保鲜及加工应用的研究进展[J]. 农产品加工,2015(390):55-58,60.
(责任编辑:成纾寒)

