血凝试验和反向间接血凝试验定量检测PCV2 Cap抗原的研究
李晶梅,谢红玲,薛 霜,李文静,黄 涛,王焕君,刘项羽,张飞雁,朱 薇,李婷婷,石宝兰
(国药集团动物保健股份有限公司,武汉 430075)
猪圆环病毒2型(PCV2)属于圆环病毒科圆环病毒属。病毒粒子直径15-20 nm,呈20面体对称结构,无囊膜。PCV2病毒主要包括2个开放的阅读框架(ORF1和ORF2),其中ORF2编码的病毒衣壳蛋白(Capsid protein,Cap)是PCV2的主要的结构蛋白、免疫原性蛋白。表达PCV2 Cap蛋白的重组杆状病毒接种昆虫细胞,培养数日后可获得含有PCV2病毒样颗粒的细胞培养液,即PCV2 Cap抗原,此抗原可制备PCV2疫苗。疫苗生产中需要定量检测PCV2 Cap抗原,常用方法有SDS-PAGE、ELISA和BCA定量,其中SDS-PAGE和ELISA方法耗时较长,BCA只能检测纯化后样品。
很多病毒具有凝集红细胞的特性,如新城疫病毒可凝集鸡、小鼠和豚鼠等的红细胞[1],猪细小病毒可凝集豚鼠、鸡和大鼠等的红细胞[2],犬细小病毒可凝集猪红细胞[3],乙脑病毒可凝集鹅红细胞[4]等。反向间接血凝试验(RIHA)是用已知抗体致敏红细胞,然后与样品在适宜条件下反应,如样品中含有目的抗原,则抗原抗体发生特异性结合,红细胞出现肉眼可见的凝集现象[5]。本实验对重组杆状病毒表达的PCV2 Cap抗原凝集猪、鸡、绵羊红细胞的特性进行了初步研究,并尝试用反向间接血凝方法定量检测PCV2 Cap抗原,以期建立简单、快速、经济的PCV2 Cap抗原定量检测方法。
1 材料和方法
1.1 抗原、病毒、单抗 昆虫细胞重组杆状病毒表达系统表达的PCV2 Cap抗原,昆虫细胞扩繁的空杆状病毒,猪圆环病毒2型(PCV2)、猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)、猪传染性胃肠炎病毒(PEDV)、猪流行性腹泻病毒(TGEV),PCV2 Cap单抗,均由国药集团动物保健股份有限公司保存。
1.2 主要试剂耗材 1%猪红细胞、1%醛化猪红细胞、1%鸡红细胞、1%醛化鸡红细胞,1%醛化绵羊红细胞,1%鞣化绵羊红细胞,PBS(0.1 mol/L,pH 7.2)、含1%兔血清的PBS、醋酸盐缓冲液(0.1 mol/L,pH 5.0)均为常规方法配制。
1.3 PCV2 Cap抗原的血凝特性研究 按《中国兽药典》[6]中的血凝试验操作方法,用PBS和含1%兔血清的PBS分别作为稀释液,用1%猪红细胞、1%醛化猪红细胞、1%鸡红细胞、1%醛化鸡红细胞、1%醛化绵羊红细胞、1%鞣化绵羊红细胞分别测定PCV2 Cap抗原和空杆状病毒的血凝效价。
1.4 反向间接血凝试验最优单抗致敏稀释度的确定
1.4.1 1%致敏红细胞的制备 用醋酸盐缓冲液稀释PCV2 Cap单抗,使稀释倍数分别为1∶500、1∶1000、1∶2000、1∶4000、1∶8000、1∶16000。再分别与1%鞣化绵羊红细胞等体积混合,37 ℃水浴30 min致敏。用含1%兔血清的PBS洗红细胞并重悬,获得不同稀释度单抗致敏的1%致敏红细胞。
1.4.2 抗原的准备 用PBS按1∶100稀释PCV2 Cap抗原备用,简称Cap抗原。
1.4.3 最优单抗致敏稀释度的确定 RIHA效价测定的具体操作为:1)在96孔血凝板各孔加入0.025 mL含1%兔血清的PBS;2)各行第1孔加入0.025 mL Cap抗原,倍比稀释至11孔,弃去0.025 mL;3)各行每孔分别加入0.025 mL 1.4.1项制备的不同稀释度单抗致敏的1%致敏红细胞;4)振荡混匀,静置90~120 min,当第12孔(阴性对照)孔底红细胞出现钮扣状沉积时判定结果,以使致敏红细胞50%凝集的样品的最高稀释度为该样品的RIHA效价。如此,用不同稀释度的单抗致敏的1%致敏红细胞分别测定Cap抗原RIHA效价,效价最高的1%致敏红细胞对应的单抗的最高稀释度为本批次单抗的最适致敏稀释度。
1.5 反向间接血凝试验的特异性、敏感性研究
1.5.1 1%致敏红细胞的制备 以1.4.3确定的最适稀释度稀释单抗,稀释后的单抗与1%鞣化绵羊红细胞等体积混合,37 ℃水浴30 min致敏,获得1%致敏红细胞,备用。
1.5.2 RIHA方法的敏感性、特异性 用1%致敏红细胞、1%鞣化红细胞分别测定被检样品的血凝效价,被检样品包括浓缩纯化后的PCV2 Cap抗原、未经纯化的PCV2 Cap抗原、空杆状病毒、PCV2、CSFV、PRRSV、PRV、PEDV和TGEV。
1.5.3 RIHA方法的应用 用1%致敏红细胞测定若干未经纯化的和浓缩纯化后的PCV2 Cap抗原的RIHA效价,与ELISA测定的含量结果进行比较,研究方法的敏感性、实用性。
2 结果与分析
2.1 PCV2 Cap抗原的血凝特性 HA效价结果详见表1。纯化和未纯化的PCV2 Cap抗原均可凝集猪、鸡、绵羊红细胞,空杆状病毒不凝集红细胞,说明是PCV2 Cap抗原凝集了红细胞。含量相近的纯化和未纯化的PCV2 Cap抗原,分别用不同红细胞、不同稀释液检测,HA效价各有高低,说明有些红细胞和稀释液的组合不能准确定量PCV2 Cap抗原。同一PCV2 Cap抗原用醛化红细胞和新鲜红细胞测得的HA效价不完全相同,说明醛化导致红细胞凝集特性发生了变化。使用相同红细胞检测相同样品,而稀释液不同时,测得的HA效价不完全相同,说明稀释液对HA效价有显著影响。猪红细胞测得的HA效价高于鸡红细胞和绵羊红细胞测得的HA效价,分析原因可能是因为PCV2是猪的病毒,所以对猪红细胞较敏感。另外,PCV2 Cap抗原易引起猪红细胞的超凝集,鸡、羊红细胞无此现象(图1)。
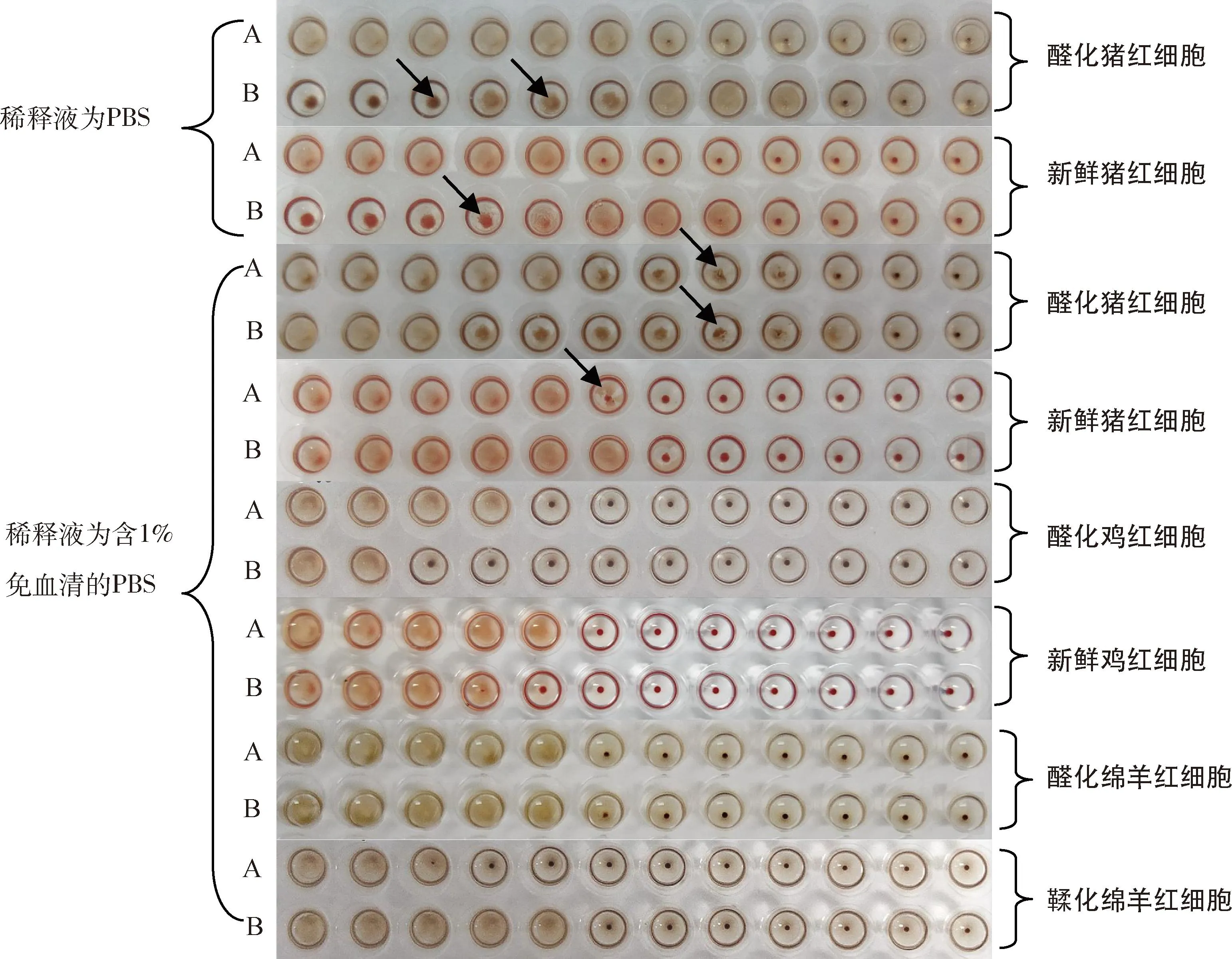
A、B:纯化的PCV2 Cap抗原、未纯化的PCV2 Cap抗原A / B: Purified PCV2 Cap antigen/Unpurified PCV2 Cap antigen图1 不同红细胞和稀释液检测的血凝结果图Fig 1 HA Tested by different erythrocytes and different dilutions
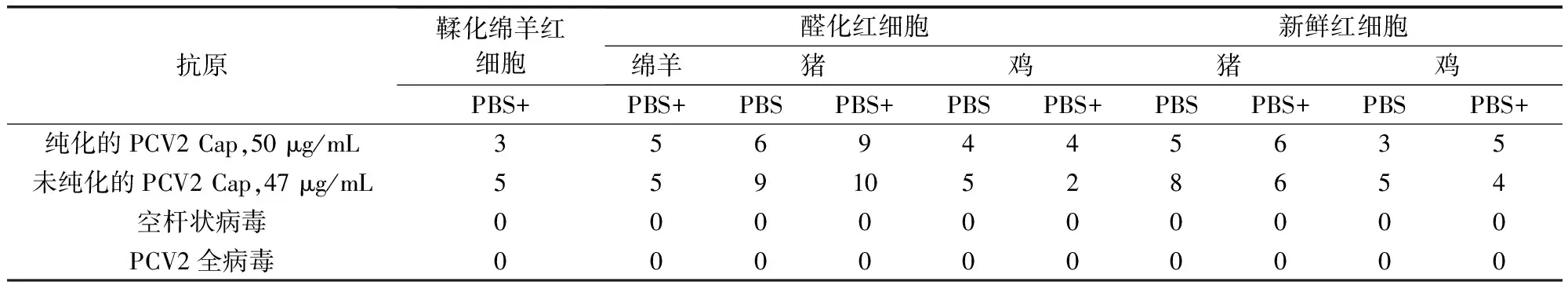
表1 HA效价(log2)Tab 1 HA titers(log2)
2.2 最适抗体致敏浓度 1∶500、1∶1000、1∶2000、1∶4000、1∶8000、1∶16000稀释的单抗致敏红细胞,检测PCV2 Cap抗原,效价分别为7 log2、7 log2、7 log2、6 log2、3 log2、1 log2(表2),由此确定本批次单抗1∶2000稀释使用最优。

表2 不同稀释度抗体致敏红细胞检测PCV2 Cap抗原Tab 2 PCV2 Cap Antigen Tested by Antibody Sensitized Erythrocytes with Different Dilutions
2.3 RIHA方法的敏感性、特异性结果 1%致敏红细胞检测纯化和未纯化的PCV2 Cap抗原效价分别为14 log2、13 log2,高于猪、鸡、非致敏绵羊红细胞检测的HA效价,说明RIHA方法敏感性良好。检测PK15细胞扩繁的PCV2病毒液效价小于1 log2,说明PCV2的含量低于RIHA方法检测下限。检测空杆状病毒、CSFV、PRRSV、PRV、PEDV、TGEV等病毒,效价均小于1 log2,说明RIHA方法特异性良好。PCV2 Cap抗原对1%鞣化红细胞也有凝集,但凝集效价远低于1%致敏红细胞的效价,说明测得的RIHA效价是特异的。结果详见表3。
2.4 RIHA方法的应用 样品1~样品4、样品5~样品8分别为未纯化的、浓缩纯化的PCV2 Cap抗原,均1∶500稀释后检测RIHA效价,结果显示,RIHA效价与ELISA方法测得的结果有平行关系。详见表4。
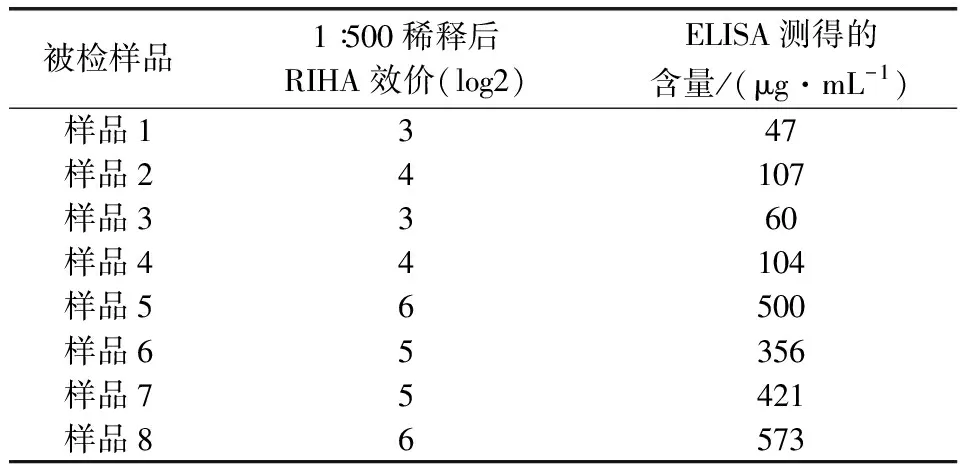
表4 样品检测结果Tab 4 Titer of samples
3 讨论与结论
3.1 PCV2 Cap抗原对猪、鸡、绵羊红细胞的凝集特性 PCV1不能凝集动物红细胞[7],也未见PCV2凝集动物红细胞的报道。本研究发现用昆虫细胞杆状病毒表达系统制备的PCV2 Cap抗原可凝集醛化猪红细胞、新鲜猪红细胞、醛化鸡红细胞、新鲜鸡红细胞、醛化绵羊红细胞、鞣化绵羊红细胞。上述红细胞不凝集PK15细胞扩繁的PCV2全病毒,分析原因可能哺乳动物细胞扩繁的PCV2抗原液中PCV2含量少,未达到能够凝集红细胞的量;昆虫细胞杆状病毒表达体系制备的PCV2 Cap抗原中PCV2 Cap含量高,稀释后仍可凝集红细胞。另外发现PCV2 Cap抗原易引起猪红细胞的超凝集,鸡、羊红细胞无此现象。
3.2 PCV2 Cap抗原凝集红细胞的条件、效价 ELISA定量检测为50 μg/mL的纯化的PCV2 Cap抗原和47 μg/mL未纯化的PCV2 Cap抗原,用不同红细胞和不同稀释液测得的凝集效价分别为3 log2~9 log2、2 log2~10 log2。说明红细胞不同、稀释液不同,测得的PCV2 Cap抗原凝集效价不同,且差异较大。
3.3 定量检测PCV2 Cap抗原的RIHA方法 PCV2 Cap单抗致敏鞣化绵羊红细胞,获得1%致敏红细胞,可用于RIHA方法定量检测PCV2 Cap抗原。1%致敏红细胞检测某批次纯化和未纯化的PCV2 Cap抗原,效价分别为14 log2、13 log2,均高于猪、鸡、非致敏绵羊红细胞检测的HA效价,说明RIHA方法敏感性良好。空杆状病毒、PCV2、CSFV、PRRSV、PRV、PEDV、TGEV的RIHA效价均小于1 log2,说明该方法特异性好,同时说明哺乳动物细胞扩繁的PCV2含量低未到达RIHA方法的检测下限。纯化后和未纯化的PCV2 Cap抗原的RIHA效价均与ELISA定量检测结果有平行关系,并且RIHA方法使用的设备耗材少、操作简便、用时短(1.5~2 h),可在抗原的生产环节应用作为SDS-PAGE和ELISA方法的补充。如检测生物反应器中培养的抗原可判定含量是否达标并结束培养;检测纯化浓缩后的抗原和废液可判定纯化浓缩工艺的抗原损耗率。
综上,通过研究 PCV2 Cap对猪、鸡、绵羊红细胞的凝集特性,确定了血凝方法定量检测PCV2 Cap有可行性,该方法的稳定性、与其他定量方法是否有平行关系等尚需进一步研究;本研究通过用PCV2 Cap单抗致敏红细胞初步建立了定量检测PCV2 Cap抗原的RIHA方法,确定其敏感性、特异性良好,RIHA效价与ELISA定量检测结果有平行关系,可用于昆虫细胞重组杆状病毒表达系统表达的PCV2 Cap抗原的快速定量检测。

