基于IL-6/STAT3信号通路探讨山楂酸对小鼠结肠癌CT26细胞增殖、凋亡的影响
李智,陈莉
(福建中医药大学药学院,福建 福州 350122)
结肠癌(colorectal cancer,CRC)是一种常见的胃肠道恶性肿瘤,为世界范围内五大主要癌症之一,中国结肠癌发病率位居全国第 3 位,死亡率居于全国第5位,且发病率和死亡率仍在逐年上升[1]。结肠癌的发病与遗传、饮食、肠道的慢性炎症等因素相关,由于其发病早期症状较隐匿,加大了早期发现、治疗的难度,晚期生存预后较差。目前,放疗、化疗、手术治疗是 CRC 的主要治疗方法[2],近年来许多研究表明,中药中的有效成分能抗肿瘤增殖及减少肿瘤的转移,有利于提高患者生存期,改善预后,提高患者生存质量等优点,成为当下结肠癌新药探索开发的热点[3]。
山楂酸(maslinic acid,MA)是一种五环三萜酸,存在于山楂、橄榄等多种天然植物中,具有丰厚的药用价值。近年来,相关研究显示其具有抗肿瘤、抗炎等生物活性[4-5]。已有研究表明,山楂酸在体内外表现出对结肠癌的治疗作用,山楂酸可通过 AMPK/mTOR 信号通路抑制结肠癌细胞HCT116与SW480的增殖与迁移[6],阻滞人结肠癌 HT29 细胞周期至G1期[7],激活caspase-8和caspase-3,诱导肿瘤细胞凋亡[8];同时,山楂酸也能降低1,2-二甲基肼诱导的结肠癌大鼠模型中肿瘤前生物标志物的含量[9]。信号转导及转录激活因子3(signal transducer and activator of transcription,STAT3)与多种恶性肿瘤的发生、发展关系最为密切,备受研究者的关注[10]。但目前国内外暂未有研究报道山楂酸对小鼠结肠癌CT26细胞中STAT3信号通路的影响。本研究基于STAT3 信号通路,探讨山楂酸对小鼠结肠癌 CT26 细胞增殖、凋亡的影响,为深入研究山楂酸在抗结肠癌的基础研究和临床应用提供理论和实验依据。
1 实验材料
1.1 实验细胞小鼠结肠癌细胞(CT26)购自武汉普诺赛生物科技有限公司。
1.2 实验试剂山楂酸(宝鸡市辰光生物科技有限公司);磷酸酶抑制剂正钒酸钠(Selleck公司);磷酸盐缓冲液、青-链霉素、1640培养基等试剂(Hyclone公司);胎牛血清(Vivacell公司);IL-6(PeproTech公司);DMSO(Sigma公司);CCK-8试剂盒、细胞凋亡检测试剂盒(大连美仑生物技术有限公司);STAT3、磷酸化 STAT3(p-STAT3)、B淋巴细胞瘤-2 基因(Bcl-2)抗体(Cell Signaling Technology公司);内参肌动蛋白(Actin)抗体(Cohesion Biosciences公司);二抗(Merck Millipore公司);RNA抽提试剂盒(上海碧云天生物技术有限公司);逆转录试剂盒(赛默飞公司);RT-PCR荧光染料定量预混液(南京诺维赞生物科技有限公司);无蛋白快速封闭液(上海雅酶生物科技有限公司)。
1.3 实验仪器AUWD120电子分析天平(岛津公司); MILLI-Q超纯水装置(Millipore公司);Tri-Gas INCuRATOR/三气培养箱(上海力申科学仪器有限公司);Infinite M200 Pro多功能酶标仪(Tecan公司);小型槽式转印系统、电泳槽(Bio-Rad公司);化学发光成像仪(Amersham Pharmacia Bioscience公司);流式细胞仪(安捷伦公司)。
2 实验方法
2.1 细胞培养小鼠结肠癌CT26细胞用含10% FBS和1%青-链霉素双抗的1640培养基培养于37℃、5% CO2的恒温培养箱中,胰酶消化传代。
2.2 CCK-8法检测细胞活力将处于对数生长期的 CT26 细胞消化,收集细胞计数。调整细胞浓度后以 5 000/孔的密度接种到 96 孔板中(100 μL/孔),放回培养箱中继续培养过夜。次日,吸弃培养基,分为空白对照组、山楂酸(10、20、30、35、40、45、50 μmoL·L-1)组每孔加入100 μL相应浓度的药物。放回培养箱中继续培养24 h 后,每孔加入100 μL 10%的CCK-8工作液, 再放回培养箱继续孵育,1 h后使用酶标仪在450 nm波长下检测每孔的吸光度(OD)值并根据公式计算细胞活力。
细胞活力=给药处理组吸光度值/未给药空白组吸光度值×100%
2.3 流式细胞术检测细胞凋亡率将处于对数生长期的CT26细胞消化,收集细胞并计数。调整细胞浓度后以3×105孔的密度接种到 12 孔板中,放回培养箱中继续培养过夜。次日,吸弃培养基,分为空白对照组、山楂酸(10、20、30、35、40 μmoL·L-1)组,加入药物干预24 h后收集细胞,根据细胞凋亡检测试剂盒说明书进行染色,避光染色一段时间后上机检测细胞凋亡率。
2.4 RT-PCR检测mRNA表达水平将处于对数生长期的CT26细胞消化,收集细胞并计数。调整细胞浓度后以3×105孔的密度接种到12孔板中,让细胞生长贴壁过夜后,吸弃原培养基,分为空白对照组、山楂酸(10、20、30、35、40 μmoL·L-1)组,加入药物处理24 h后用 RNA 抽提试剂盒提取细胞总RNA。测定RNA 浓度后,取适量RNA进行逆转录,逆转录取cDNA上样检测。
2.5 Western blotting检测细胞蛋白表达水平将处于对数生长期的CT26 细胞消化,收集细胞并吹打混匀,制备成单细胞悬液并计数。调整细胞浓度后以8×105/孔的密度接种于 6孔板中,放回培养箱中继续培养过夜。次日,吸弃培养基,分为空白对照组、山楂酸(10、20、30、35、40 μmoL·L-1)组,加入药物干预24 h后收集细胞,裂解后提取细胞总蛋白,测定浓度后加入5×蛋白上样缓冲液,于100 ℃变性10 min后,根据蛋白浓度定量结果吸取蛋白样品经SDS-PAGE凝胶电泳,电泳结束后将蛋白转膜至PVDF膜上,无蛋白快速封闭液封闭15 min,封闭结束后加入相应的一抗, 4 ℃孵育过夜。次日,使用TBST缓冲液洗膜10 min×3次,室温孵育二抗2 h,TBST缓冲液洗膜10 min×3次。滴加ECL显影液曝光显影,使用Imagine Lab软件分析条带灰度值。
2.6 统计学方法实验数据计量资料均以均数±标准差(Mean±SD)表示,并采用 SPSS 26.0 软件进行分析。各组数据符合正态性检验时,组间比较采用单因素方差分析(One-way ANOVA); 各组数据不符合正态性检验时,组间比较采用非参数检验。P<0.05,表示具有显著差异;P<0.01,表示具有极显著差异。
3 实验结果
3.1 不同浓度山楂酸对CT26细胞活力的影响与空白组相比,CT26细胞经不同浓度山楂酸处理24 h后,细胞增殖活力降低且呈现剂量依赖性,20、30、35、40、45、50 μmoL·L-1浓度的山楂酸能降低CT26细胞活力(P<0.05)。
3.2 不同浓度山楂酸对CT26细胞凋亡的影响如图1所示,与空白组相比,CT26细胞经不同浓度山楂酸处理24 h后,30、35、40 μmoL·L-1山楂酸能显著增加CT26细胞凋亡率(P<0.05),低浓度山楂酸(10、20 μmoL·L-1)则对细胞总凋亡率无显著影响。
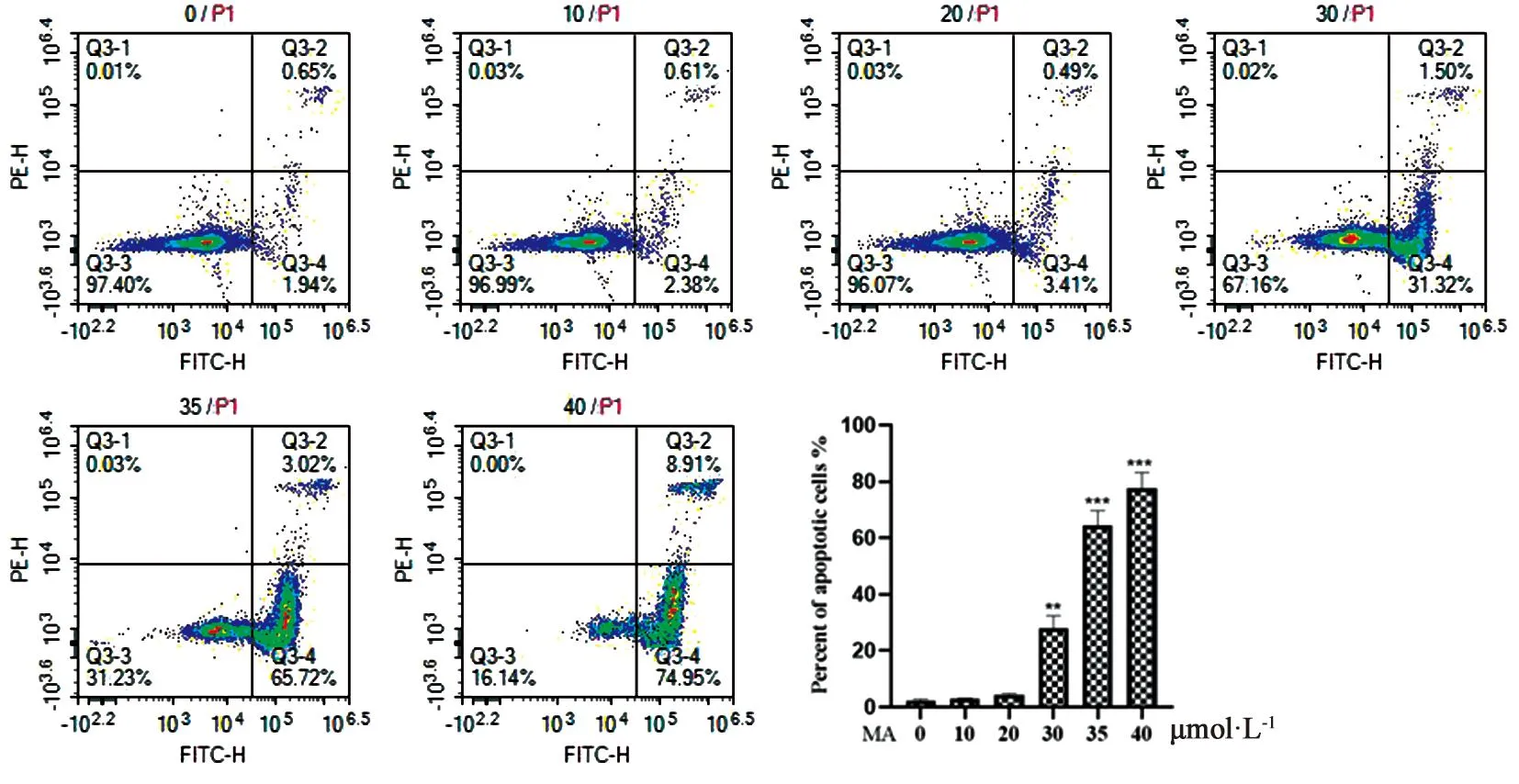
图1 山楂酸对CT26细胞凋亡的影响
3.3 不同浓度山楂酸对CT26细胞中IL-6 mRNA表达水平的影响与空白组相比,CT26细胞经不同浓度山楂酸处理24 h后,IL-6 mRNA 表达水平降低且呈现剂量依赖性,30、35、40 μmoL·L-1浓度的山楂酸能显著降低CT26细胞中IL-6 mRNA的表达水平(P<0.05)。
3.4 不同浓度山楂酸对CT26细胞中p-STAT3、STAT3蛋白表达水平的影响如图2所示,与空白组相比,CT26细胞经不同浓度山楂酸处理24 h后,30、35、40 μmoL·L-1山楂酸能显著降低细胞中p-STAT3蛋白的表达(P<0.05)。同时,如图3所示山楂酸也能够抑制IL-6刺激后CT26细胞中p-STAT3蛋白的表达水平,且在35、40 μmoL·L-1有显著差异。
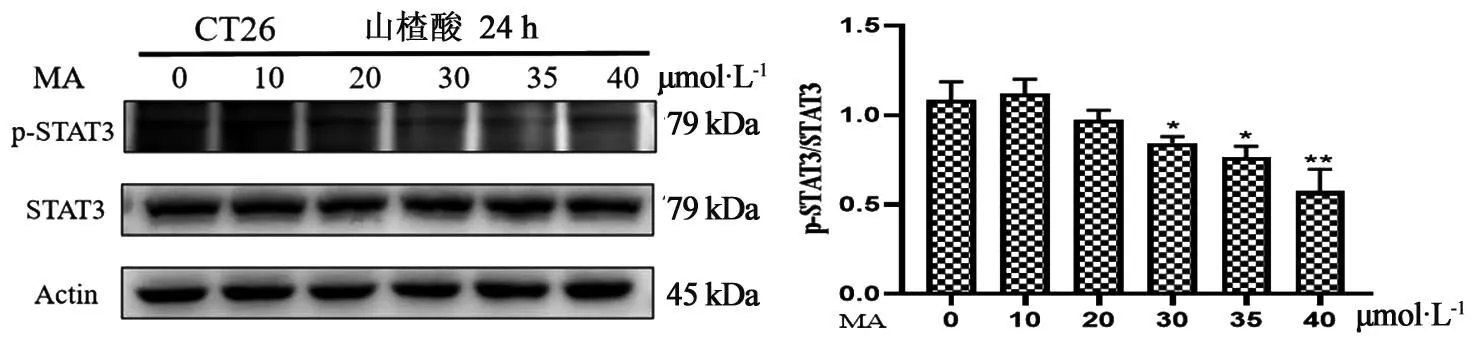
图2 山楂酸对CT26细胞中p-STAT3蛋白表达水平的影响
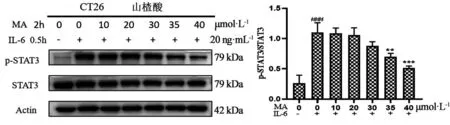
图3 山楂酸对IL-6诱导的CT26细胞中p-STAT3蛋白表达水平的影响
3.5 不同浓度山楂酸对CT26细胞中p-JAK2、JAK2、Bcl-2蛋白表达水平的影响如图4~5所示,与空白组相比,CT26细胞经不同浓度山楂酸处理24 h后,CT26细胞中p-JAK2、JAK2蛋白表达水平没有明显变化,35、40 μmoL·L-1浓度的山楂酸能显著降低Bcl-2蛋白的表达水平。
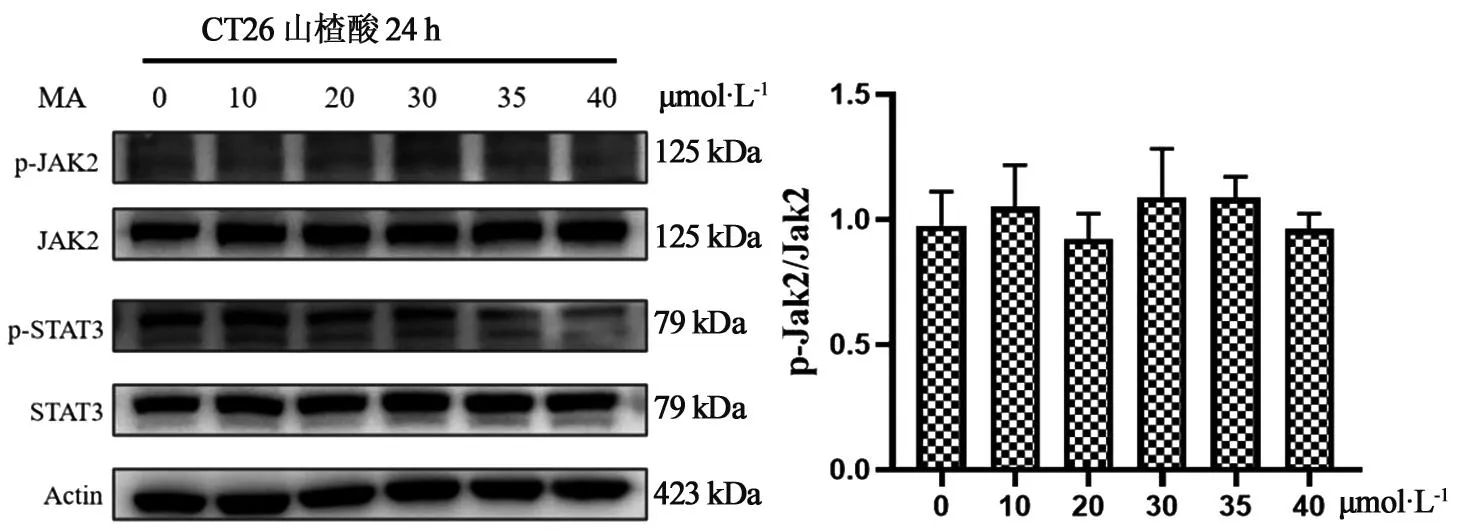
图4 山楂酸对CT26细胞中p-JAK2蛋白表达水平的影响
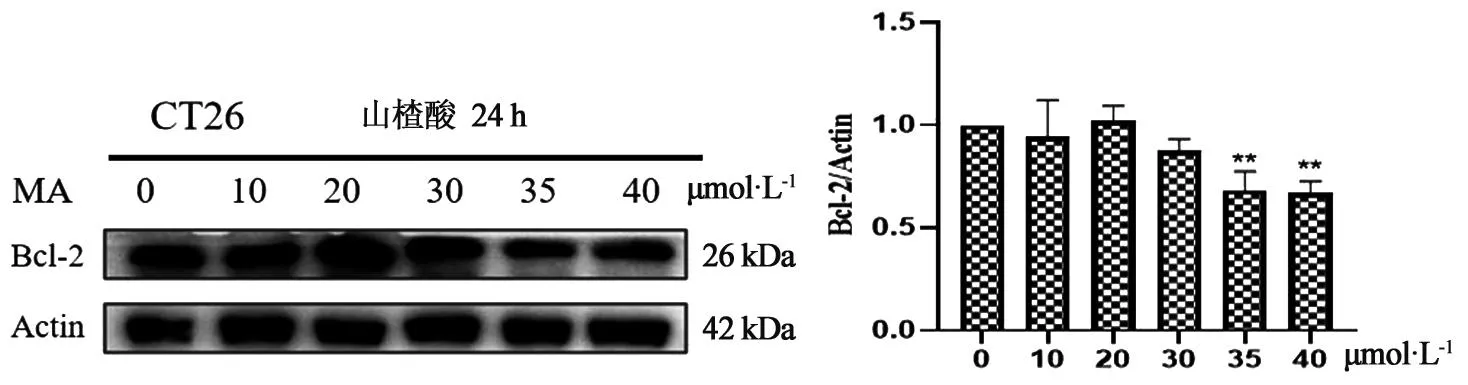
图5 山楂酸对CT26细胞中Bcl-2蛋白表达水平的影响
3.6 磷酸酶抑制剂正钒酸钠影响山楂酸对CT26细胞中p-STAT3蛋白水平的抑制作用如图6所示,与单用山楂酸组相比,40 μmoL·L-1山楂酸+50 μmoL·L-1正钒酸钠组细胞中p-STAT3蛋白的表达水平有所忧复,且与空白组细胞中p-STAT3蛋白表达水平相当。
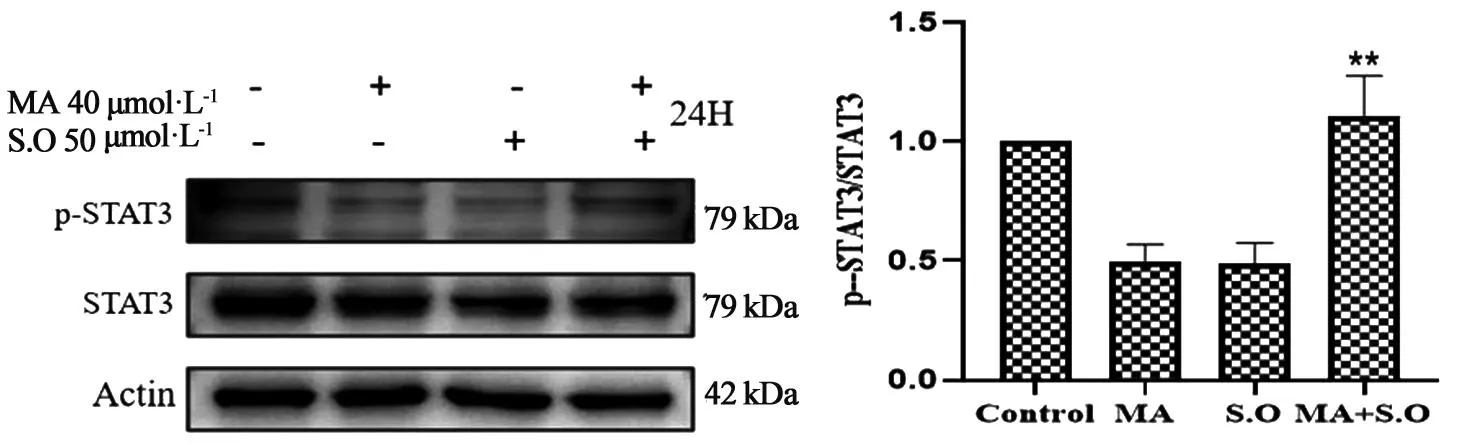
图6 山楂酸、正钒酸钠对CT26细胞中p-STAT3蛋白表达水平的影响
4 讨论
结肠癌是第三种最常见的恶性肿瘤,影响着全球数百万人。美国癌症协会发表的统计数据显示:结肠癌的发病率为 6.1%,死亡率已经达到了9.2%[11]。肿瘤细胞的异常增殖和凋亡减少是其恶性发展的基础,故肿瘤治疗的关键是抑制其增殖和促进其凋亡[12]。本研究结果显示经山楂酸处理后的CT26细胞活力降低,细胞增殖抑制率呈浓度依赖性升高;流式细胞术结果显示经山楂酸处理后的CT26细胞凋亡率增加,同时Western blotting结果显示山楂酸能够显著下调STAT3下游抗凋亡蛋白Bcl-2蛋白的表达水平。以上结果说明山楂酸可影响CT26细胞的恶性生物学,能够抑制其异常增殖并诱导凋亡,且有一定的浓度依赖性。
吸烟、饮酒过度、食炎症性肠病等是诱发结肠癌的危险因素,这其中慢性炎症与结肠癌的发病密切相关。有研究发现在结肠癌患者的血清和肿瘤组织中发现了高表达的 IL-6,且其表达水平与患者的肿瘤大小、转移情况、预后和生存率均有关[13]。IL-6 是一种促炎性细胞因子,与细胞表面的 IL-6结合受体蛋白(interleukin-6 binding receptor protein,IL-6R)结合后可引发经典信号通路途径,在细胞质中募集并激活 JAK 激酶蛋白,而后磷酸化其受体酪氨酸残基,继而激活 STAT3 的磷酸化,磷酸化的 STAT3 形成同源二聚体并发生核转位后,可结合并激活靶基因的转录,最终调节 STAT3 靶基因的表达,实现其各种生物学功能[14]。STAT3的异常活化与多种恶性肿瘤的发生与发展密切相关,已有大量研究表明抑制STAT3活化已成为抗肿瘤治疗有效手段的潜力。本研究结果显示,CT26细胞经山楂酸处理后,细胞中IL-6 mRNA的水平降低,同时细胞中p-STAT3蛋白的表达水平显著下降,这提示山楂酸能够降低细胞中IL-6的表达水平,并进一步抑制STAT3的活化。同时山楂酸也能够有效抑制IL-6所诱导的CT26细胞中的STAT3磷酸化。
STAT3在许多血液性和实体肿瘤中高度活化。肿瘤细胞中的蛋白酪氨酸激酶(RTK)直接募集Janus激酶(JAK)使JAK发生磷酸化而活化,随后活化的JAK促使STAT3的Y705位点磷酸化而活化[14]。为了进一步深入探究山楂酸是如何影响STAT3的活化,本研究检测了经山楂酸处理的CT26细胞中STAT3上游激酶p-JAK2、JAK2蛋白的表达水平,结果显示山楂酸对上游激酶p-JAK2、JAK2的蛋白表达水平没有影响。于是后期实验引入了磷酸酶抑制剂正钒酸钠进一步探究山楂酸对STAT3活化的影响,结果显示磷酸酶抑制剂可以逆转山楂酸对STAT3活性抑制,显著上调p-STAT3蛋白的表达水平。以上实验结果提示山楂酸抑制STAT3的活化可能是通过促进磷酸酶降解p-STAT3蛋白来实现的,与上游激酶JAK2无关。
综上所述,山楂酸能够抑制CT26细胞增殖,诱导细胞凋亡,且呈现一定的浓度依赖性,其可能是通过抑制STAT3信号通路相关蛋白的活化来实现的。这为山楂酸体外抗结肠癌提供了一定的实验依据,但其体内外抗结肠癌活性与机制值得进一步深入探究。

