丁酸梭菌对爱拔益加肉鸡生长性能、肠道健康和抗氧化能力的影响
王思梦 聂存喜* 姬琳堡 沈家坤 王 佩 张 濂 张 鑫
(1.石河子大学动物科技学院,石河子 832003;2.中国农业大学动物科学技术学院,动物营养学国家重点实验室,北京 100193)
在畜牧业中,抗生素的过量使用可能对动物肠道菌群造成损害,导致肠道菌群失衡,进而影响动物的消化吸收和免疫功能[1]。因此,减少或替代抗生素在养殖生产中的应用已成为畜禽养殖业亟待解决的问题[2]。我国不仅对抗生素在畜禽养殖中的应用加强了监管力度,而且广泛关注对抗生素替代品的研发工作。
作为一种生态友好且益于人类和动物健康的抗生素替代品,丁酸梭菌(Clostridiumbutyricum)不仅有助于肠道菌群的稳定,而且可以增强免疫力[3-4],这类抗生素替代品的开发因此受到了广泛关注。丁酸梭菌具有优良的特性,如产生芽孢、耐酸、耐胆盐及耐高温等[5],使其成为理想的饲料添加剂。研究表明,在饲粮中添加丁酸梭菌可以降低肉鸡盲肠中大肠杆菌、沙门氏菌数量,促进肉鸡肠道有益菌群繁殖[6]。尽管丁酸梭菌在养殖业中有着广泛的应用,但在家禽生产方面的研究还相对较少。因此,本研究旨在揭示饲粮添加丁酸梭菌对爱拔益加(AA)肉鸡生长性能、肠道健康和抗氧化能力的影响,以期提供科学、高效的抗生素替代方案及为肉鸡无抗养殖的实际应用提供一定的指导作用。
1 材料与方法
1.1 试验材料
本试验采用丁酸梭菌(SLZX19-05,CN113583915B)作为试验菌株,由农业农村部饲料工业中心分离保存。丁酸梭菌的活菌数为2.88×109CFU/g,菌株于-80 ℃低温冰箱中保存,使用前需解冻并于平板培养基中接种。
试验主要仪器包括:SPM-9500J3型原子力显微镜(日本岛津),KD-BLⅣ型包埋机(浙江省金华市科迪仪器设备有限公司),HM315型轮转式切片机(美国赛默飞),KD-THⅡ型摊烤片机(浙江省金华市科迪仪器设备有限公司),XI71型荧光显微镜(日本奥林巴斯)。
1.2 试验设计
选取1日龄AA肉仔鸡120只,随机分为2组,每组6个重复,每个重复10只,重复之间体重无显著差异(P>0.05)。对照组饲喂基础饲粮,基础饲粮为参照NRC(1994)营养需要配制的粉状配合饲料;丁酸梭菌组饲喂在基础饲粮中添加0.5%丁酸梭菌的饲粮。饲粮组成及营养水平见表1。试验期42 d,分为1~21日龄和22~42日龄2个阶段。

表1 饲粮组成及营养水平(风干基础)
1.3 饲养管理
试验前对鸡舍进行冲洗消毒,净化通风后开始使用。试验鸡采用笼养,自由采食和饮水。光照24 h/d,温度第1周保持37 ℃,后面每周降3 ℃,直到27 ℃为止。试验鸡的鸡舍卫生管理、饲养管理及免疫规章均按照AA肉鸡饲养方法进行。
1.4 样品采集与指标测定
1.4.1 样品采集
试验结束时,每个重复随机选取2只鸡,翅静脉采血,3 000 r/min离心15 min,取上清液于-20 ℃保存,用于血清抗氧化指标的测定;试验鸡采血后屠宰,采集1~2 cm十二指肠、空肠、回肠及其内容物迅速放入2 mL无菌EP管中,于-80 ℃保存;并采集2~3 cm的肠段放入装有甲醛溶液的50 mL离心管中备用。
1.4.2 生长性能测定
饲养期间以重复为单位记录鸡的喂料量、剩余料量、初始体重和终末体重,计算试验鸡各阶段的平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G),计算公式为:
平均日增重=(终末体重-初始体重)/(试验天数×肉鸡只数);平均日采食量=总耗料量/(试验天数×肉鸡只数);料重比=平均日采食量/平均日增重。
1.4.3 肠道形态结构测定
将十二指肠、空肠和回肠样品用0.9%生理盐水冲洗后于组织固定液中固定24 h,制作石蜡切片,采用苏木精-伊红(HE)染色后进行镜检,测定绒毛高度和隐窝深度,并计算绒隐比(绒毛高度/隐窝深度)。
1.4.4 抗氧化能力测定
称取0.1 g解冻的样品,加入0.9 mL预冷的缓冲液,在冰浴条件下进行匀浆,然后于4 ℃、3 000 r/min离心10 min,取上清液。采用试剂盒测定血清和肠道总超氧化物歧化酶(total superoxide dismutase,T-SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GPS-Px)活性以及总抗氧化能力(total antioxidant capacity,T-AOC)和丙二醛(MDA)含量,试剂盒由南京建成生物工程研究所提供,测定方法按照试剂盒说明书进行。
1.4.5 空肠抗氧化和炎症相关基因表达量测定
根据RNA提取试剂盒说明,从每组各取4个空肠样本,从空肠组织中提取总RNA[7]。采用分光光度计对RNA浓度进行测定,当260~280 nm处吸光度值在1.8~2.2,说明提取的RNA质量较好。使用TB Green®Premix Ex TaqTMⅡ进行逆转录,扩增总体积为10 μL,其中包括0.4 μL上游引物、0.4 μL下游引物、1.0 μL cDNA、5.0 μL TB Green®Premix Ex TaqTMⅡ和3.2 μL焦碳酸二乙酯(DEPC)水。实时荧光定量PCR程序如下:95 ℃变性30 s,95 ℃变性5 s,然后60 ℃退火和延伸20 s,40个循环。目标基因和参考基因(β-肌动蛋白)的引物序列见表2,目标基因的mRNA相对表达量采用2-ΔΔCt方法进行计算。

表2 实时荧光定量PCR引物序列
1.5 数据统计分析
试验数据采用SPSS 20.0软件进行组间t检验分析,结果数据用“平均值±标准差”表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 丁酸梭菌对肉鸡生长性能的影响
丁酸梭菌对肉鸡生长性能的影响见表3。与对照组相比,丁酸梭菌组肉鸡42日龄体重以及22~42日龄和1~42日龄平均日增重显著或极显著提高(P<0.05或P<0.01),22~42日龄料重比显著降低(P<0.05);饲粮添加丁酸梭菌对肉鸡平均日采食量无显著影响(P>0.05)。由此可见,饲粮添加丁酸梭菌可以提高肉鸡生长性能,特别是对生长后期提高作用更加明显。

表3 丁酸梭菌对肉鸡生长性能的影响
2.2 丁酸梭菌对肉鸡肠道形态结构的影响
丁酸梭菌对肉鸡肠道形态结构的影响如图1和图2所示。无论是对照组还是丁酸梭菌组肉鸡,其肠道各肠段绒毛结构均较为完整,没有观察到明显的脱落或损伤,绒毛密度也没有明显变化。与对照组相比,丁酸梭菌组肉鸡十二指肠绒毛高度极显著提高(P<0.01),回肠隐窝深度显著降低(P<0.05),回肠和十二指肠绒隐比显著或极显著提高(P<0.05或P<0.01)。结果表明,饲粮添加丁酸梭菌能够改善肉鸡肠道形态结构。

A:空肠 jejunum;B:回肠 ileum;C:十二指肠 duodenum。

*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。下图同。
2.3 丁酸梭菌对肉鸡抗氧化能力的影响
丁酸梭菌对肉鸡血清抗氧化指标的影响见表4。与对照组相比,丁酸梭菌组肉鸡血清T-SOD活性显著提高(P<0.05),血清MDA含量极显著降低(P<0.01),其他血清抗氧化指标无显著差异(P>0.05)。丁酸梭菌对肉鸡肠道抗氧化指标的影响见表5。与对照组相比,丁酸梭菌组肉鸡空肠T-AOC和回肠T-SOD活性极显著提高(P<0.01),回肠MDA含量极显著降低(P<0.01)。结果表明,饲粮添加丁酸梭菌能够提高肉鸡抗氧化能力。
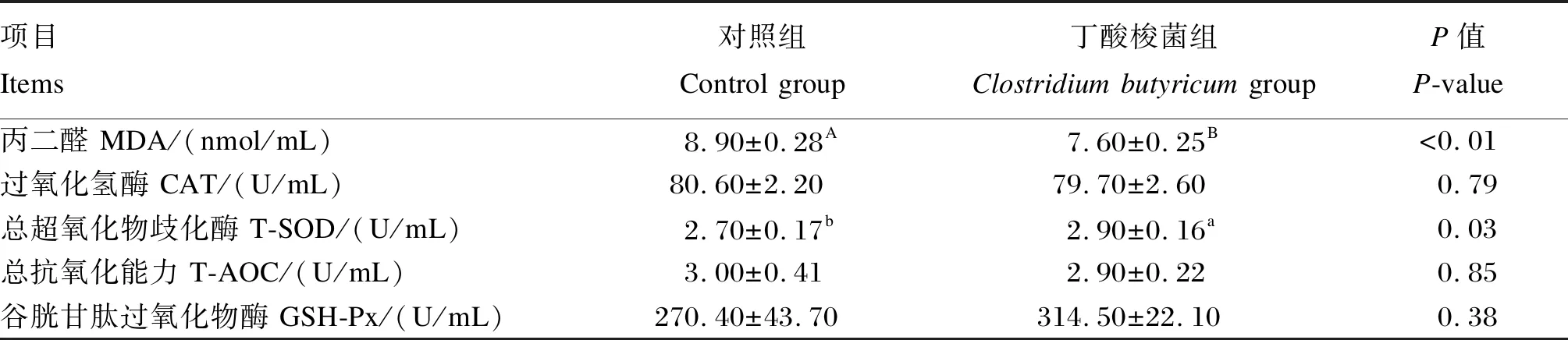
表4 丁酸梭菌对肉鸡血清抗氧化指标的影响

表5 丁酸梭菌对肉鸡肠道抗氧化指标的影响
丁酸梭菌对肉鸡空肠抗氧化相关基因表达的影响如图3所示。与对照组相比,丁酸梭菌组肉鸡空肠中核因子E2相关因子2(Nrf2)、CAT和血红素氧合酶-1(HO-1)的mRNA相对表达量显著提高(P<0.05),空肠中超氧化物歧化酶(SOD)和GSH-Px的mRNA相对表达量无显著差异(P>0.05)。

图3 丁酸梭菌对肉鸡空肠抗氧化相关基因表达的影响
2.4 丁酸梭菌对肉鸡空肠炎症相关基因表达的影响
丁酸梭菌对肉鸡空肠炎症相关基因表达的影响如图4所示。与对照组相比,丁酸梭菌组肉鸡空肠中闭合蛋白(occludin)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)和白细胞介素-1β(IL-1β)的mRNA相对表达量均无显著差异(P>0.05)。结果表明,饲粮添加丁酸梭菌对肉鸡空肠炎症相关基因表达没有显著影响。
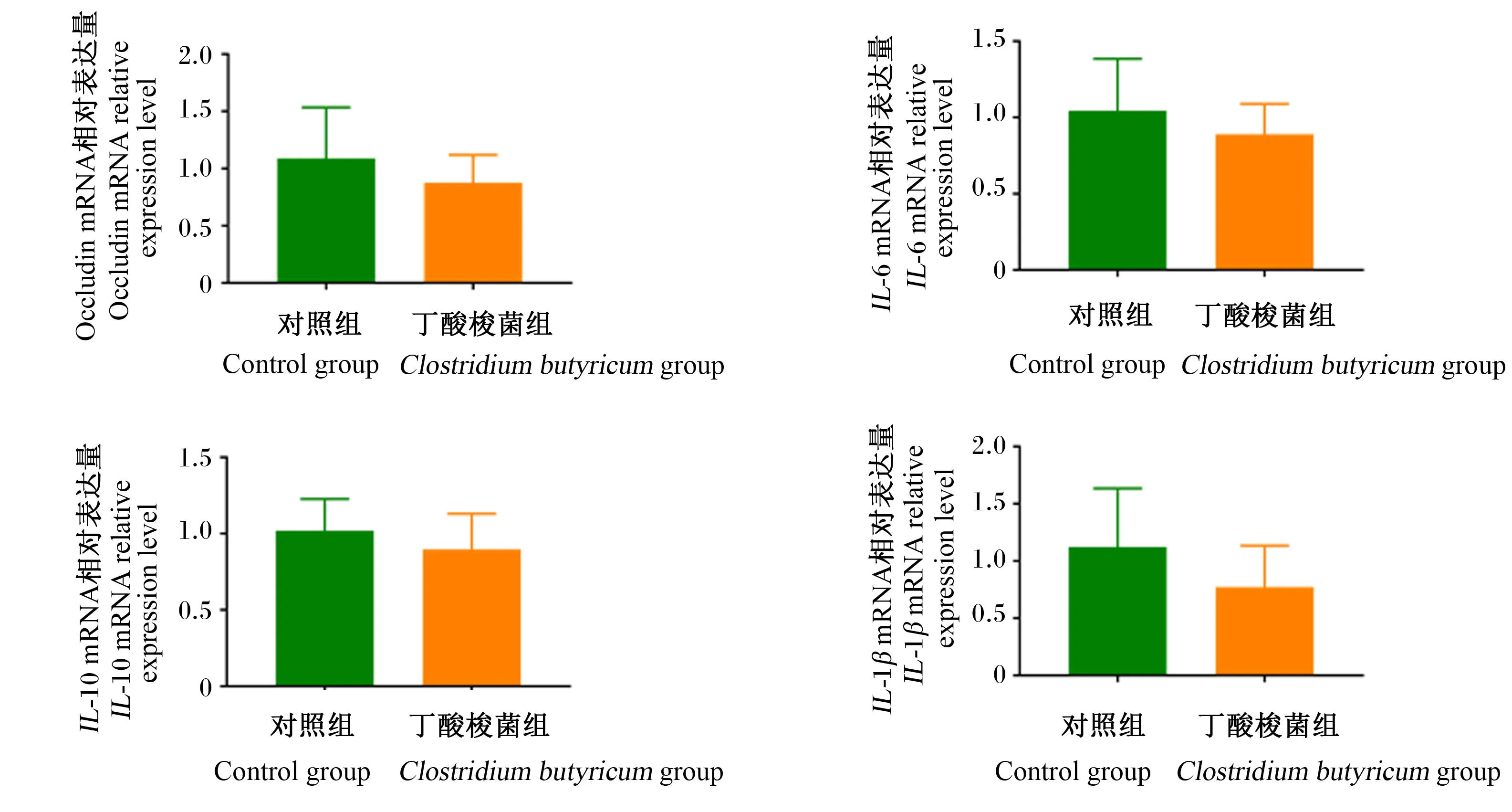
图4 丁酸梭菌对肉鸡空肠炎症相关基因表达的影响
3 讨 论
3.1 丁酸梭菌对肉鸡生长性能的影响
丁酸梭菌能够促进益生菌的生成,减少疾病的产生,从而维护宿主健康[8];丁酸梭菌还能够显著改善畜禽的生产和饲喂效率,其在肠黏膜中合成的丁酸能够刺激肠黏膜的增生,提高胃肠的消化能力[9]。本试验结果表明,饲粮添加丁酸梭菌能够提高肉鸡42日龄体重以及22~42日龄和1~42日龄平均日增重,降低22~42日龄料重比。研究表明,饲粮添加250 mg/kg丁酸梭菌对鹅的生长发育、肠道抗氧化能力和肠道微生物组成均有积极影响[10]。饲粮添加1×109CFU/kg丁酸梭菌能够改善AA肉鸡生长性能和平均日增重[11]。这主要是因为丁酸梭菌能够产生淀粉酶、蛋白酶和纤维素酶等,提高有益菌群在肠道中的定植,进一步促进养分的吸收和利用,从而提高了肉鸡的生长发育速度[12]。也有研究表明,在饲粮中添加丁酸梭菌后,肉鸡的生长发育没有变化[13]。这可能是由于饲粮类型、肉鸡品种和生长阶段以及添加剂量不同等原因造成的。
3.2 丁酸梭菌对肉鸡肠道形态结构的影响
肠道组织形态是评价肠道健康的重要依据,绒毛高度、隐窝深度和绒隐比反映了机体对营养物质消化和吸收的效率,是衡量肠道功能的重要指标。农斯伟等[14]研究发现,饲粮添加丁酸梭菌有提高广西黎村黄鸡十二指肠、空肠和回肠绒毛高度的趋势,显著降低空肠隐窝深度,并显著提高空肠和回肠绒隐比。李莹等[12]研究表明,饲粮添加丁酸梭菌能够显著提高白羽肉鸡十二指肠绒毛高度和绒隐比,显著降低其隐窝深度,并显著提高回肠绒毛高度和绒隐比。本试验结果表明,饲粮添加丁酸梭菌显著提高了肉鸡十二指肠绒毛高以及回肠和十二指肠绒隐比,并显著降低了回肠隐窝深度。这说明丁酸梭菌能够通过促进肉鸡肠道的发育,保持肠道健康。
3.3 丁酸梭菌对肉鸡抗氧化能力的影响
氧化应激是一种普遍存在于生物体中表现为机体活性氧(ROS)升高的现象,能够引起脂质、蛋白质及DNA等的破坏[15-16]。研究发现,饲粮添加丁酸梭菌能够显著提高蛋鸡血清T-AOC,降低血清和回肠MDA含量,并提高血清和回肠T-SOD活性[17]。研究还发现,在仔猪饲粮添加丁酸梭菌能够降低机体的氧化压力,并使其氧化还原达到均衡状态[18]。本试验结果表明,饲粮添加丁酸梭菌显著提高肉鸡血清T-SOD活性、空肠T-AOC和回肠T-SOD活性,显著降低血清和回肠MDA含量。前人的研究结果也证实了这一结论,在獭兔饲粮中添加1.0×105CFU/g的丁酸梭菌,能够改善肠道形态结构和抗氧化状态[19];饲粮添加5×108CFU/g丁酸梭菌可以提高肉鸡血清T-SOD活性和T-AOC,降低血清MDA含量[20]。
3.4 丁酸梭菌对肉鸡空肠抗氧化和炎症相关基因表达的影响
在氧化应激反应中,Nrf2作为一个关键的转录因子,能够激活下游途径的抗氧化蛋白,包括HO-1和还原型烟酰胺腺嘌呤二核苷酸(磷酸)[NAD(P)H],以及刺激具有抗氧化特性蛋白的产生来控制细胞的氧化应激[21]。肠道黏膜屏障作为免疫系统的第一道防线,对维持肠道免疫系统的稳定十分重要[22]。肠道黏膜屏障受损会使肠道菌群发生迁移,从而引发炎症[23]。occludin作为肠道上皮细胞之间紧密连接的结构蛋白,不仅能够反映肠道的炎症程度,而且在肠道黏膜愈合过程中起着至关重要的作用[24-25]。丁酸梭菌可调控肠黏膜微生态及pH,在维持肠黏膜结构及功能方面发挥着重要功能[9]。本研究发现,饲粮添加丁酸梭菌可以显著提高肉鸡空肠中Nrf2、CAT和HO-1的mRNA相对表达量,提高肠道的抗氧化能力,这与以前的研究结果[26]一致。研究表明,丁酸梭菌能够激活Nrf2信号通路,提高Nrf2、HO-1、SOD和CAT的表达量[27]。不过,丁酸梭菌对空肠中SOD和GSH-Px的mRNA相对表达量无显著影响,这可能是因为Nrf2路径对SOD和GSH-Px的调控机制较为复杂,或者需要更长时间才能观察到丁酸梭菌的影响。尽管如此,本试验结果仍然突显了丁酸梭菌对肉鸡肠道抗氧化能力的积极效果,且可能是通过激活Nrf2路径,进一步增强Nrf2、CAT和HO-1的表达实现的。
IL-6和IL-10可以反映机体炎症水平,炎症的发生和IL-6的产生会改变许多器官的功能,并导致整个循环系统许多化学反应的发生,包括转铁蛋白、纤维蛋白和白蛋白水平的降低[28]。在免疫反应的急性阶段,IL-10通过降低促炎症细胞因子水平和促进组织修复来保护宿主免受组织损伤,从而限制促炎症反应[29]。在一些物种中,IL-10已被证明是控制宿主防御期间肠道平衡的最有力的抗炎细胞因子之一[30]。本研究发现,饲粮添加丁酸梭菌对肉鸡空肠occludin、IL-6、IL-10和IL-1βmRNA相对表达量均无显著影响,这可能与生长阶段和添加的丁酸梭菌数量有关。
4 结 论
① 饲粮添加丁酸梭菌能够提高肉鸡生长性能,特别是对生长后期提高作用更加明显。
② 饲粮添加丁酸梭菌可以改善肉鸡肠道形态结构。
③ 饲粮添加丁酸梭菌可以提高血清T-SOD活性,降低血清MDA含量,并通过Nrf2信号通路提高肠道抗氧化能力。

