辣蓼黄酮通过调控核因子E2相关因子2信号通路及组蛋白乙酰化缓解伪狂犬病毒感染小鼠诱导的脾脏和肺脏氧化应激
韦玉衡 赵雅琪 陈 奇 周家芳 周淑棉 胡庭俊*
(1.广西大学动物科学技术学院,南宁 530004;2.贵港市动物疫病预防控制中心,贵港 537100)
伪狂犬病毒(PRV)可感染猪、羊、牛、鼠等动物,引起严重的临床症状和急性死亡[1]。猪是其主要宿主和传染源,各年龄段的猪只均易感染,可引起母猪繁殖障碍,仔猪出现严重的呼吸道症状和神经症状,甚至死亡;猪只感染后终生带毒,且持续排毒,猪场净化不到位将导致该病反复感染,导致重大经济损失[2]。由于PRV感染侵害呼吸系统,因此选择肺脏为研究目标之一。脾脏是机体最大的免疫器官,占全身淋巴组织总量的25%,含有大量的淋巴细胞和巨噬细胞,是机体细胞免疫和体液免疫的中心,通过多种机制发挥抗病毒和抗肿瘤等作用,因此选择脾脏为研究目标之一。
除在中间宿主体内传播之外,Li等[3]发现养猪场环境中广泛存在PRV污染,PRV可以通过病毒污染的污染物从猪传播给其他动物。Liu等[4]从急性人脑炎病例中分离出一种PRV毒株,该分离株与我国PRV变异株具有密切的系统发育关系和相似的病原学特征,表明PRV对公共卫生和养猪业均具有潜在的威胁。
据报道,辣蓼化学成分主要包括有机酸、黄酮类和萜类等,具有抗菌、抗氧化、抗炎、抗病毒、杀虫等生物活性[5]。研究发现,辣蓼黄酮可以通过调节病毒感染免疫细胞内炎性因子含量来干预炎症反应[6]。匡娜等[7]研究发现,辣蓼黄酮可以通过降低活性氧(ROS)和一氧化氮(NO)含量,有效缓解脂多糖(LPS)造成的氧化应激损伤和炎症反应。辣蓼黄酮正丁醇部分(FNB)可以使小鼠耳肿胀程度极显著降低,表明其对小鼠具有一定的抗炎作用[8]。辣蓼总黄酮无急性毒性作用,也无亚慢性毒性作用[9]。病毒感染会导致小鼠神经瘤细胞内ROS、丙二醛(MDA)含量上升,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性降低,核因子E2相关因子2(Nrf2)和血红素加氧酶-1(HO-1)的mRNA和蛋白表达上升,造成氧化应激损伤[10]。抗氧化酶的表达受到转录因子Nrf2的调控[11],通过使用抗氧化剂维持机体氧化与抗氧化平衡,对病毒感染有一定的治疗效果[12]。
组蛋白乙酰化是表观遗传学中一种重要的后修饰类型,因为它影响DNA缠绕组蛋白并包装成染色质的方式[13]。组蛋白乙酰化是由组蛋白乙酰转移酶(HAT)和组蛋白去乙酰化酶(HDAC)完成的,组蛋白乙酰化状态取决于HDAC和HAT活性之间的动态平衡[14]。组蛋白乙酰化在内的表观遗传修饰导致的异常表观遗传模式被认为是炎症性系统性疾病的发生及细胞和机体氧化应激损伤的重要原因。研究表明,病毒通过介导宿主组蛋白乙酰化水平来调节炎症因子的表达[15]。Cao等[16]发现,三七皂苷对猪圆环病毒2型诱导的氧化应激和组蛋白乙酰化具有调控作用。由于辣蓼黄酮具有良好的抗氧化和抗炎活性,我们推测其可能通过调节组蛋白乙酰化水平并调控Nrf2氧化应激通路相关因子的表达,进而缓解PRV感染小鼠诱导的脾脏和肺脏氧化应激。
因此,本研究采用PRV感染小鼠造成其氧化应激,通过荧光定量PCR(q-PCR)、免疫组化和蛋白免疫印迹(Western Blot)等方法,观察辣蓼黄酮对Nrf2氧化应激信号通路相关因子的mRNA和蛋白表达的影响,并观察组蛋白乙酰化是否受到调控,进而阐明辣蓼黄酮缓解PRV感染小鼠诱导的脾脏和肺脏氧化应激的分子机制。
1 材料与方法
1.1 病毒和药物
猪PRV株(PRV-GXLB-2013)由广西大学动物科学技术学院预防兽医学教研室赠予,经测定其组织半数感染量(TCID50)=10-6.75/0.1 mL。辣蓼购自广西壮族自治区南宁市山草堂,由广西大学动物科学技术学院兽医药理实验室提取总黄酮。维生素C(VC)购自索莱宝公司。
1.2 主要试剂
Trizol试剂盒购自TaKaRa公司;Nrf2抗体、HO-1抗体、依赖还原型辅酶Ⅰ(Ⅱ)醌氧化还原酶1(NQO1)抗体、诱导型一氧化氮合酶(iNOS)抗体、辣根过氧化物酶连接的兔抗免疫球蛋白G(IgG)均购自Abcam公司;广谱免疫组化检测试剂盒购自博奥森生物技术有限公司;脱脂奶粉购自武汉赛维尔生物科技有限公司;β-肌动蛋白(β-actin)抗体、乙酰化组蛋白H3(AcH3)抗体和乙酰化组蛋白H4(AcH4)抗体均购自CST公司。
1.3 试验动物
无特定病原体(SPF)级昆明种小鼠,体重(20±2) g,雌雄各占1/2,购自广西医科大学实验动物中心(SYXK桂2014-0003)。于鼠笼恒温饲养,自由采食,适应7 d以适应新环境。
1.4 试验设计
将60只小鼠随机分为6组,每组10只,雌性各占1/2。6组分别为空白对照组、PRV组、VC组以及辣蓼黄酮高、中、低剂量组。空白对照组小鼠肌肉注射杜氏改良Eagle培养液(DMEM)0.1 mL/只,其他5组小鼠肌肉注射联合滴鼻接种10×TCID50PRV病毒液0.1 mL/只;2 h后,空白对照组和PRV组小鼠灌服100 mg/kg BW的DMEM,辣蓼黄酮高、中、低剂量组分别灌服200、100和50 mg/kg BW的辣蓼黄酮混悬液,VC组灌服100 mg/kg BW的VC,各组灌服量均为0.2 mL,VC及高、中、低剂量的辣蓼黄酮溶于DMEM对小鼠进行灌胃。连续灌胃7 d,每天1次。各试验组小鼠于感染后的第7天剖杀,取脾脏、肺脏组织测定mRNA和蛋白表达。
1.5 Nrf2氧化应激信号通路相关mRNA及HDAC和HAT mRNA表达的测定
采样后用Trizol法取组织总RNA,将RNA反转录为cDNA后,通过q-PCR方法检测小鼠脾脏、肺脏组织中iNOS、HO-1、NQO1、Nrf2、HAT和HDAC的mRNA表达水平。各基因引物序列见表1。q-PCR结果以β-actin为内参基准分析,通过2-ΔΔCt计算各基因的表达水平。

表1 各基因引物序列
1.6 免疫组化检测小鼠肺脏组织iNOS及Nrf2氧化应激信号通路相关蛋白表达
采样后,将固定的组织进行二次取材,经梯度脱水、透明和包埋后,切下4 μm厚度的石蜡片。再对石蜡切片进行避光阻断、微波修复等处理,同时按1∶1 000稀释iNOS、Nrf2、HO-1和NQO1等抗体,于4 ℃过夜孵育。而后,按1∶1稀释二抗并孵育,经二氨基联苯胺(DAB)避光显色和苏木精衬染后,使用甘油明胶封片。最后在光学显微镜下观察并采图分析,通过Image J软件计算平均光密度值。
1.7 Western Blot检测小鼠脾脏、肺脏组织AcH3和AcH4蛋白表达
采样后,提取小鼠脾脏、肺脏组织蛋白,测定蛋白浓度,通过Western Blot测定AcH3和AcH4的蛋白表达水平。首先配制十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶,待凝胶于电泳槽内凝固后,加入蛋白样品进行电泳。以标记物(Marker)为参考,选取所需要的目的蛋白和内参蛋白所在位置,将其余部分胶裁去,再根据胶面积裁剪出对应大小的聚偏二氟乙烯(PVDF)膜。将PVDF膜放入甲醇中活化,再使用与PVDF膜相当大小的厚滤纸按三明治结构包夹凝胶和PVDF膜,置于半干转膜仪上,恒流转膜。转膜结束后,使用5%的脱脂奶粉封闭PVDF膜2 h。最后,将PVDF膜放入1∶1 000稀释的AcH3和AcH4抗体中,低温过夜孵育,次日孵育1∶400稀释后的二抗,便可于蛋白成像仪观察蛋白条带,通过Image J计算灰度值。
1.8 数据分析
试验数据使用SPSS 21.0统计软件进行单因素方差分析,选择LSD检验进行差异性分析。结果用平均值±标准误表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 辣蓼黄酮对PRV感染小鼠脾脏和肺脏组织中iNOS和Nrf2 mRNA表达的影响
如表2所示,与空白对照组相比,PRV组脾脏组织中iNOS的mRNA表达水平显著升高(P<0.05),肺脏组织中iNOS的mRNA表达水平极显著升高(P<0.01)。与PRV组相比,VC组及辣蓼黄酮高、中、低剂量组肺脏组织中iNOS的mRNA表达水平极显著降低(P<0.01)。
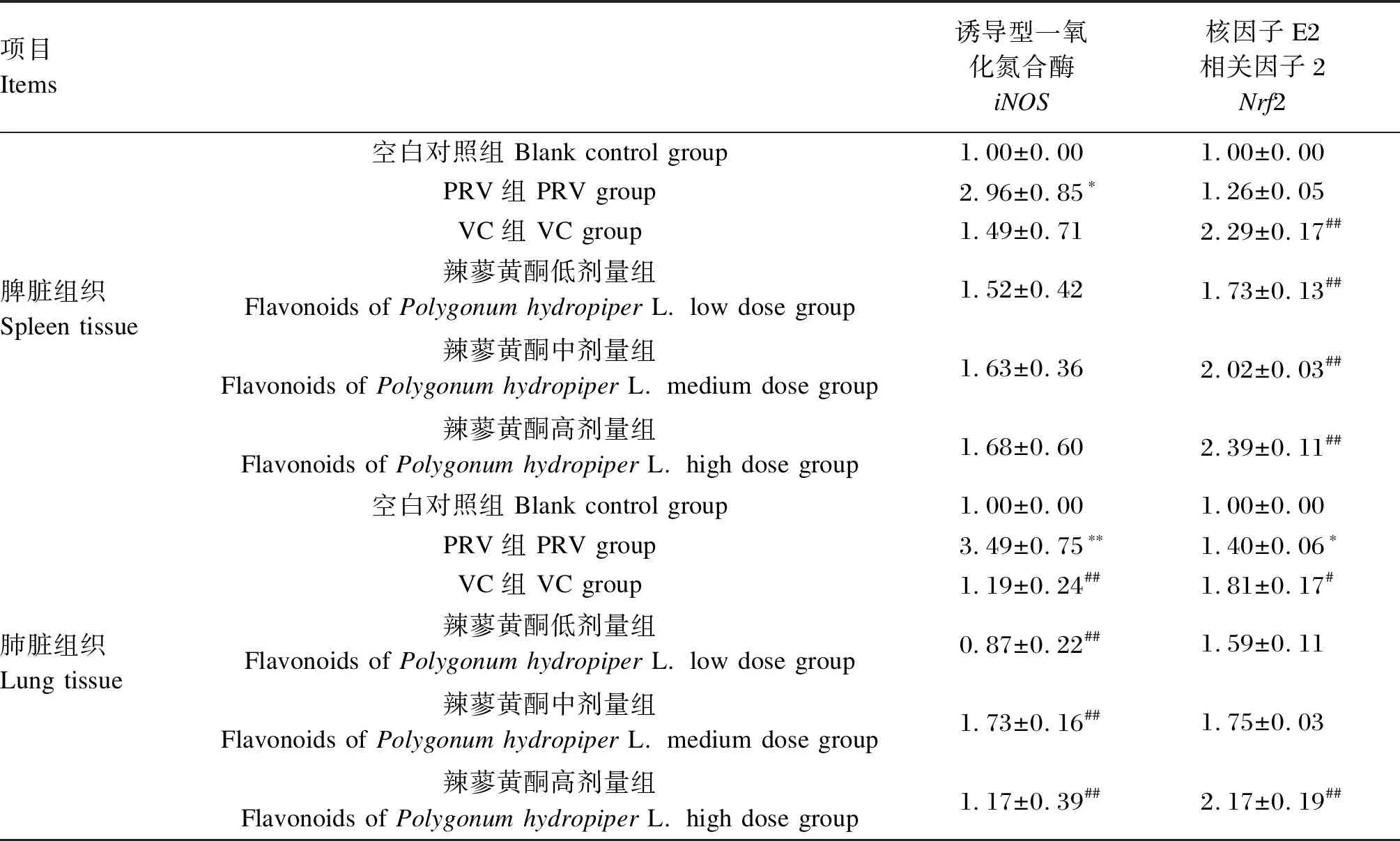
表2 辣蓼黄酮对PRV感染小鼠脾脏和肺脏组织中iNOS和Nrf2 mRNA表达的影响
与空白对照组相比,PRV组肺脏组织中Nrf2的mRNA表达水平显著升高(P<0.05)。与PRV组相比,VC组及辣蓼黄酮高、中、低剂量组脾脏中Nrf2的mRNA表达水平极显著升高(P<0.01),VC组及辣蓼黄酮高剂量组肺脏组织中Nrf2的mRNA表达水平显著或极显著升高(P<0.05或P<0.01)。
2.2 辣蓼黄酮对PRV感染小鼠脾脏和肺脏组织中HO-1和NQO-1 mRNA表达的影响
如表3所示,与空白对照组相比,PRV组脾脏组织中HO-1的mRNA表达水平极显著降低(P<0.01),肺脏组织中HO-1的mRNA表达水平显著升高(P<0.05)。与PRV组相比,VC组及辣蓼黄酮高、中、低剂量组脾脏组织中HO-1的mRNA表达水平极显著升高(P<0.01),VC组及辣蓼黄酮高、中剂量组肺脏组织中HO-1的mRNA表达水平显著或极显著降低(P<0.05或P<0.01)。

表3 辣蓼黄酮对PRV感染小鼠脾脏和肺脏组织中HO-1和NQO1 mRNA表达的影响
与空白对照组相比,PRV组肺脏组织中NQO1的mRNA表达水平显著升高(P<0.05)。与PRV组相比,VC组及辣蓼黄酮高、中剂量组脾脏组织中NQO1的mRNA表达水平极显著升高(P<0.01),VC组及辣蓼黄酮高剂量组肺脏组织中NQO1的mRNA表达水平显著或极显著升高(P<0.05或P<0.01)。
2.3 辣蓼黄酮对PRV感染小鼠脾脏和肺脏组织中HAT和HDAC mRNA表达的影响
如表4所示,与空白对照组相比,PRV组脾脏和肺脏组织中HAT的mRNA表达水平极显著升高(P<0.01)。与PRV组相比,VC组及辣蓼黄酮高、中、低剂量组脾脏和肺脏组织中HAT的mRNA表达水平极显著降低(P<0.01)。

表4 辣蓼黄酮对PRV感染小鼠脾脏和肺脏组织中HAT和HDAC mRNA表达的影响
与空白对照组相比,PRV组脾脏组织中HDAC的mRNA表达水平极显著降低(P<0.01)。与PRV组相比,VC组及辣蓼黄酮高、中、低剂量组脾脏组织中HDAC的mRNA表达水平极显著升高(P<0.01),VC组及辣蓼黄酮中、低剂量组肺脏组织中HDAC的mRNA表达水平显著升高(P<0.05)。
2.4 辣蓼黄酮对PRV感染小鼠肺脏组织中iNOS和Nrf2蛋白表达的影响
如图1所示,肺脏组织中iNOS蛋白在PRV组有较多的阳性表达,显示为棕黄色或棕褐色,主要分布在支气管上皮细胞的胞浆中。如表5所示,与空白对照组相比,PRV组肺脏组织中iNOS的蛋白表达水平极显著升高(P<0.01)。与PRV组相比,VC组及辣蓼黄酮高、低剂量组肺脏组织中iNOS的蛋白表达水平极显著降低(P<0.01)。

A:空白对照组;B:PRV组;C:VC组;D:辣蓼黄酮低剂量组;E:辣蓼黄酮中剂量组;F:辣蓼黄酮高剂量组;比例尺:50 μm。下图同。

表5 辣蓼黄酮对PRV感染小鼠肺脏组织中iNOS和Nrf2蛋白表达的影响
如图2所示,肺脏组织中Nrf2蛋白在各试验组均有阳性表达,显示为棕褐色,主要分布在肺泡细胞和血管上皮细胞的胞浆中,同时Nrf2蛋白在支气管上皮细胞的胞核中亦有表达。如表5所示,与空白对照组相比,PRV组肺脏组织中Nrf2的蛋白表达水平极显著升高(P<0.01)。与PRV组相比,VC组肺脏组织中Nrf2的蛋白表达水平极显著升高(P<0.01),而辣蓼黄酮高、中、低剂量组肺脏组织中Nrf2的蛋白表达水平差异不显著(P>0.05)。
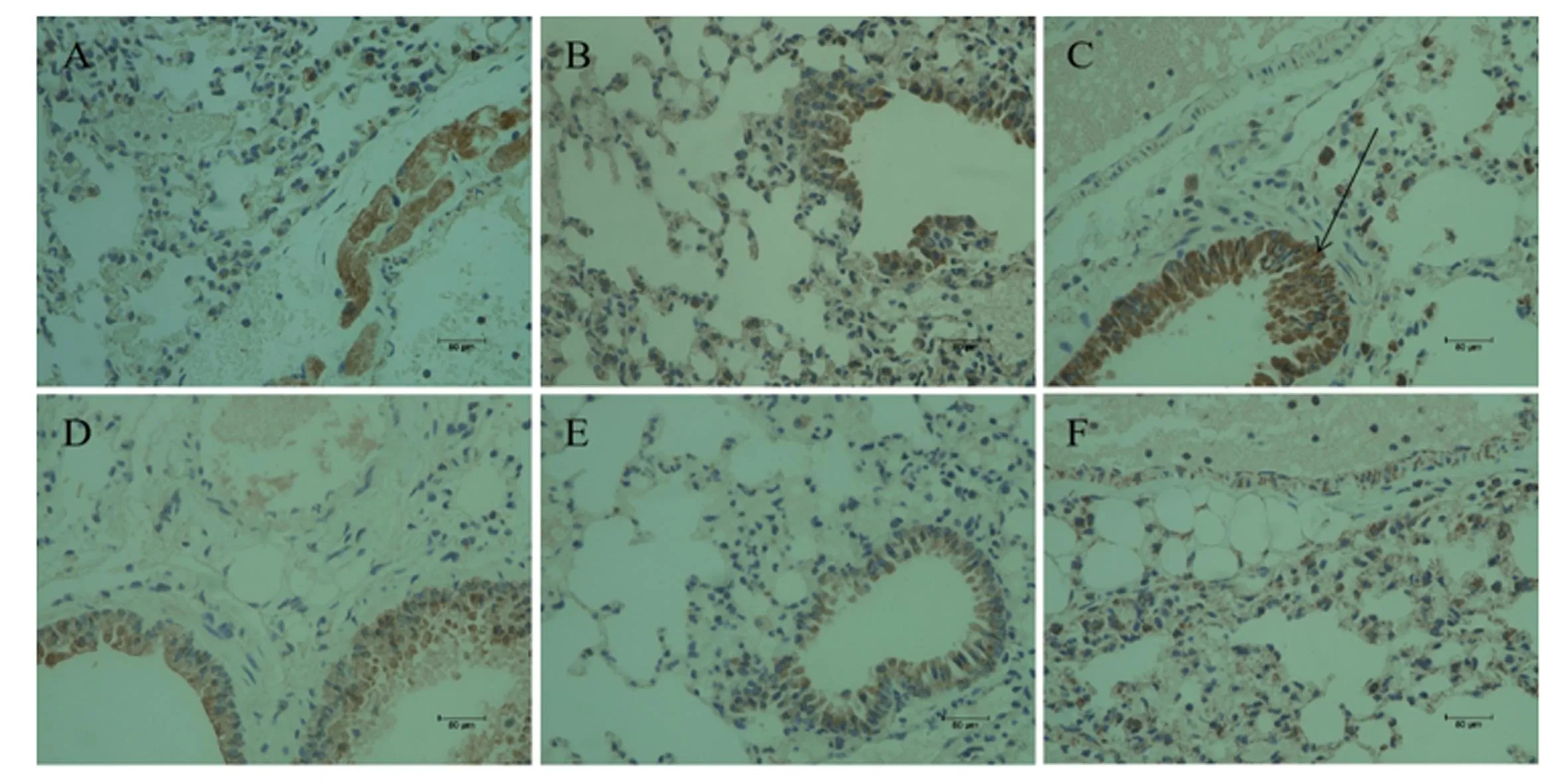
图2 PRV感染小鼠肺脏组织中Nrf2蛋白免疫组化切片图
2.5 辣蓼黄酮对PRV感染小鼠肺脏组织中HO-1和NQO1蛋白表达的影响
如图3所示,肺脏组织中HO-1蛋白在各试验组均有阳性表达,主要分布在胞浆或支气管上皮细胞的胞浆或胞核中,肺泡细胞中也有少许分布,呈棕黄色或棕褐色。如表6所示,与空白对照组相比,PRV组肺脏组织中HO-1的蛋白表达水平有所降低,但差异不显著(P>0.05)。与PRV组相比,VC组及辣蓼黄酮高、低剂量组肺脏组织中HO-1的蛋白表达水平极显著升高(P<0.01)。
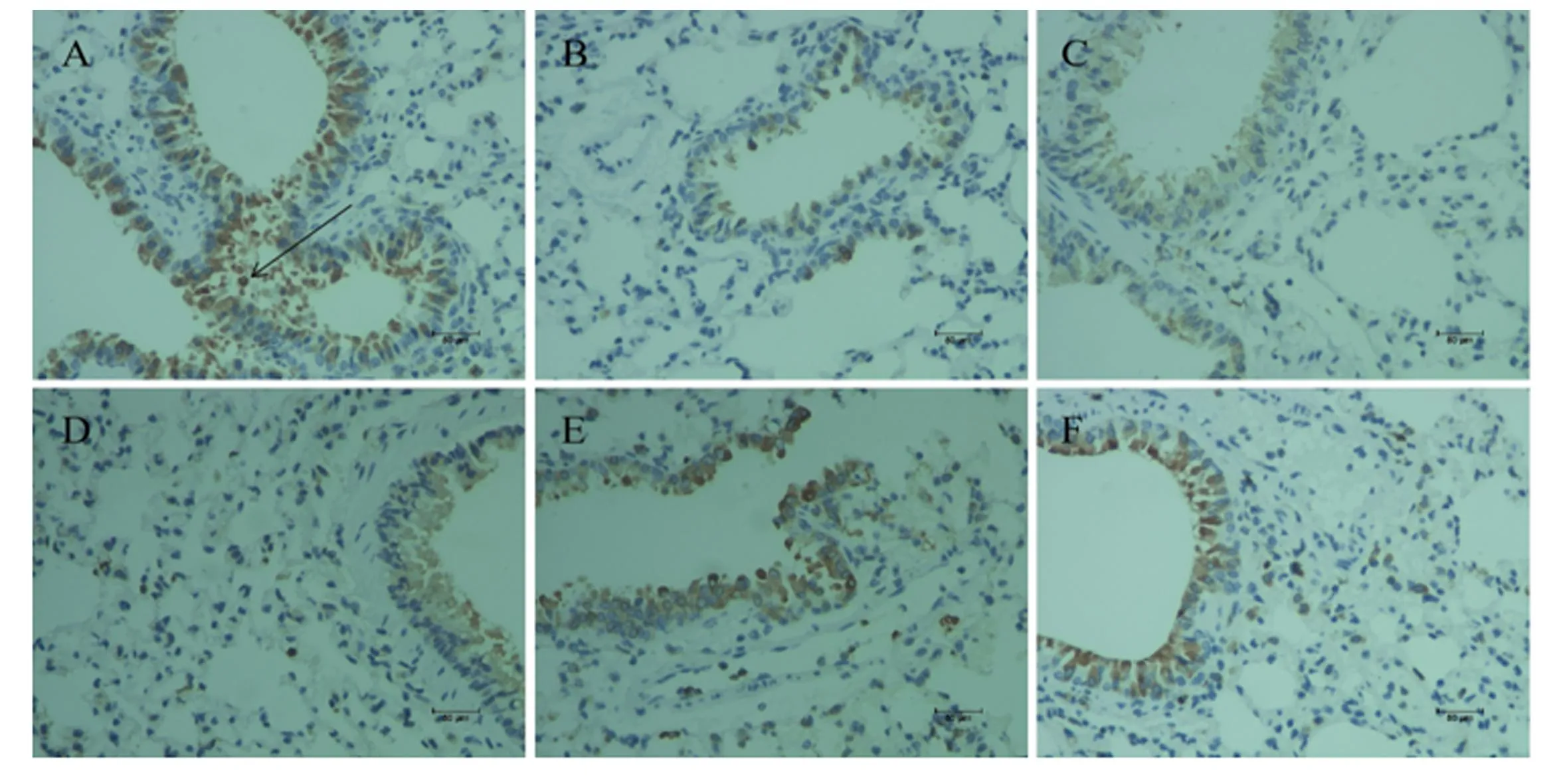
图3 PRV感染小鼠肺脏组织中HO-1蛋白免疫组化切片图

表6 辣蓼黄酮对PRV感染小鼠肺脏组织中HO-1和NQO1蛋白表达的影响
如图4所示,肺脏组织中NQO1蛋白在空白对照组表达较少,在其他各试验组均有表达,显示为棕褐色或者黄色,主要分布在肺泡壁细胞的胞浆中,同时NQO1蛋白在支气管上皮细胞的胞核中亦有分布。如表6所示,与空白对照组相比,PRV组肺脏组织中NQO1的蛋白表达水平有所升高,但差异不显著(P>0.05)。与PRV组相比,辣蓼黄酮高剂量组肺脏组织中NQO1的蛋白表达水平显著升高(P<0.05),辣蓼黄酮低剂量组肺脏组织中NQO1的蛋白表达水平显著降低(P<0.05)。
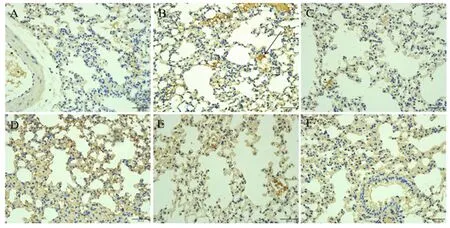
图4 PRV感染小鼠肺脏组织中NQO1蛋白免疫组化切片图
2.6 辣蓼黄酮对PRV感染小鼠脾脏和肺脏组织中AcH3和AcH4蛋白表达的影响
如图5和图6所示,与空白对照组相比,PRV组脾脏和肺脏组织中AcH3的蛋白表达水平极显著升高(P<0.01)。与PRV组相比,VC组及辣蓼黄酮高、中、低剂量组脾脏和肺脏组织中AcH3的蛋白表达水平显著或极显著降低(P<0.05)。
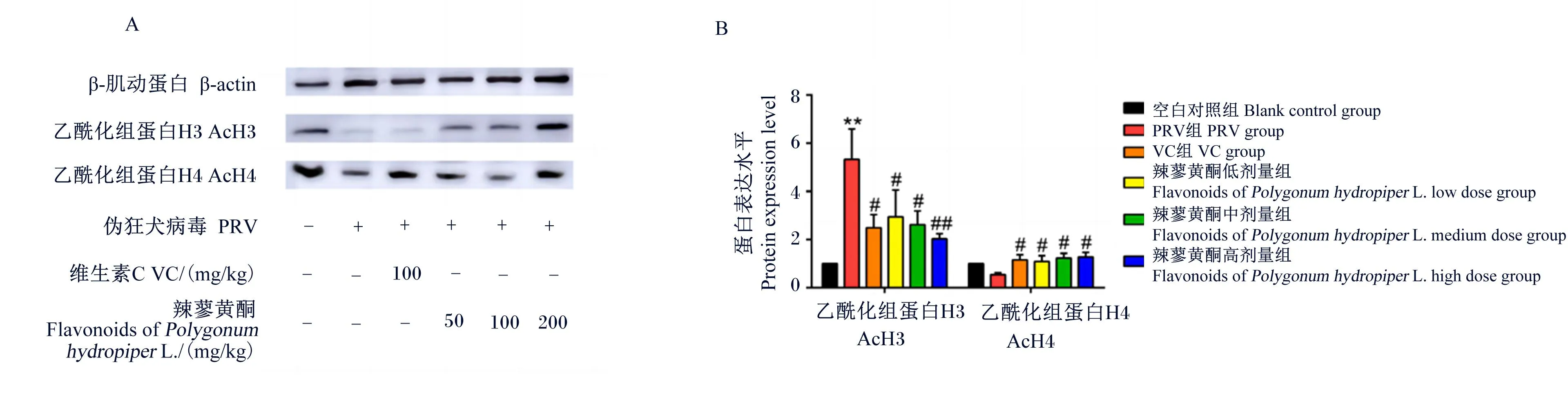
图5 辣蓼黄酮对PRV感染小鼠脾脏组织中AcH3和AcH4蛋白表达的影响
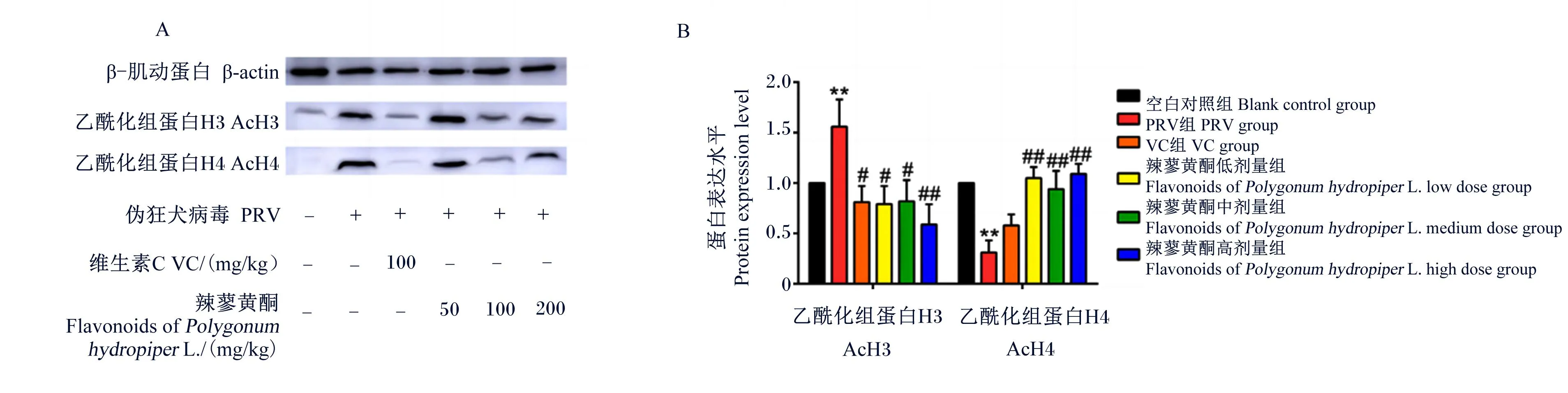
图6 辣蓼黄酮对PRV感染小鼠肺脏组织中AcH3和AcH4蛋白表达的影响
与空白对照组相比,PRV组肺脏组织中AcH4的蛋白表达水平极显著降低(P<0.01)。与PRV组相比,VC组及辣蓼黄酮高、中、低剂量组脾脏组织中AcH4的蛋白表达水平显著升高(P<0.05),辣蓼黄酮高、中、低剂量组肺脏组织中AcH4的蛋白表达水平极显著升高(P<0.01)。
3 讨 论
研究表明,iNOS是合成NO的关键酶,在iNOS的催化下,NO可以在较长的时间内以恒定速率合成[17]。而NO是一种高反应性细胞毒性自由基。因此,iNOS被认为是评估氧化应激反应过程的有效生物标志物之一。陈奇等[18]研究发现,猪繁殖与呼吸综合征病毒(PRRSV)感染后将诱导细胞发生氧化应激,且iNOS分泌水平在测定的各个时间点均高于空白对照组。本研究结果显示,PRV感染小鼠后,小鼠脾脏和肺脏组织中iNOS的mRNA表达水平升高,这与前人的研究结果一致,说明PRV感染造成了小鼠的氧化应激。高、中、低3个剂量的辣蓼黄酮可下调小鼠肺脏组织中iNOS的mRNA和蛋白表达水平,说明辣蓼黄酮能够缓解PRV感染诱导的氧化应激。
生物体内,自由基作用于脂质发生过氧化反应,氧化终产物为MDA,会引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性。MDA含量是反映机体抗氧化潜在能力的重要参数,可以反映机体脂质过氧化速率和强度,也能间接反映组织过氧化损伤程度。髓过氧化物酶(MPO)又称过氧化物酶,是血红素辅基的血红素蛋白酶,是血红素过氧化物酶超家族成员之一。总抗氧化能力(T-AOC)是指各种抗氧化物质和抗氧化酶等构成的总抗氧化水平,如抗氧化物酶、维生素C、维生素E和胡萝卜素等,为保护细胞和机体免于活性氧自由基造成的氧化应激损伤,因此可用T-AOC来评价生物活性物质的抗氧化能力。SOD是生物体内存在的一种抗氧化金属酶,它能够催化超氧阴离子自由基歧化生成氧和过氧化氢,在机体氧化与抗氧化平衡中起到至关重要的作用,与很多疾病的发生、发展密不可分。本实验室前期研究表明,辣蓼黄酮可极显著降低LPS诱导的小鼠小肠中MDA和MPO的分泌水平,同时,其还可极显著升高小鼠血清中谷胱甘肽的分泌水平,高剂量的辣蓼黄酮能够显著或极显著提高小鼠肝脏中T-AOC和SOD活性[19]。此外,Ren等[20]研究表明,辣蓼黄酮乙酸乙酯部位可显著或极显著降低PRV感染RAW264.7细胞内ROS、NO含量和iNOS活性,本研究结果与其一致。由此表明,辣蓼黄酮能够缓解外来病原感染小鼠造成的氧化应激,并提高小鼠自身机体的抗氧化能力。
此外,Wang等[21]研究表明,氧化应激是由紫外线辐射等破坏性刺激引起的皮肤损伤的主要原因,而间质干细胞衍生外泌体(MSC-Exo)作为一种纳米治疗剂可通过降低小鼠体内ROS含量、提高MDA含量而缓解氧化应激和皮肤损伤;敲低Nrf2的表达减弱了MSC-Exo在体内和体外的抗氧化能力,表明该治疗药物提升的抗氧化能力是通过Nrf2信号通路介导的。Yang等[22]研究表明,药物Maresin1可降低小鼠肝脏中ROS和MDA等氧化应激指标的含量而缓解LPS诱导造成的氧化应激和急性肝脏损伤;而敲低Nrf2基因后,小鼠肝脏中HO-1和谷胱甘肽过氧化物酶4(GPX4)的表达水平随之降低,Maresin1的保护作用也明显下降,表明Nrf2/HO-1/GPX4的激活可抑制ROS的产生,Nrf2信号通路及其下游抗氧化酶HO-1、GPX4和NQO1等的表达水平高低可在一定程度上反映机体抗氧化能力的强弱。
Nrf2在氧化应激过程中发挥保护作用,在ROS存在下,Kelch样环氧氯丙烷相关蛋白1(Keap1)-Nrf2复合物解离,Nrf2从细胞质易位,并于细胞核中结合抗氧化反应元件(ARE)参与抗氧化反应的基因的转录,其产物主要是具有灭活ROS能力的酶[23]。其中一种ARE酶是HO-1,可保护细胞遭受氧化应激损伤,已被证明具有抗炎、抗氧化和抗凋亡作用[24]。另一种酶是NQO1,是一种抗氧化酶,可催化几种不同类别的醌样化合物的双电子还原,以避免单电子还原启动氧化还原循环产生活性氧并造成氧化应激[25]。刘泽霖等[10]在Nrf2通路对日本脑炎病毒(JEV)感染小鼠神经瘤细胞引起的氧化应激反应进行研究发现,JEV激活了Nrf2的mRNA和蛋白的表达。慢性萎缩性胃炎模型大鼠胃黏膜组织Nrf2、NQO1、谷胱甘肽S转移酶(GST)蛋白及mRNA表达水平升高[26]。薰衣草总黄酮能够明显减轻小鼠皮肤光损伤引起的氧化应激,减轻皮肤外观损伤程度、表皮厚度及皮肤组织的病理学变化,且能显著增强Nrf2、HO-1、NQO1的蛋白表达水平[27]。在本研究中,PRV感染会导致小鼠肺脏组织中Nrf2和NQO1的mRNA和蛋白表达水平上调,且导致HO-1的mRNA表达水平上调,这与前人的研究结果相一致。此外,高、中、低剂量的辣蓼黄酮能上调PRV感染小鼠脾脏组织中Nrf2、HO-1和NQO1的mRNA表达水平,且高、低剂量的辣蓼黄酮能上调PRV感染小鼠脾脏组织中HO-1和NQO1的蛋白表达水平,这同样与前人的研究结果相类似。由此表明,辣蓼黄酮可通过调控Nrf2信号通路,增强抗氧化酶相关基因和蛋白的表达,发挥抗氧化作用,缓解PRV感染小鼠诱导的氧化应激。其中,200 mg/kg BW的高剂量辣蓼黄酮效果最好。
组蛋白H3和组蛋白H4中赖氨酸残基的乙酰化是被研究最多的组蛋白修饰类型,它受到HAT和HDAC活性的严格控制[28]。HAT和HDAC活性之间的平衡保证了稳定的组蛋白乙酰化水平,而这种平衡的改变会导致疾病的发生[29]。据报道,1型即艾滋病病毒(HIV-1)可以降低HDAC活性,增加HAT活性,并上调组蛋白H3和组蛋白H4的乙酰化作用[30]。另有研究表明,抑制HIV-1复制与HDAC活性的增加和组蛋白乙酰化的抑制有关,而高HAT活性与HIV-1活性转录相对应[31-32]。据报道,猪圆环病毒2型(PCV2)感染在小鼠体内诱导了氧化应激和组蛋白乙酰化,三七皂甙可以通过降低HAT活性并增加PCV2感染小鼠脾脏组织中HDAC活性来降低组蛋白H3的乙酰化水平,缓解氧化应激造成的损伤[16]。Chen等[33]研究表明,马尾藻多糖通过降低HAT的分泌水平,升高HDAC的分泌水平,下调组蛋白H3和组蛋白H4的乙酰化,显著抑制炎症反应,从而保护细胞免受PCV2诱导的损伤。在本研究中,PRV感染上调了小鼠脾脏和肺脏组织中HAT的mRNA表达水平,下调了小鼠脾脏组织中HDAC的mRNA表达水平,并上调了组蛋白H3的乙酰化水平。这与前人的研究结果相类似。而高、中、低3个剂量的辣蓼黄酮能下调小鼠脾脏和肺脏组织中HAT的mRNA表达水平,上调小鼠脾脏和肺脏组织中HDAC的mRNA表达水平,下调组蛋白H3的乙酰化水平。上述结果表明,辣蓼可通过上调HDAC的mRNA表达水平,进而下调调控组蛋白乙酰化,发挥抗氧化作用,缓解PRV感染小鼠诱导的氧化应激。综合分析来看,200 mg/kg BW的高剂量辣蓼黄酮效果最好。
4 结 论
辣蓼黄酮对Nrf2信号通路和组蛋白乙酰化修饰具有调控作用,且其通过该调控作用而缓解PRV感染小鼠脾脏和肺脏诱导的氧化应激。

