不同毒力型的幽门螺旋杆菌对胃内微环境的影响
赵小青,肖嘉欣,林 勇,张剑锋,王文辉,张文杰
(广东省中医院珠海医院脾胃病科,广东 珠海 519000)
幽门螺杆菌在包括我国在内的世界范围感染普遍,平均感染率超过50%,是目前感染率最高的有明确致病作用的细菌[1]。大量的研究证实,Hp 是慢性胃炎及消化性溃疡的主要病因之一,同时Hp 感染与胃癌的发生亦密切相关,在一定程度上增加了胃癌发生风险[2-4]。
Hp 感染后可产生不同抗体,根据所产生的抗体种类和致病能力不同,临床上将产生细胞毒素相关蛋白A 和细胞空泡毒素A 抗体类型归为Hp 感染I 型;产生尿素酶A 和尿素酶B 抗体类型归为Hp 感染Ⅱ型;Hp 感染阳性,抗体检测均为阴性者为不定型组[5]。近年来不同毒力的幽门螺旋杆菌的致病性及严重性受到了广泛的关注,毒力越强的Hp 毒株对胃黏膜损伤越大[6]。胃部疾病与Hp 感染密切相关,尤其是Ⅰ型Hp 高毒力菌株为胃部疾病的主要致病菌株。不同毒力的Hp 感染可能导致不同的胃液微环境改变,进而导致不同的疾病的发生,笔者通过观察不同分型的Hp 感染患者胃液中pH 值、Na+、K+、Cl-、IL-6、IL-8、G-17、PG Ⅰ、PG Ⅱ水平的变化,初步探讨不同毒力Hp 感染者胃内微环境是否具有差异性,这是否是疾病不同严重程度的关键环节。
1 资料与方法
1.1 病例资料
收集2021 年12 月至2023 年3 月于广东省中医院珠海医院住院进行胃镜检查患者,纳入标准:(1)年龄18~70 岁,男女不限;(2)由临床医生通过13C 呼气试验诊断为Hp 感染或无Hp 感染,无论有无消化道症状者;排除标准:近14 d 内服用抑制胃酸分泌和中和胃酸药物的患者[6]。最终纳入:Hp 感染阳性患者79 例;Hp 感染阴性患者31 例。通过Hp 抗体分型检测最终Hp 感染阳性患者分为:Ⅰ型组52 例,平均年龄(53±9.5)岁,男性16 例、女性36 例。Ⅱ型组11 例,平均年龄(52±9.4)岁,男性6 例、女性5 例。未定型组16 例,平均年龄(49±12)岁,男性7 例、女性9 例。Hp 感染阳性患者筛选抗体均为阴性患者为:空白对照组12 人,平均年龄(54±7.7)岁,男性7 例,女性5 例。以上各组性别、年龄比较无差异(P>0.05)。本研究通过广东省中医院珠海医院伦理委员会审核批准(BE2022-087-01),所有胃镜检查患者均签署知情同意书。
1.2 方法及相关指标检测
标本采集前12 h 禁止饮食和服用影响胃酸分泌的药物。进行胃镜检查时,描述胃内粘膜状态,记录胃镜诊断,在进行其他操作前首先进行胃液抽取和采集,以干燥洁净储存盒采集,量为5 mL。获取胃液标本后,尽快置入标本收集管-20 ℃冷冻保存,无需离心,待收集齐后,统一进行检测和评价。检测前标本自然解冻,3 500 r/min 离心10 min 后取上清液。pH 仪测定酸碱度,分光光度法测定Na+、K+、Cl-含量,酶联免疫检测PGⅠ、PGⅡ、G-17、IL-6、IL-8 水平。
1.3 统计学处理
选用统计学软件 SPSS 25.0 对研究数据进行分析和处理,计量资料以均数±标准差()表示,2 组比较采用两独立样本t检验;多组比较采用单因素方差分析,进行方差齐性检验,方差齐,如果样本含量不同,采用Scheffe 多重比较的方法;如果样本含量相同,采用Tukey 多重比较的方法;方差不齐,多重比较采用Dunnett T3 两两比较。计数资料性别用百分率表示,组间比较采用卡方检验;P<0.05 为差异有统计学意义。
2 结果
2.1 病例资料统计
4 组患者一般资料比较差异无统计学意义(P>0.05),见表1。
表1 4 组患者一般情况比较()Tab.1 Comparison of general conditions of 4 groups of patients()

表1 4 组患者一般情况比较()Tab.1 Comparison of general conditions of 4 groups of patients()
2.2 Hp 阳性组和Hp 阴性组各项指标比较
Hp 阳性组与Hp 阴性组相较,pH 值、Na+、K+差异无统计学意义(P>0.05);Hp 阳性组与Hp阴性组相比较Cl-含量降低(P<0.05),见表2。Hp 阳性组与Hp 阴性组相比较,PGⅠ、PGⅡ、IL-6、IL-8、G17 均有上升(P<0.05),见表3。
表2 Hp 阳性组和Hp 阴性组酸碱度及相关离子比较()Tab.2 Comparison of pH and related ions between the Hp-positive group and the Hp-negative group()

表2 Hp 阳性组和Hp 阴性组酸碱度及相关离子比较()Tab.2 Comparison of pH and related ions between the Hp-positive group and the Hp-negative group()
注:与Hp阴性组相比,*P <0.05。
表3 Hp 阳性组和Hp 阴性组各项指标比较()Tab.3 Comparison of Hp-positive and Hp-negative groups()

表3 Hp 阳性组和Hp 阴性组各项指标比较()Tab.3 Comparison of Hp-positive and Hp-negative groups()
注:与Hp阴性组相比,*P <0.05。
2.3 不同毒力型幽门螺旋杆菌感染组与空白对照组的各项指标比较
Ⅰ型组分别与Ⅱ型组、未定型组、空白对照组各组相比较,pH 值、Na+、K+差异无统计学意义(P>0.05)。Ⅰ型组与未定型组的Cl-含量较空白对照组降低,差异有统计学意义(P<0.05);Ⅱ型组与其他各组相较,Cl-含量差异无统计学意义(P>0.05),见表4。
表4 4 组酸碱度及相关离子比较()Tab.4 Comparison of pH and related ions in the four groups()
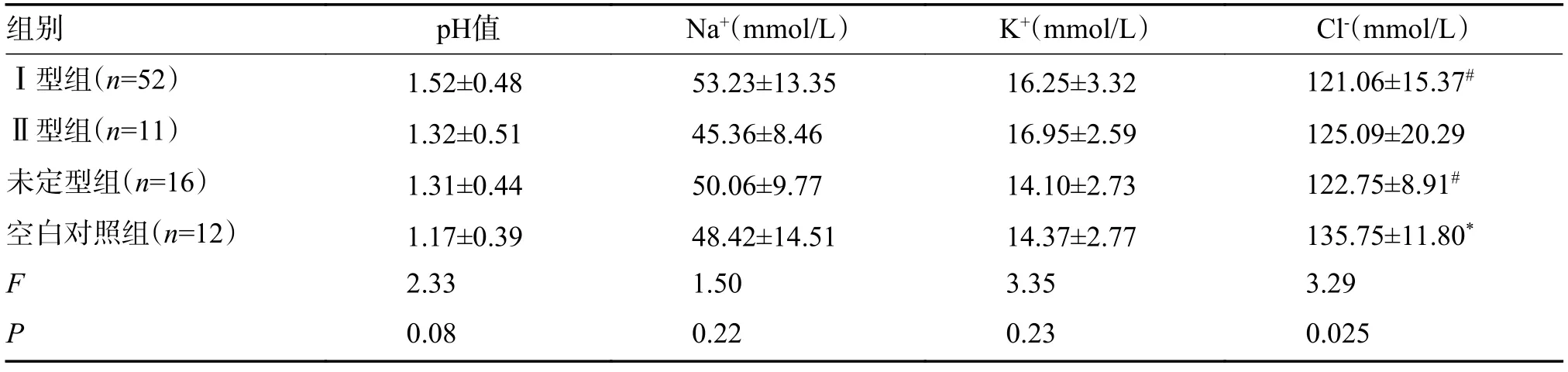
表4 4 组酸碱度及相关离子比较()Tab.4 Comparison of pH and related ions in the four groups()
注:与Ⅰ型组相比,*P <0.05;与空白对照组相比,#P <0.05。
Ⅰ型组与Ⅱ型组、未定型组、空白对照组比较,IL-6、IL-8、PGⅠ均有上升,差异有统计学意义(P<0.05)。空白对照组与其他各组之间比较,PG Ⅱ下降,差异有统计学意义(P<0.05)。Ⅰ型组与未定型组的胃泌素17 含量差异无统计学意义(P>0.05)。Ⅰ型组与Ⅱ型组、空白对照组比较,胃泌素17 上升,差异有统计学意义(P<0.05),见表5。
表5 4 组PGⅠ、PGⅡ、IL-6、IL-8、G17 比较()Tab.5 The four groups were compared with PGI.,PGII.,IL-6,IL-8 and G17()
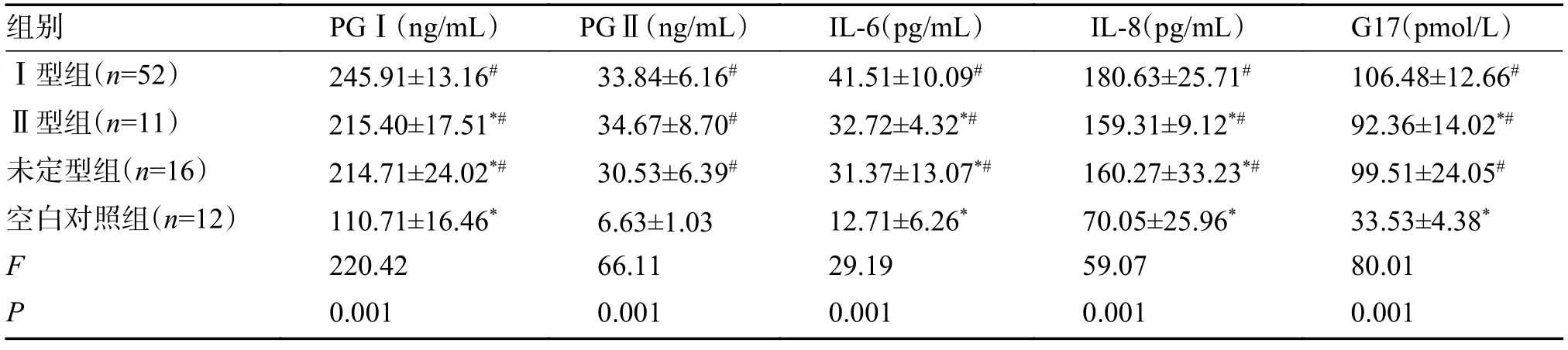
表5 4 组PGⅠ、PGⅡ、IL-6、IL-8、G17 比较()Tab.5 The four groups were compared with PGI.,PGII.,IL-6,IL-8 and G17()
注:与Ⅰ型组相比,*P <0.05;与空白对照组相比,#P <0.05。
3 讨论
幽门螺旋杆菌是全球范围内高感染率的慢性感染性致病菌,它被认为是多种消化道疾病的主要病因,常见如慢性胃炎、消化道溃疡,更有甚者可以引起胃黏膜相关淋巴组织淋巴瘤和胃癌[7]。近期研究发现它还和心血管系统、神经内分泌系统相关疾病的发生发展紧密相关[8-9]。因此深入研究幽门螺旋杆菌感染后的致病机制是必不可少的。
宿主感染Hp 后可通过Hp 定植、损害胃黏膜屏障、炎症与免疫反应、毒力基因造成的损害、感染后胃泌素和生长抑素、调节失衡所致的胃酸分泌异常等方式对机体造成损害。随着检测技术的进步,Hp 菌株中含有细胞毒素相关蛋白A(CagA)、细胞空泡毒素A(VacA)、尿素酶A(UreA)、尿素酶B(UreB)、热休克蛋白 60 和氮素还原酶等抗原蛋白。Hp 感染后可产生不同抗体,根据所产生的抗体种类和致病能力不同,临床上将产生CagA 和VacA 抗体类型归为Hp 感染Ⅰ型[10]。产生UreA 和UreB 抗体类型归为Hp 感染Ⅱ型[11]。CagA 是Hp 最具特点的1 种毒力蛋白,有研究指出,CagA 进入宿主体内后诱导胃黏膜内IL-8 水平明显增高,CagA 通过Ⅳ型分泌系统进入宿主体内后诱导胃黏膜内IL-8 水平增高,导致中性粒细胞、T 淋巴细胞等免疫细胞激活、粘附,促使上皮细胞炎症损害明显加重[12]。VacA 可破坏上皮细胞结构的完整性,上皮下拨产生空泡样改变,损伤黏膜,屏障功能下降,调节炎症反应等[13]。董欣红等[14]通过1 项多中心临床研究发现:不同毒力型的Hp 菌株感染,致病力也有差异,Ⅰ型 Hp比Ⅱ型有更强的致病力,更易致消化性溃疡。杨静怡等[15]通过对不同亚型幽门螺旋杆菌感染与功能性消化不良症状的关系研究发现:Ⅰ型感染功能性消化不良患者的临床症状重于Ⅱ型感染的。彭梦巧等[16]通过统计不同菌株Hp 感染的胃粘膜在各个阶段病变状态的差异性,发现胃部疾病与Hp感染密切相关,且Ⅰ型致病菌,黏膜损伤更严重。
PG Ⅰ、PG Ⅱ是胃黏膜特异性功能酶的重要组成部分,由胃底腺的主细胞和黏液颈细胞分泌,是参与消化的无活性前体。PG Ⅰ、PG Ⅱ可被胃液中的的盐酸激活,进而参与消化活动,但是PGⅠ、PG Ⅱ过多、活性增强对胃黏膜组织具有损伤作用[17]。本研究亦发现,Hp 感染后PG Ⅰ的表达量明显增多,Ⅰ型Hp 感染患者的PG Ⅰ表达量比Ⅱ型Hp 感染患者的PG Ⅰ表达量增加(P<0.05)。
胃泌素-17 主要是由G 细胞分泌,分布在胃窦、胃底部等,当胃部因各种原因受损时,胃粘膜功能也随之出现不同程度的改变[18]。黄凤敏等[19]发现:十二指肠溃疡患者伴有血清G-17 水平的升高,其水平与Hp 感染及病情密切相关,可用于临床诊断及病情评估。本实验通过检测胃液G-17 发现,Hp 阳性患者比Hp 阴性患者G-17 表达量明显升高,其中Ⅰ型感染者较Ⅱ型感染者G-17 水平升高(P<0.05)。因此可以看出不同毒力Hp 感染后G-17 具有差异性。
IL-6、IL-8 是1 种促炎因子,是判断机体炎症常用的指标[20]。有研究发现[21]:Hp 阳性患者IL-6 和IL-8 水平高于阴性患者,且与慢性胃炎的严重程度成正相关。吴捷莉等[22]通过体外细胞实验发现:CagA+、CagE+基因型Hp 菌株通过蛋白酪氨酸激酶的磷酸化增加胃上皮细胞IL-8 的分泌量;潘小炎等[23]发现:Ⅰ型Hp 感染患者IL-8 明显高于Ⅱ型Hp 感染患者。有研究报道[24]提出:CagA 蛋白可激活和激素白细胞趋化,促进IL-8、肿瘤坏死因子α 的释放,进而导致炎症反应加剧和组织损伤。本研究结果发现:IL-6、IL-8 表达量在Hp 感染患者的胃液中更高,且不同Hp 菌株分型之间也具有差异性。
综上所述,本研究结果提示,不同毒力的Hp 感染对胃内酸碱度及钠、钾、氯离子影响不大,但是对胃蛋白酶及炎症因子的影响具有差异性,Ⅰ型幽门螺旋杆菌感染的对胃腔的内环境改变更明显,可能通过增加IL-6、IL-8、胃泌素17 的表达量,影响PG Ⅰ、PG Ⅱ的表达和激活造成对胃黏膜损伤,进而导致消化功能异常和相关疾病的发生、发展。

