慢病毒介导长链非编码RNA XLOC_015548基因编辑的C2C12细胞模型建立
翁鉴,齐天天,魏懿浩,于斐
骨骼肌是生物体内含量最丰富的组织之一,主要负责运动的维持、形态的维持和分泌功能的执行[1-2]。骨骼肌肉的正常结构和功能完整性依赖于神经的支配,肌细胞内正常的神经传导和神经冲动,以及肌细胞内正常的代谢过程[3-4]。越来越多的证据表明,骨骼肌受损或发育不良与多种机体的疾病状态有关,包括失神经肌萎缩、癌变恶疾、内分泌代谢系统疾病等[5-8]。骨骼肌的形成是一个多步骤及复杂的过程,包括募集生肌前体、细胞增殖、细胞融合、肌管分化等[9-11]。目前的研究认为,在骨骼肌中存在多种非编码RNA,包括长度超过 200 bp 的长链非编码RNA(long non-coding RNA, LncRNA),参与成肌调控的过程[12-13]。在细胞质和细胞核中,研究者们相继发现了LincMD1、LincYAM1、LncMUNC、LncMyoD及LncMg 等成肌分化相关的特异性调节因子,并且通过体内体外实验,验证了其对于肌源性标志物的影响[14-17]。这些研究结果预示着,LncRNA 在机体的成肌过程中发挥着重要作用。
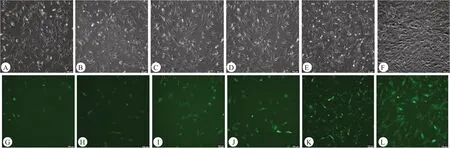
图1 感染不同滴度XLOC_015548基因慢病毒的C2C12细胞
本研究团队的前期利用小鼠的周围神经损伤后失神经腓肠肌萎缩模型,结合RNA-seq 技术,分析了骨骼肌萎缩过程转录组中LncRNA 的生物学作用。根据表达差异及表达丰度,共发现73 个LncRNA 在肌萎缩过程中具有统计学差异。其中,XLOC_015548(Lnc000280)在测序结果中表现出理想的表达丰度及最显著的表达差异[18]。因此,猜测XLOC_015548可能是肌萎缩相关的靶点之一。
慢病毒载体是一类对多种细胞均有感染能力的病毒载体,在细胞实验中应用广泛。这类病毒能够稳定地将目的基因整合到细胞的基因序列中,从而构建子代细胞,能够稳定地表达目的基因。综上所述,鉴于LncRNA 在成肌调控中的重要作用,结合前期工作中通过RNA-seq 技术得到的结果,本研究将通过慢病毒载体技术在体外诱导XLOC_015548感染C2C12 成肌细胞,构建能稳定遗传XLOC_015548 的成肌细胞模型,为进一步探究XLOC_015548 对失神经肌萎缩等骨科相关疾病提供实验基础。
1 材料与方法
1.1 设计
体外细胞学实验,样本之间采用独立样本t检验分析。
1.2 时间和地点
实验于2021年11月至2022年3月在北京大学深圳医院中心实验室、北京大学深圳医院骨科生物材料国家地方联合工程研究中心完成。
1.3 材料
1.3.1 实验细胞
小鼠成肌细胞系C2C12 购自中国武汉普诺赛生命科技有限公司。
1.3.2 主要试剂
慢病毒载体由上海汉恒生物科技有限公司构建;总RNA 提取试剂盒购于中国贝贝生物科技有限公司;引物及测序由上海汉恒生物科技有限公司及广州锐博生物科技有限公司提供及完成;Myogenin抗体、GFP 抗体购于Abcam 公司;Vinculin 抗体、Myod 抗体购于菲恩生物公司;β-actin 抗体购于abclonel 公司;DMEM 培养基、胎牛血清、0.25% Trypsin-EDTA 购于Gibco 公司;Millex-HV 0.45 μm PVDF filters 购于美国Millipore 有限公司;cDNA 逆转录试剂盒、SYBR PreMix Ex Taq Ⅱ购于Takara 公司;蛋白裂解缓冲液、蛋白酶抑制剂、磷酸酶抑制剂购于碧云天生物科技有限公司;ECL 超敏型化学发光底物试剂盒购于中国北京白鲨生物科技有限公司。
1.3.3 主要仪器
离心机购自德国艾本德生命科学公司;共聚焦显微镜TCS SP8购自德国徕卡微系统有限公司;电泳仪购自伯乐生命医学产品(上海)有限公司;凝胶化学发光成像系统购自上海勤翔科学仪器有限公司;实时荧光定量PCR 仪购自美国赛默飞公司;生物安全柜购自新加坡艺思高科技有限公司;CO2培养箱购自上海力申科学仪器有限公司。罗氏480 实时定量PCR系统购自上海凯来仪器有限公司。
1.4 实验方法
1.4.1 C2C12细胞的培养
将小鼠成肌细胞系C2C12(普诺赛生命科技有限公司,武汉,中国)进行常规复苏,接种于10 cm 培养皿中。细胞的增殖培养条件为体积分数10%胎牛血清+1%链霉素、青霉素+DMEM 的完全培养基,并将细胞置于37℃、体积分数5%的CO2细胞培养箱中,每隔48 h 更换新鲜培养基,待细胞增殖融合度达到80%左右时,按照1∶3 的比例传代。传代后的C2C12细胞按照上述培养条件继续增殖培养。
1.4.2 XLOC_015548 过表达及敲低慢病毒载体系统的构建及转染
根据XLOC_015548 的基因序列[18]设计慢病毒。使用pHBLV-U6-MCS-CMV-ZsGreen-PGK-PURO 干扰载体,构建病毒载体HBLV-m-Lnc000280-shRNA1-ZsGreen-PURO。 使 用 pHBLV-CMV-MCS-EF1-ZsGreen-T2A-puro 载体,构建HBLV-m-Lnc000280-Null-ZsGreen-PURO 过表达载体。使用BamH Ⅰ和EcoR Ⅰ两个限制性内切酶位点,引物退火后合成双链DNA,使用T4DNA连接酶将双酶切载体和退火后的双链DNA转化入感受态细胞。同时利用聚合酶链反应(polymerase chain reaction, PCR)鉴定阳性克隆。质粒经测序提取,鉴定合格后用于后续实验。转染293T细胞5 d,在荧光显微镜下观察各病毒稀释液中的荧光细胞。收集包装好的慢病毒颗粒,其测定滴度(TU/mL)=细胞数×阳性克隆百分比×感染复数×病毒稀释倍数×103。将C2C12 细胞分为阴性对照组、XLOC_015548敲低组、阳性对照组、XLOC_015548过表达组。然后分别以1、2、5、10、20、30 的感染复数(multiplicity of infection, MOI)转染。孵育12~24 h后,更换新鲜增殖培养基,培养72 h后进行第一次传代,并加入2 mg/mL嘌呤霉素进行筛选稳定转染株。培养72 h后,在荧光显微镜下照相并采集细胞,进行后续实验。
1.4.3 绿色荧光蛋白(green fluorescent protein, GFP)的观察
为了分析XLOC_015548过表达及敲低慢病毒载体系统是否能够成功转染靶细胞,使用荧光显微镜观察慢病毒转染24~96 h的GFP的表达。
1.4.4 RNA提取及实时荧光定量RT-qPCR
在慢病毒处理细胞3 d 后收集细胞,使用RL solution(贝贝生物科技有限公司,河北,中国),依照说明书中的实验流程提取总RNA,使用PrimeScript RT试剂盒(Takara,辽宁,中国)对1 μg RNA进行逆转录。将合成后的cDNA以1∶5的稀释度进行稀释,再应用快速实时聚合酶链反应系统进行实时RT-qPCR。根据制造商的说明,使用SYBR PreMix Ex Taq Ⅱ(Takara,辽宁,中国)及使用罗氏480 实时定量PCR系统测定RNA 的相对丰度。使用以下温度设置:95℃ 持续30 s,然后95℃和60℃ 分别进行40 次循环,每次循环5 s和30 s。在10 μL反应混合物中进行每个实时PCR反应,用于实时PCR的引物见表1。以GAPDH 作为内参基因,用2-ΔΔCt法计算基因相对mRNA表达水平。

表1 PCR引物
1.4.5 蛋白质免疫印迹分析
在慢病毒处理细胞3 d 后,使用蛋白裂解缓冲液RIPA(碧云天生物技术有限公司,上海,中国)、蛋白酶抑制剂、磷酸酶抑制剂进行裂解,经超声波震荡并在12 000g和4 ℃下离心30 min 后收集上清液,使用BCA 法进行蛋白质定量。按照35 μg 蛋白进行电泳上样,经10% SDS-PAG 电泳后转PVDF 膜。用TBST配置的5% BSA 低速摇床封闭45~90 min,放入GFP抗体(Abcam,ab290,1∶1 000)、Myod 抗体(FINE Biotech,FNab05511,1∶2 000)、Myogenin 抗体(Abcam,ab124800,1∶1 000)或Vinculin 抗体(FINE Biotech,FNab09799,1∶1 000)中4℃过夜孵育。将一抗孵育后的膜与辣根过氧化物酶偶合的二抗孵育1 h,用TBST 洗净。用ECL 超敏型化学发光底物试剂盒检测蛋白质条带(中国北京白鲨生物科技有限公司)。以β-actin 或Vinculin 作为内参基因,目的蛋白的灰度值表示目的蛋白的表达量。
1.5 统计学方法
使用SPSS 21.0 软件进行统计分析,使用Graphpad Prism 9.0 进行图片制作。所有数据均以均值±标准差表示,并通过t检验进行比较。以P<0.05为差异具有统计学意义。
2 结果
2.1 XLOC_015548基因相关慢病毒感染条件筛选
为了选用合适的MOI,分别以1、2、5、10、20、30的MOI 为条件对C2C12 成肌细胞进行转染。以敲低空载对照组为例,不同的MOI感染细胞后,在荧光倒置显微镜下,每组细胞都有不同强度的绿色荧光表达。按照说明书提示,转染72 h后,不同感染条件的细胞呈现最明显的绿色荧光(图1)。当MOI为20及30时,绿色荧光的表达水平相当,且较其他组数量更多(图2)。因此,本研究用于后续实验的感染条件为MOI=20。

图2 感染不同滴度XLOC_015548基因慢病毒的C2C12细胞的感染效率统计图
2.2 XLOC_015548基因编辑细胞模型成功构建
为了确认转染是否成功,在慢病毒转染72 h 后,评估GFP 水平。敲低空载对照组、XLOC_015548 敲低慢病毒组、过表达空载对照组、XLOC_015548过表达慢病毒组在荧光倒置显微镜观察下均可见明显绿色荧光(图3A~3D),敲低组和过表达组之间的绿色荧光相对强度比较,差异无统计学意义(图3E)。Western Blot 实验中,各组均有GFP 的表达(图4A),GFP 的蛋白表达量差异无统计学意义(图4B)。此外,进行RT-qPCR 用以评估XLOC_015548 以及肌源性分化因子Myod的mRNA 表达水平,与各自对照组相比,XLOC_015548 敲低慢病毒组中细胞mRNA 表达量较低,XLOC_015548 过表达慢病毒组中细胞RNA 表达量较高(P<0.05,图5)。肌源性分化因子Myod 的mRNA 表达量的变化趋势与XLOC_015548升高及降低趋势一致,差异具有统计学意义(P<0.05)。同时,Western Blot 用以评估肌源性分化因子Myod、Myogenin 蛋白表达水平,与各自对照组相比,XLOC_015548 敲低慢病毒组中Myod、Myogenin 蛋白表达量下降,XLOC_015548 过表达慢病毒组中Myod、Myogenin 蛋白表达量,差异具有统计学意义(P<0.05,图6)。基于以上观察,本研究验证了靶基因成功转染到C2C12 成肌细胞中,并且初步验证了肌源性分化因子Myod、Myogenin 表达与XLOC_015548具有相关性。
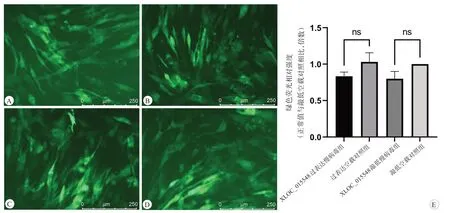
图3 感染复数为20的XLOC_015548基因慢病毒的C2C12细胞

图4 慢病毒载体绿色荧光蛋白表达水平
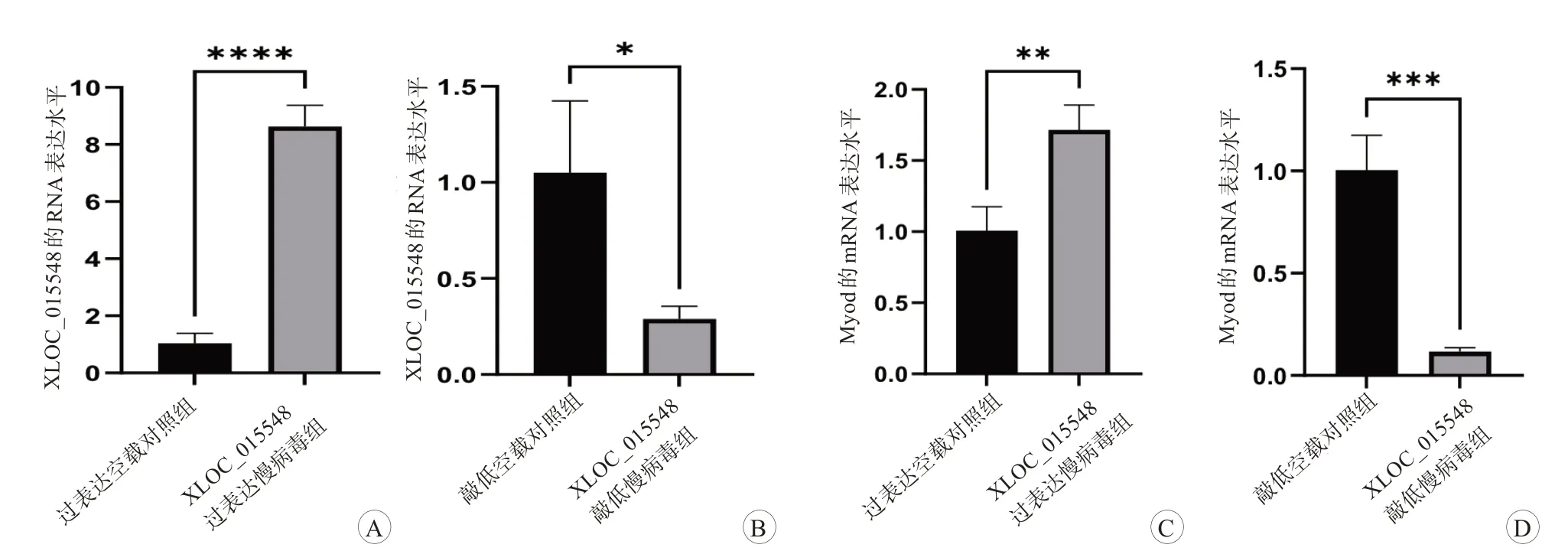
图5 细胞中XLOC_015548和Myod的RNA表达水平

图6 细胞中Myod和Myogenin的蛋白表达水平
3 讨论
在骨骼肌萎缩相关疾病中,以去神经化肌肉为例,损伤神经末梢的靶肌会发生结构、生化、生理等方面的变化,造成肌质的流失,最终导致肌细胞的凋亡和肌肉的萎缩。随着时间的推移,由于肌纤维坏死,结缔组织增生,同时肌细胞再生能力衰竭,肌细胞数量大量流失,使神经末梢肌肉对再生运动轴突失去接受能力[19-20]。在本研究的前期工作中,通过RNA-seq 检测分析失神经化后的小鼠萎缩腓肠肌。在这一过程中,73 个LncRNA 检测到差异表达。其中,发现了一种在萎缩腓肠肌中的下调的长链非编码RNA XLOC_015548(Lnc000280)。目前尚无报道XLOC_015548 的相关研究,为了后续实验进一步探索XLOC_015548 在肌萎缩过程的作用,本研究利用慢病毒载体技术,在C2C12 成肌细胞系中构建XLOC_015548相关基因编辑细胞模型。
目前已有多项研究证实,在骨骼肌中存在多种非编码RNA,包括长度超过200 bp 的LncRNA,参与成肌调控的过程,对肌肉发育中起到重要作用[12-13]。细胞质中的Linc-MD1 是第一个被发现可用于正性调节成肌分化的肌肉特异性LncRNA[14]。而与YY1相关的Linc-YAM1 是一个被证实为重要的负性调控肌生成的长链非编码RNA,其可存在于肌原细胞的细胞核和细胞质[15]。在C2C12 肌细胞和肌管内的YAM1 敲除可导致多个肌原性标记物的增加,下调YAM1 可以克服转录因子YY1 对肌原分化的抑制作用[16]。其他的LncRNA,例如MUNC,可作为肌生成的正调控因子,通过不同的机制调控成肌分化,直接增强了内源性肌分化因子Myod、Myogenin、Myh3 基因的表达[21]。同样,位于MYOD1 基因上游的LncMyod 也可促进肌生成及肌分化[22]。这些发现预示着,LncRNA 在机体的成肌过程中发挥着重要作用。综上所述,鉴于LncRNA在成肌调控中的重要作用,或许可以利用LncRNA 调控肌源性调节因子,以达到存留肌肉、改善肌萎缩程度的目的。
本研究中,通过转染XLOC_015548 的敲低及过表达慢病毒进入成肌细胞C2C12 中,第一次成功构建出XLOC_015548基因编辑细胞模型。PCR和测序结果表明,敲低和过表达的病毒载体中的序列与目的序列保持一致,并且成功地插入了该载体。感染病毒后,可在荧光显微镜下观察慢病毒载体所表达的绿色荧光,感染条件为MOI=20,同时利用嘌呤霉素2 mg/mL 进行筛选,结果发现转染后细胞形态良好,生长良好,可供后续实验研究使用。
本研究也存在着诸多局限性与不足,首先仅从细胞生物学上通过观察荧光表达以及RT-qPCR 检测XLOC_015548 的RNA 含量来确定转染成功,而没有收集各组别细胞再次通过测序及基因克隆来验证XLOC_015548 在细胞内的转染效率和情况。其次,所使用的细胞为C2C12 成肌细胞系,与原代肌细胞存在差异。除此之外,对于肌源性分化因子与XLOC_015548 相关性探索,也仅使用RT-qPCR 来验证。而且,基因研究不但需要细胞实验,未来还将构造动物模型,配合动物实验提高说服力。因此,后续需要通过更多的分子生物学的方法,在本研究所构造的细胞模型中去验证XLOC_015548与其他成肌分化相关因子的相关性和探索二者之间存在机制。
4 结论
综上所述,本研究构建出LncRNA XLOC_015548 基因慢病毒,并成功感染C2C12 成肌细胞,检测细胞中XLOC_015548 及肌源性分化因子Myod、Myogenin 的mRNA 及蛋白表达量。未来,将利用所构建出的XLOC_015548 基因编辑细胞模型,通过进一步细胞实验,探索其在成肌分化中的作用,为以后进一步探究XLOC_015548对失神经肌萎缩等骨科相关疾病提供初步实验基础。
【利益冲突】所有作者均声明不存在利益冲突

