单核细胞增生李斯特菌弱毒株主要毒力基因表达水平分析*
白 帆,陈健舜,程昌勇,陈巧妙,方维焕
(浙江大学动物预防医学研究所,浙江省动物预防医学重点实验室,浙江杭州310029)
单核细胞增生李斯特菌(Listeria monocytogenes,以下简称单核细胞增生李斯特菌)是一种重要的食源性人兽共患病原菌。主要通过污染食品而感染宿主,轻则引起胃肠炎,重则引起败血症、脑膜炎、流产等,死亡率高达25%~30%[1]。单核细胞增生李斯特菌黏附与侵入宿主细胞的过程与内化素A、B(inlAB)有关,而其细胞内增殖及细胞间扩散能力则由毒力基因plcA、hly、mpl、actA、plcB介导。PrfA(prfA)调控上述所有毒力因子,与plcA、hly、mpl、actA、plcB构成第一毒力岛(LIPI-1);inlAB同时受σB(sigB)的调控[2]。
并非所有的单核细胞增生李斯特菌均具有相同的毒力。血清型1/2a在食品中分离率最高,但绝大多数人李斯特菌病均由4b型引起,1/2a与1/2b型次之。4a与4c型则很少引起人发病[3]。单核细胞增生李斯特菌H4是本实验室从牛奶中分离的弱毒株[4]。本文在对H4进行血清分型与毒力测定的同时,采用荧光定量PCR的方法比较分析H4与10403S、681主要毒力基因(prfA、plcA、hly、mpl、actA、plcB、inlA、inlB和sigB)的表达水平差异,为探明其弱毒机制奠定基础。
1 材料与方法
1.1 菌株及培养基
单核细胞增生李斯特菌标准菌株10403S系国际生命科学协会(Internation Life Sciences Institute)北美食品微生物专家委员会指定的康奈尔李斯特菌菌种保藏室提供,单核细胞增生李斯特菌分离株H4、681由本实验室分别分离自消毒奶与原料奶。李斯特菌培养基BHI购自北京陆桥技术有限责任公司。
1.2 试剂、引物与仪器
Taq酶、10×PCR buffer购自Takara公司;4×dNTPs购自上海申能博彩;Trizol总RNA抽提试剂盒购自上海生工;反转录酶、THUNDERBIRD?SYBR Green qPCR Master Mix购自Toyobo公司;RNase Free DnaseⅠ、10×buffer with MaCl2for DnaseⅠ为Fermantas公司产品;荧光定量PCR仪(美国Bio-Rad公司);其他试剂均为国产分析纯。所有引物均由上海英骏生物技术有限公司合成(表1)。
1.3 血清型鉴定
参照Doumith建立的多重PCR血清分型方法[4],设计针对ORF2819、ORF2110、lmo0737和lmo1118的引物鉴定单核细胞增生李斯特菌10403S、H4、681的血清型(表1)。其中引物ORF2819特异性识别血清型为1/2b、3b、4b、4d、4e和4ab的单核细胞增生李斯特菌,引物ORF2110进一步区分4b、4d、4e和4ab;引物lmo0737识别血清型为1/2a、3a、1/2c和3c的菌株,而lmo1118进一步区分1/2c和3c。由于3a、3b、3c、4d、4e与4ab在环境株或临床株中均非常少见,故此PCR体系主要区分4种常见的致病血清型。同时,lmo1134引物亦被加入PCR体系[5],该基因存在于除谱系III外所有的菌株(表1)。

表1 引物序列T able 1 Primers used in this study
1.4 小鼠LD50试验
ICR小鼠(雌性,20~22克)购自浙江省中医学院实验动物中心。取细菌过夜培养物5 000 r/min,4℃离心6 min以收集菌体。用0.01 M PBS(pH 7.4)重悬,细菌数至108cfu/mL,并进行一系列的10倍梯度稀释,平板计数以确定实际接种量。同时,选取不同的稀释度腹腔接种于ICR小鼠,剂量为0.1 mL,每组接种5只小鼠,连续观察10 d,用寇氏法计算LD50。选取10403S为攻毒阳性对照组,PBS为阴性对照组。
1.5 细菌总RNA的获得及反转录
选用T rizol总RNA抽提试剂盒抽提细菌总RNA,并加入RNase Free DNaseⅠ除去样品中基因组DNA污染。反转录步骤:10 μ L总RNA与1 μ L的下游引物(50 μ M)在65℃水浴中变性10 min,冰浴冷却10 min后加入4 μ L反转录酶缓冲液、2 μ L dNTP mix、2 μ L DTT、0.5 μ L RNase抑制剂与0.5 μ L反转录酶,反应体系总体积为20 μ L,离心混匀后42℃水浴1 h,95℃灭活反转录酶5 min。cDNA置—20℃贮存。
1.6 荧光定量PCR反应体系、条件及结果分析
反应总体积中包括:cDNA 2 μ L,TH UNDERBIRD?SYBR Green qPCR Master Mix 10 μ L,上下游引物(10 μ M)各0.5 μ L,无菌双蒸水补足体积至20 μ L。选用看家基因gyrB作为内参。内参与目的基因各设3个平行反应管。反应条件:95℃1 min预变性;95℃5 s,60℃10 s,72℃15 s,共40个循环;72℃实时检测荧光信号;65℃到95℃每隔6 s检测融解曲线,共61个循环。
荧光定量PCR结果分析:—Δ Ct为内参基因Ct值减去目的基因Ct值,使用2—ΔCt代表某菌株初始cDNA的相对量,将H4的基因表达水平设为1,另两株细菌2—ΔCt与其的比值即能直观地表示10403S、681与H4主要毒力基因的表达差异。
2 结果
2.1 血清分型与小鼠毒力试验
根据多重PCR结果,10403S、681与H4的血清型分别为1/2a、4b和4a(表2)。10403S与681对小鼠的LD50分别为105.5与103.9,为强毒株。而H4对小鼠的LD50达108.2,为弱毒株(表2)。

表2 各菌株血清型鉴定结果及对小鼠LD50比较Table 2 Serotype of L.monocytogenes isolates and comparison of their virulence in terms of LD50
2.2 LIPI-1基因表达水平
荧光定量PCR结果表明,H4的LIPI-1各基因(prfA、plcA、hly、mpl、actA、plcB)表达水平为10403S与681的102~103倍。由此可见,弱毒株H4的LIPI-1表达水平极显著高于强毒株,属于过量表达(over expression)(图1)。
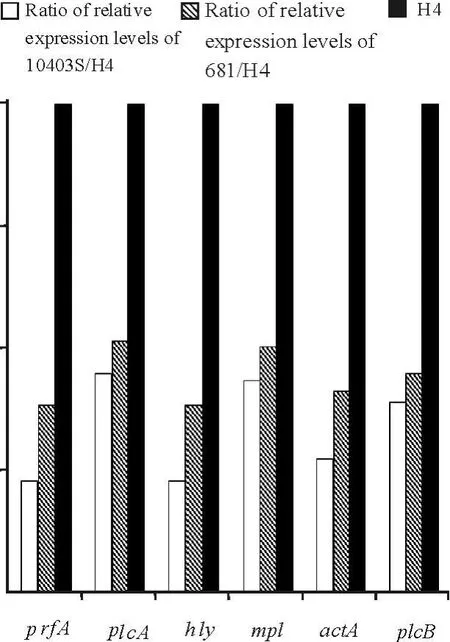
图1 单核细胞增生李斯特菌10403S、681与H4株LIPI-1中主要毒力基因表达水平比较(其中H4的基因表达水平设为1)Fig.1 Comparison of ex pression levels of genes within LIPI-1 in L.monocytogenesH4 with those in strains 10403S and 681(expression level of H4 set as 1).
2.3 inlA、inlB与sigB表达水平
荧光定量PCR结果表明,H4的sigB表达水平与10403S与681相近,inlA、inlB表达水平均高于另两个菌株,但差异程度不如LIPI-1明显(图2)。

图2 单核细胞增生李斯特菌10403S、681与H4 inlA、 inlB和sigB转录水平比较(H4的基因表达水平设为1) Fig.2 Comparison of expression levels of inlA,inlB and sig B in L.monocytogenesH4 with those in strains 10403S and 681 (expression level of H4 set as 1).
3 讨论
从1983年至今,北美和欧洲曾报道多起人类李斯特菌病的暴发,由于其高致死率,李斯特菌病被视为一种重要的食源性疾病。单核细胞增生李斯特菌首先在InlA(inlA)和InlB(inlB)的介导下,黏附至宿主细胞膜,之后在具有膜穿孔特性的溶血素LLO(hly)和磷脂酶PI-PLC(plcA)的协同作用下逃离吞噬体,进入宿主细胞质。菌体进入胞质后的运动由ActA介导,其能聚合肌动蛋白并使菌体在胞质内运动。而单核细胞增生李斯特菌在细胞间的传递则由LLO和另一种磷脂酶PC-PLC(plcB)介导[5]。其中PC-PLC需要金属酶蛋白Mpl(mpl)的剪切从而具有活性[6]。这些毒力因子均受转录调控因子PrfA(prfA)调控[7]。同时,InlA、InlB的转录还受σB(sigB)调节[8]。
单核细胞增生李斯特菌分离株H4血清型为4a,对小鼠毒力较弱。RT-PCR结果显示,弱毒株H4中,与细菌的细胞内感染周期相关的毒力基因表达水平均高于另两株细菌,其中hly的2—ΔCt值是标准菌株10403S的1180倍。H4的inlA、inlB的表达水平也较高,但不如LIPI-1中各基因转录活性高,这可能因为inlA、inlB同时受σB调节,而σB在三株细菌中的转录水平相近,2—ΔΔCt直观地显示了这一趋势。本实验室进行了体外磷脂酶(PC-PLC)活性测定,发现H4具有体外强溶脂活性,而10403S与681则无此现象,表明H4的plcB过量表达。本研究亦显示H4的plcB表达水平分别比10403S与681高269和157倍,与H4的强溶脂活性表型吻合。因此,H4的弱毒可能与LLO、PC-PLC等膜裂解因子的高表达有关,H4更易暴露于宿主免疫系统而被清除,从而导致该菌株对宿主的毒力下降。本研究为探明这类菌株的弱毒机制奠定了重要的基础。
[1] Hamon M,Bierne H,Cossart P.Listeria monocytogenes:a multifaceted model[J].Microbiology,2006,4:423-434.
[2] Freitag N E,Port G C,Miner M D.Listeria monocytogenesfrom saprophyte to intracellular pathogen[J].Nature Rev Microbiol,2009,7(9):623-628.
[3] Kathariou S.Listeria monocytogenes virulence and pathogenicity:a food safety perspective[J].J Food Protection,2002,65(11):1811-1829.
[4] Jiang L L,Xu J J,Chen N,et al.Virulence phenotyping and molecular characterization of a low-pathogenicity isolate of Listeria monocytogenes from cow's milk[J].Acta Biochimicaet Biophysica Sinica,2006,38(4):262-270.
[5] Doumith M,Buchrieser C,Glaser P,et al.Differentiation of the majorListeria monocytogenesserovars by multiplex PCR[J].J Clinical Microbiol,2004,42(8):3819-3822.
[6] Chen J S,Luo X K,Jiang L L,et al.Molecular characteristics and virulence potential of Listeria monocytogenes isolates from Chinese food systems[J].Food Microbiol,2009,26:103-111.
[7] V zquez-Boland J A,Kuhn M,Berche P,et al.Listeria pathogenesis and molecular virulence determinants[J].Clin Microbiol,2001,14(3):584-640.
[8] Chatterjee S S,Hossain H,Otten S,et al.Intracellular gene expression pro?le of Listeria monocytogenes[J].Infection and Immunity,2006,74(2):1323-1338.
[9] Poyart C,Abachin E,Razafimanantsoa I,et al.The zinc metalloprotease of Listeria monocytogenes is required for maturation of phosphatidylcholine phospholipase C:direct evidence obtained by gene complementation[J].Infection and Immunity,1993,61(4):1576-1580.
[10] Kreft J,V zquez-Boland J A.Regulation of virulence genes in Listeria[J].Int J Med Microbiol,2001,291:145-157.
[11] Abram F,Su W L,Wiedmann M,et al.Proteomic analyses of a Listeria monocytogenes mutant lacking σBidentify new components of the σBregulon and highlight a role for σBin the utilization of glycerol[J].App Environ Microbiol,2008,74(3):594-604.

