转人血清白蛋白基因奶牛多重PCR快速检测方法的建立
朱振营,林祥梅,刘 建*,吴绍强,仇松寅,王建武,薛振华
(1.中国检验检疫科学研究院 动植物检疫研究所,北京100029;2.中国农业大学农业生物技术国家重点实验室 北京100193,3.北京市畜牧兽医总站,北京100107)
1982年“硕鼠”的问世[1],使转基因动物成为当今生命科学发展中的热门领域。1997年世界首例体细胞克隆绵羊“多莉”的诞生,促进了转基因技术在大动物方面的广泛应用。目前国内外已成功研制多种用于生产药用或食用蛋白、提高瘦肉率、改善营养、增强抗病力的转基因猪、牛、羊[3-8]。2006年GTC公司转基因克隆羊生产的药物抗凝血酶Ⅲ(商品名:ATryn)在欧洲上市,2009年在美国上市,标志着转基因动物应用正走向产业化道路。
由于转基因生物及其产品存在风险,转基因生物及产品的管理一直受到各国政府的高度重视。而建立规范、准确、快速的转基因成分检测技术,是维护消费者知情同意权和在国际贸易中维护国家利益的重要保障。
转基因植物检测技术的研究已开展多年,常用的检测技术包括:第一类是在整合水平上进行的检测;第二类是在转录水平上进行的检测;第三类是在表达水平上进行的检测。国际上比较认同的检测技术是利用PCR方法对外源基因进行整合水平检测[8]。
目前对具有商品化前景的转基因家畜的检测平台尚待建立,本研究以通过体细胞核移植技术制作的转人血清白蛋白基因的奶牛[7]为研究对象,针对内源基因B2M、外源基因hLF及标记基因EGFP和NptII建立了多重PCR检测方法,旨在对我国出入境检验提供技术支持,为转基因标识制度在转基因动物及其产品中的顺利实施提供借鉴。
1 材料与方法
1.1 材料
本试验所用转人血清白蛋白基因奶牛基因组来自中国农业大学农业生物技术国家重点实验室。
1.2 试剂
PCR用Taq DNA聚合酶、dNTPs及缓冲液购自宝生物工程(大连)有限生物有限公司,pGEM-T载体购自Promega公司,琼脂糖凝胶DNA纯化试剂盒、微量质粒抽提试剂盒购自OMEGA公司。
1.3 引物
根据序列号为NM_173893.3的序列设计奶牛基因组内源性基因B2M的引物,根据序列号为AB049976的序列设计α-LA基因的引物,根据生产转基因奶牛时构建的载体设计NPTⅡ和EGFP基因的引物。上述引物(表1)均由Beacon Designer 7.0设计,由北京Invitrogen公司合成。
1.4 单一PCR检测
PCR反应体系为25μ L,其中ddH2O 17.25 μ L,10×PCR buffer(含25 mmol/L MgCl2)2.5 μ L,dNTP(2.5 mmol/L)2 μ L,上下游引物(均为10 pmol/L)各为1 μ L,rTaq DNA聚合酶(5 U/μ L)0.25 μ L,基因组(100 mg/L)1 μ L。PCR反应
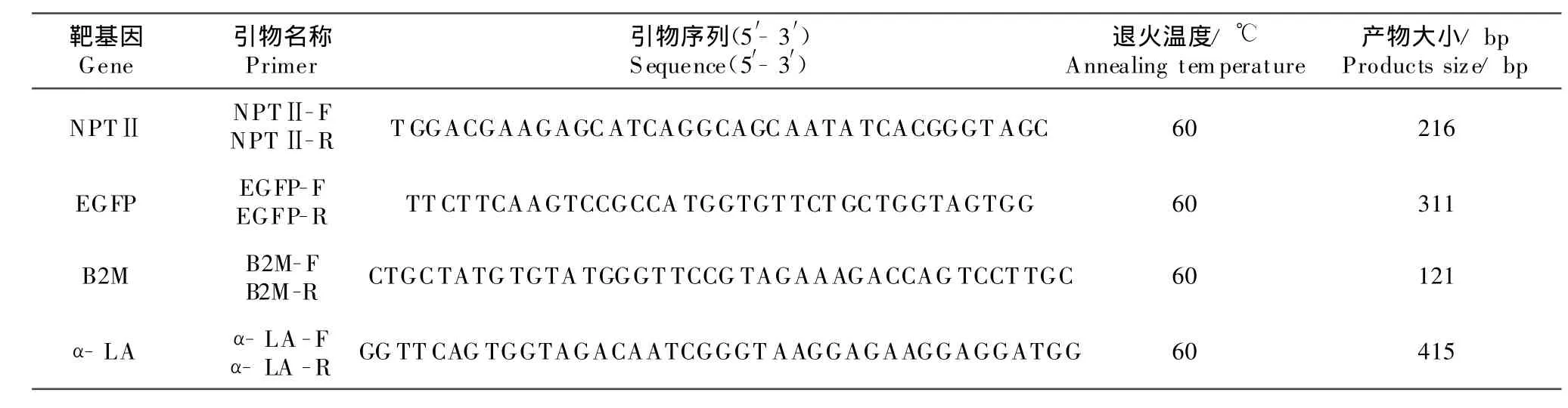
表1 多重PCR引物序列T able 1 primer sequences of multiplex PCR
条件:预变性94℃5 min;94℃30 s,58℃30 s,72℃30 s,共30循环;延伸反应72℃7 min。PCR产物用20 g/L琼脂糖凝胶电泳进行鉴定后,回收目的片段。将已纯化的目的基因片段连接到pGEM-T载体,转化至E.coli DH5α中,挑取单克隆经PCR鉴定后,送北京诺赛基因有限公司测序。
1.5 多重PCR检测
多重PCR反应体系为25 μ L,其中ddH2O 17.50 μ L,10×PCR buffer(含25 mmol/L MgCl2)2.5 μ L,dNTP(2.5 mmol/L)2 μ L,NPTⅡ、α-LA、EGFP基因上下游引物(均为10 pmol/L)各0.25 μ L;B2M基因上下游引物(均为10 pmol/L)各0.125 μ L,rTaq DNA聚合酶(5 U/μ L)0.25 μ L,基因组1(100 mg/L)μ L。PCR反应条件:预变性94℃5 min,94℃30 s,60℃30 s,72℃30 s,共40循环,延伸反应72℃7 min。PCR产物用20 g/L琼脂糖凝胶电泳进行鉴定。
2 结果
2.1 单一PCR扩增结果
检测外源基因α-LA,NPTⅡ和EGFP 2时只有转基因阳性奶牛有条带扩增,野生型奶牛和空白对照均无条带扩增,检测内源基因B2M时,转基因阳性奶牛和野生型奶牛均有条带,空白对照无条带,与预期结果一致(图1)。为了保证扩增结果的准确性,4个基因序列都克隆测序,NPTⅡ和EGFP测序结果与生产此转基因奶牛的质粒载体序列比对,100%同源;B2M与GenBank中奶牛B2M基因序列100%同源;α-LA测序结果与GenBank中人α-LA基因序列99.8%同源。
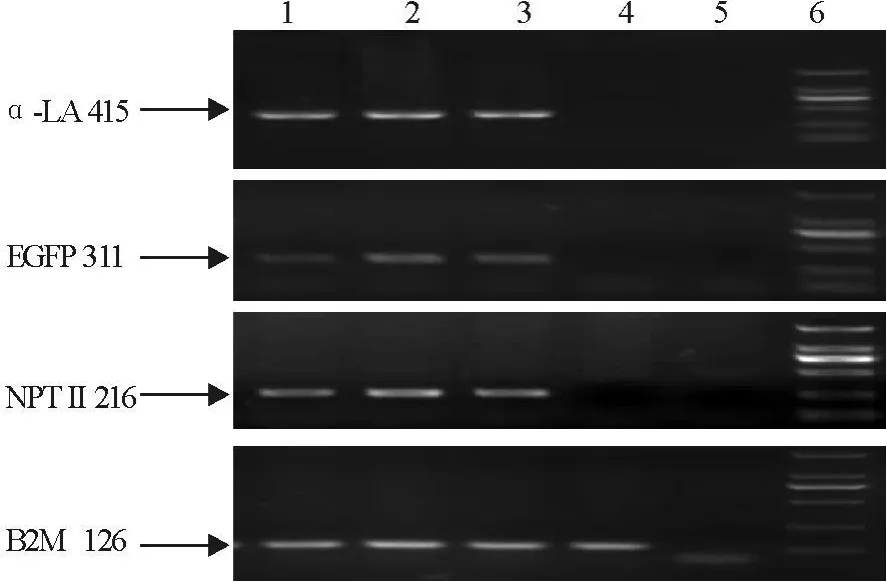
图1 各引物PCR扩增结果Fig.1 PCR products amplified with each primer pairs
2.2 不同退火温度的多重PCR结果
因为单一PCR扩增时各引物的退火温度均较宽(数据未发表),选择55℃~60℃范围内进行多重PCR扩增。随着温度的升高4条带逐渐都得到较好的扩增,以60.5℃扩增效果最好(图2)。

图2 温度梯度多重PCR扩增Fig.2 Multiplex PCR products amplified from gradient annealing temperature
2.3 转基因奶牛多重PCR扩增结果
转基因阳性奶牛基因组的多重PCR扩增条带大小与预期一致,3种基因奶牛基因组均能扩增4条特异性条带,而野生型奶牛只能扩增内源基因B2M,空白对照没有任何条带(图3)。

图3 多重PCR扩增结果Fig.3 Multiplex PCR amplification
3 讨论
多重PCR一个反应即可检测一个转基因样品中的多种外源基因结构,尽可能排除假阳性或假阴性,使检测结果更可靠。也正因为多序列同时扩增,使反应的敏感性受到很多因素的影响,如不同引物对之间的相对浓度、退火温度、缓冲液浓度、Mg2+浓度等[9]。本研究对引物对相对浓度、退火温度进行了优化,添加相同的引物浓度时,内源基因B2M扩增效果最好,其它引物对扩增较弱,而当减少B2M引物对至原来一半时,各个引物对均得到较好扩增;从图2可以看出随着温度的升高,多重PCR扩增效果越来越好。转基因产品检测中,如果延长延伸时间,就可能产生过度延伸的产物,从而影响结果的判断。为了避免产生这种非特异性条带,PCR延伸时间应适当缩短[10],因考虑到本研究选取的的4对引物相隔较远(至少2 000 bp),延伸时间适当延长亦不会产生过度延伸的产物,本研究中延伸时间选择为1 min或30 s时,均能很好的扩增三个条带,但考虑到节省时间,所以延伸时间选择30 s。
转基因产品检测时,通过对内源基因进行PCR检测,可以判断样品核酸的质量,即如果内源基因扩增失败,说明所抽提的核酸中不含该动物的DNA或者所抽提的核酸含有PCR抑制物质,从而可以避免转基因检测的假阴性结果,而内源基因是单拷贝基因时,能更好的避免假阴性结果。本试验选择的内源基因B2M是单拷贝基因,不但可以作为多重PCR的内源基因,还可以为外源基因定量检测及拷贝数的确定提供借鉴。考虑到检测过程中基因组DNA片段会有不同程度的降解,内源基因的扩增片段应选择较短的目的序列,本研究中内源基因B2M扩增长度为121 bp,可有效保证转基因动物及衍生产品的检测效果。
EGFP和NPTⅡ是制作转基因动物时常用的标记基因,动物自身不携带这两种基因,利用这两种基因建立的检测方法可以对转基因动物进行初步筛查。对待检样品进行检测时,如果能同时扩增出两条特异性条带,或两条特异性条带中任意一条,可以说明待检样品是转基因样品。但是很多转基因动物不含有这两个原件,因此单靠两个标记基因对转基因动物及其产品进行筛查很容易出现假阴性的结果。而且转基因动物没有统一启动子和终止子,不同的表达蛋白往往需要不同的启动子和终止子。这些因素为转基因动物及产品筛查检测技术平台的建立提供了难题。
由于转基因产品的安全性评价具有累积性和潜在性特点,并与社会、文化及伦理等多方面因素互为影响,所以需要多方位长期系统的监测才能对其安全性作出较为客观的评价,建立转基因产品的检测技术平台尤为重要。本研究建立的多重PCR方法可用于转基因奶牛的检测,为转基因动物及产品的出入境检验及检测标准的建立提供参考。
[1] Palmiter R D,Brinster R L,Hammer R E,et al.Dramatic growth of mice that develop from egg s micro injected with a metallothionein-growth hormone fusion gene[J].Nature,1982,300(5893):611-615.
[2] Wilmut I,Schnieke A E,McWhir J,et al.Viable offspring derived from fetal and adult mammalian cells[J].Nature,1997,385(6619):810-813.
[3] Schnieke A E,Kind A J,Ritchie W A,et al.Human factor IX transgenic sheep produced by transfer of nuclei from transfected fetal fibroblasts[J].Science,1997,278(5346):2130-2133.
[4] Lai L,Kang J X,Li R,et al.Generation of cloned transgenic pigs rich in omega-3 fatty acids[J].Nat Biotechnol,2006,24(4):435-436.
[5] Kuroiwa Y,Kasinathan P,Sathiyaseelan T,et al.Antigenspecific human polyclonal antibodies from hyperimmunized cattle[J].Nat Biotechnol,2009,27(2):173-181.
[6] Yang P,Wang J,Gong G,et al.Cattle mammary bioreactor generated by a novel procedure of transgenic cloning for largescale production of functional human lactoferrin[J].PLoS One,2008,3(10):e3453.
[7] Wang J,Yang P,Tang B,et al.Expression and characterization of bioactive recombinant human alpha-lactalbumin in the milk of transgenic cloned cows[J].J Dairy Sci,2008,91(12):4466-4476.
[8] Germini A,Zanetti A,Salati C,et al.Development of a seventarget multiplex PCR for the simultaneous detection of transgenic soybean and maize in feeds and foods[J].J Ag ric Food Chem,2004,52(11):3275-3280.
[9] 黄银花,胡晓湘,徐慰倬,等.影响多重PCR扩增效果的因素[J].遗传,2003,25(10):65-68.
[10] 王趁芳,李新云,王志伟,等.转基因小鼠的多重PCR快速检测技术[J].畜牧兽医学报,2009,40(2):185-190.

