腺病毒介导的热休克蛋白 70表达对神经元氧化应激损伤的保护作用
宋晓聪,杨芳芳,胡 丹,曲 彦
热休克蛋白 (heat shock proteins,HSPs)是生物体或离体培养细胞在热应激等不良环境下由热休克基因编码产生的一组具有高度保守性的应激蛋白,广泛存在于原核细胞和真核细胞中。在热休克蛋白家族中,热休克蛋白 70(heat shock protein 70,HSP70)家族是最保守、最丰富,也是研究最为深入的一种[1]。在脑卒中、颅脑创伤等所致的脑缺血再灌注过程中,脑缺血缺氧引起的氧化应激反应所产生的大量氧自由基是引起脑损伤的主要原因之一[2]。目前,如何保护神经组织免受氧化应激损伤成为医学研究的一个重要课题。本实验以重组腺病毒介导外源性 HSP70在体外培养的神经元和胶质细胞中表达,再以过氧化氢 (H2O2)诱导细胞损伤作为细胞氧化应激损伤的模型,观察外源性 HSP70表达对 H2O2所致神经元和胶质细胞毒性的影响,以探讨 HSP70是否具有抗氧化的神经保护作用。
1 材料与方法
1.1 主要材料和试剂 重组腺病毒 vAd-HSP70和腺病毒载体对照 vAd-GFP由本课题组构建并保存[3]。乳酸脱氢酶(LDH)检测试剂盒购于南京建成科技有限公司;鼠抗人HSP70单克隆抗体购于美国 Santa Cruz生物技术公司;辣根过氧化物酶标记羊抗鼠 IgG和羊抗兔 IgG购于北京博奥森生物技术有限公司。
1.2 体外神经元和胶质细胞的培养 取出生时间 <24 h的新生昆明种小鼠 (购自青岛市药品检验所),在无菌条件下断头取大脑皮质,去除软脑膜,剪碎皮质,经消化、离心,加培养液制成细胞悬液,接种于 75 cm2培养瓶,置 37℃,5%CO2培养箱中培养。具体过程参见文献 [4]。靶细胞主要为神经元和胶质细胞。
1.3 感染靶细胞及氧化应激模型的建立
1.3.1 实验分组 对照组包括正常细胞对照组 (未感染组)和腺病毒对照组 (vAd-GFP感染组);实验组为重组腺病毒vAd-HSP70感染组。病毒感染组在感染 48 h时经 0.5 mol/L H2O2处理,同时未感染组也给予氧化应激处理。
1.3.2 感染靶细胞 体外培养神经元和胶质细胞达 70%~80%融合时,弃去培养液,用 PBS洗细胞单层一次,接种 200 μl低温保存的重组腺病毒悬液,37℃吸附 30 min,加维持液继续培养。
1.3.3 氧化应激模型 将 30%H2O2用无血清 DMEM稀释成终浓度为 0.5 mmol/L的处理液,现配现用。将 3组细胞在无菌条件下弃去培养液,加入配好的处理液,液体完全覆盖靶细胞作用 1 h。之后,弃去处理液,PBS冲洗 1次,加入正常培养液继续培养 24 h后做相应检测。
1.4 病毒感染靶细胞效应的检测 采用 RT-PCR检测靶细胞中 HSP70转录,Western blotting检测靶细胞中 HSP70蛋白表达,MTT检测细胞增殖。
1.4.1 RT-PCR检测靶细胞中 HSP70转录 收集病毒感染48 h后的各组细胞,Trizol一步法提取细胞总 RNA,按照反转录试剂盒要求的标准条件合成 cDNA用作 PCR模板。利用Primier primer 5.0引物设计软件设计扩增 HSP70编码基因的特异性引物,上游引物 5′-CGGGTACCCAACGACGGAGACAGCC-3′, 下游引物 5′-GCGATATCTCCAGCCACGAGATGACC-3′,扩增产物长度为 1 486 bp。PCR反应体系及扩增条件参见文献 [4]。取5μl PCR扩增产物于 0.8%的琼脂糖凝胶 (含0.5 mg/L溴化乙锭)中电泳,凝胶自动成像系统观察结果。
1.4.2 Western blotting检测靶细胞中 HSP70蛋白表达 重组腺病毒感染靶细胞 48 h后收集细胞,用裂解液 (400μl RIPA+4μl PMSF)提取细胞总蛋白,取 50μg蛋白上样行 SDSPAGE电泳、转膜、封闭,依次加抗 HSP70抗体 (1∶500稀释)、兔抗鼠抗体 (1∶500稀释)作用,最后 X线片曝光、显影和定影后观察结果。
1.4.3 MTT检测细胞增殖 制备 1×106个 /ml的对数生长期细胞悬液接种于 96孔细胞培养板,每孔 200μl。细胞过夜贴壁后每孔接种病毒 2μl,vAd-GFP感染组和 vAd-HSP70感染组均设 3个平行孔,以无细胞培养液孔作为对照孔。经氧化应激处理后各孔加 10μl MTT溶液 (5 mg/ml),37℃继续培养 4 h,每孔加 150μl二甲基亚枫 (DMSO)终止反应,振荡10 min,用酶标检测仪在 490 nm波长下测定吸光度 (A)值。测定 3次取平均值。
1.4.4 LDH活力检测 取对数生长期细胞,接种于 24孔培养板,细胞过夜贴壁后每孔接种重组腺病毒 5μl,根据实验分组,每组均设 6个平行孔,各组经氧化应激处理后24 h,收集培养上清液,检测 LDH活力,取 6次检测值的平均值。
1.4.5 电镜检测细胞超微结构 将各实验组细胞经 H2O2处理后收集,固定、脱水、常规包埋、超薄切片、染色后在透射电镜下观察、拍照。
1.5 统计学方法 采用 SPSS 13.0统计软件进行统计学处理,数据以 (x±s)表示,3组均值间的比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 靶细胞中重组腺病毒 vAd-HSP70的表达 倒置荧光显微镜观察可见重组腺病毒感染靶细胞 48 h后感染率达 80%(见图1)。RT-PCR检测结果显示重组腺病毒 vAd-HSP70感染组可观察到 HSP70编码基因 1 486 bp的特异性扩增带;而未感染组和 vAd-GFP感染组细胞无此条带 (见图 2)。Western blotting检测结果显示重组腺病毒 vAd-HSP70感染组出现HSP70蛋白条带;而未感染组和 vAd-GFP感染组细胞相应位置无特异条带 (见图3)。
2.2 HSP70表达对靶细胞活力的影响 H2O2氧化应激处理后,用 MTT法检测各组的吸光度值以间接反映细胞活力,连续检测 6 d。vAd-HSP70感染组细胞活力始终高于其他两组(P<0.01,见表 1),表明细胞有较强的生长能力。从第 4天起,vAd-GFP感染组和未感染组细胞逐渐凋亡 (见图 4)。

图 1 重组腺病毒感染 48 h后的靶细胞Figure 1 The target cellsinfected by recombinant adenovirus at 48 h A:vAd-HSP70 infected target cells;B:vAd-GFP infected target cells
2.3 LDH活性变化 各组细胞氧化应激处理 24 h后,vAd-HSP70感染组培养液中 LDH活性为 (976±106),低于 vAd-GFP感染组和未感染组 〔分别为 (1 332±197)和 (1 380±121)〕,差异有统计学意义 (P<0.01),而 vAd-GFP感染组和未感染组培养液中 LDH活性间差异无统计学意义 (P>0.05)。
2.4 透射电镜下观察细胞超微结构的变化 透射电镜下观察经 H2O2处理后各组细胞超微结构的变化。vAd-HSP70感染组细胞的胞膜较清晰完整,细胞核致密,核膜清晰,其形态与正常对照细胞接近。vAd-GFP感染组和未感染组细胞的胞膜边界不清,细胞质中出现空泡,核仁松散甚至核仁组分分离,部分细胞可见细胞核裂解等不可逆性损伤 (见图 5)。

图 2 RT-PCR检测神经元中 HSP70的表达Figur e 2 HSP70 expression in neuronal cells detected by RT-PCR lane 1:PCR marker DL2000;lane 2:positive control(Hela cells);lane 3:vAd-HSP70 infected neuronal cells;lane 4:vAd-GFPinfected neuronal cells;lane 5:uninfected neuronal cells control

图 3 Western blotting检测神经元中 HSP70的表达Figure 3 HSP70 expression detected by Western blotting in neuronal cells Lane 1:positive control(MCF-7 cells);Lane 2:vAd-HSP70infected neuronal cells;lane 3:vAd-GFP infected neuronal cells;Lane 4:uninfected neuronal cells control

图 4 HSP70表达对靶细胞增殖能力的影响Figure 4 The effect of HSP70 expression on target cell proliferation
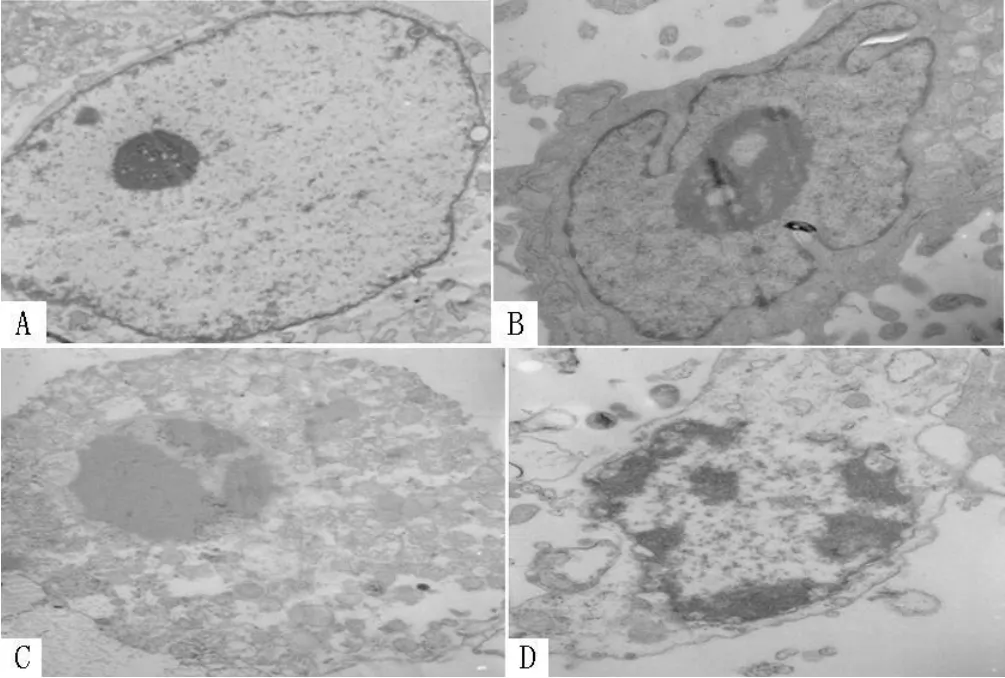
图 5 透射电镜观察各组细胞超微结构变化 (×10 000倍)Figur e 5 The changesof the ultrastructure of cells observed with the transmission electron microscope A:neuronal cells control;B:vAd-HSP70 infected neuronal cells;C:vAd-GFP infected neuronal cells;D:uninfected neuronal cells control

表 1 MTT检测各组细胞的活力 (x±s)Table 1 Viability of cells tested by MTT
3 讨论
氧化应激是缺血再灌注引起组织损伤的主要原因之一,而脑组织对缺血缺氧最为敏感,耐受性差。此外,临床上有许多神经退行性疾病如脊髓侧索硬化症、帕金森病、阿尔茨海默病等都被认为与氧化应激损伤有关[5]。近年来,通过高热预处理诱导内源性 HSP的表达以探讨 HSP的细胞保护作用的研究较多。Joyeux等[6]研究表明高热预处理可以抵抗大鼠心肌的缺血再灌注损伤。体外实验也证明高热预处理对 H2O2所致的心肌细胞氧化应激损伤具有保护作用[7]。张广雄等[8]研究表明高热预处理对神经元的氧化应激损伤有保护作用。本实验通过成功诱导体外培养的神经元中外源性 HSP70的表达,来探讨外源性 HSP是否同样具有抗氧化应激的保护作用。
成功诱导外源性 HSP表达成为本研究的关键。本研究采用重组腺病毒为载体将外源性 HSP70编码基因导入靶细胞,该载体系统具有构建简单,宿主广泛,感染效率高,特异性强,安全性好等特点。由于重组腺病毒携带 GFP的编码基因,因此可在包装增殖的同时直接用荧光显微镜观察转染及感染效率。且重组腺病毒 vAd-HSP70能有效感染小鼠原代神经元,用 RT-PCR和 Western blotting在重组腺病毒 vAd-HSP70感染的神经元均可检测到 HSP70的表达,而未感染组和 vAd-GFP感染组的神经元未检测到 HSP70的表达,表明重组腺病毒能在靶细胞中有效表达。
MTT可反映细胞内线粒体内膜琥珀酸脱氢酶的活性,从而反映线粒体的功能,因此,被广泛用作细胞呼吸和活力的指标,反映线粒体的整体功能。线粒体是细胞供能的场所,其功能丧失意味着细胞死亡,因此同等条件下 MTT检测吸光度值大小可以反映细胞活力的高低。各组细胞经 H2O2处理后,对照组细胞的活力明显下降,与 vAd-GFP感染组比较,重组腺病毒 vAd-HSP70感染组细胞仍有较强的活力;表明重组腺病毒介导的外源性 HSP70表达能维持线粒体的整体功能,从而抵抗 H2O2诱导的氧化应激损伤,起到细胞保护作用。
LDH是细胞内的标志酶。细胞受损时,细胞膜通透性升高,细胞内 LDH释放至细胞上清液,且释放量与细胞受损程度呈正相关,因此通过检测细胞上清液中 LDH释放量即可反映细胞受损情况。LDH的检测结果显示,各组细胞经 H2O2处理后,对照组的细胞培养上清液中 LDH活力明显增加。这表明 H2O2诱导的氧化应激损伤能导致细胞膜的损伤;而 vAd-HSP70感染组细胞培养液中 LDH活力则较低,提示外源性HSP70在靶细胞中的表达能增强细胞膜的稳定性,对细胞起到保护作用。由此可见,HSP70过表达可显著减轻神经元和胶质细胞氧化应激损伤的程度。
各种原因导致的脑组织缺血缺氧损伤,都伴随大量氧自由基的产生,氧自由基能够直接损伤多种细胞器从而使细胞超微结构发生变化。电镜结果显示,H2O2作用 1 h后,vAd-HSP70感染组细胞的胞膜完整,核仁致密,核膜清晰,大多数细胞线粒体清晰可见;而其他两组细胞损伤明显,大量细胞的胞膜界限不清,线粒体肿胀,核仁松散甚至核仁组分分离,部分细胞可见细胞核裂解等不可逆性损伤。电镜结果与 MTT及LDH检测结果相符合,这也能够进一步解释 H2O2处理后第 1天 vAd-HSP70感染组细胞活力就明显大于其他两组细胞的原因。
综上所述,重组腺病毒 vAd-HSP70介导的外源性 HSP70基因在体外培养的神经元和胶质细胞中表达可以起到抗氧化应激的作用。这与 Yenari等[9]研究结果一致,其采用嗜神经性单纯疱疹病毒作为载体将 HSP70基因导入脑卒中、心跳停止和中毒等实验动物模型中,结果显示外源性 HSP70高表达可提高神经元的存活率,能抵抗不同原因所致的脑损伤。本课题组的研究也表明,腺病毒介导的外源性 HSP70表达可保护体外培养的神经元和胶质细胞抵抗缺氧再复氧损伤,具有明确的细胞保护作用[4]。然而目前,对外源性 HSP70具体的作用机制仍不明确。于如同等[10]实验显示,高热预处理可以减少氧化应激神经元一氧化氮 (NO)的产生,从而起到神经保护作用。大量研究表明,应激状态下,HSP70可在细胞内不同的部位定位,如线粒体、内质网、细胞骨架等,以发挥其抗损伤的作用[11-12]。在应激状态下,核仁的结构与功能会发生改变,HSP70可向核仁移位从而减轻氧化应激所致细胞核仁损伤[13-14]。这一机制与本研究结果一致。高热预处理诱导内源性 HSP70表达对细胞的保护作用机制与外源性 HSP70的作用机制是否一致,这一问题需要进一步的研究。
本课题组成功构建了携带 HSP70基因的重组腺病毒,并能在靶细胞中有效地表达,且进一步证实了重组腺病毒介导的HSP70表达在神经元中有明显的抗缺氧及抗氧化应激作用。这为以后的体内实验奠定了基础。
1 Kiang JG,Tsokos GC.Heat shock protein 70kDa:molecular biology,biochemistry,and physiology[J].Pharmacol Ther,1998,80(2):183-201.
2 Mikawa S,Sharp FR,Kamii H,et al.Expression of c-fos and hsp70 mRNA after traumatic brain injury in tansgenic mice over expressing Cu Zn-superoxide dismutase[J].Brain Res Mol Brain Res,1995,33(2):288.
3 徐小娜,曲彦 .热休克蛋白 70重组腺病毒载体的构建及鉴定[J].青岛大学医学院学报,2008,44(2):162-167.
4 杨芳芳,徐晓娜,曲彦,等 .腺病毒介导的 HSP70对缺氧再复氧损伤后神经细胞生长状态的影响 [J].中国危重病急救医学,2008,20(11):681-684.
5 Christen Y.Oxidative stress and Alzheimer disease[J].Am J Clin Nutr,2000,71(2):621S-629S.
6 Joyeux M,Ribuot C,Bourlier V,et al.In vitro antiarrhythmic effect of prior whole body hyperthermia:implication of catalase[J].J Mol Cell Cardiol,1997,29(12):3285-3292.
7 肖卫民,蒋碧梅,肖献忠,等 .热休克蛋白抑制过氧化氢所致C2C12细胞凋亡的机制 [J].中南大学学报 (医学版),2004,29(1):6-10.
8 张广雄,罗爱林.高热预处理对 PC12细胞氧化应激损伤的保护作用 [J].华中医学杂志,2006,30(2),79-81.
9 Yenari MA,Dumas TC,Sapolsky RM,et al.Gene therapy for treatment of cerebral ischemia using defective herpes simplex viral vectors[J].Ann N Y Acad Sci,2001,93(9):340-357.
10 于如同,高立达,官鹏,等.热休克对氧化应激神经元产生 NO的影响 [J].徐州医学院学报,1999,19(5):351.
11 Kregel KC.Molecular biology of thermoregulation invited review:heat shock proteins:modifying factors in physiological stress responses and acquired thermotolerance[J].J Appl Physiol,2002,92(5):2177-2186.
12 Giffard RG,Yenari MA.Many mechanisms for HSP70 protection from cerebral ischemia[J].Neurosurg Anesthesiol,2004,16(1):53-61.
13 Horky M,Wurzer G,Kotala V,et al.Segregation of nucleolar components coincides with caspase-3 activation in cisplatin-treated HeLa cells[J].JCell Sci,2001,114(Pt 4):663-670.
14 徐自智,王慷慨,肖献忠,等.氧化应激对热休克蛋白 70核仁分布的影响 [J].中南大学学报 (医学版),2005,30(4):384-389.

