18种青黛 7-氮杂靛玉红对 6种肿瘤细胞增殖的影响
刘雅波,陶文沂
1江南大学医药学院,无锡 214122;2江南大学教育部工业生物技术重点实验室,无锡 214122
18种青黛 7-氮杂靛玉红对 6种肿瘤细胞增殖的影响
刘雅波1,陶文沂2*
1江南大学医药学院,无锡 214122;2江南大学教育部工业生物技术重点实验室,无锡 214122
本文阐述了利用MTT法测定青黛中18种 7-氮杂靛玉红衍生物对 6种肿瘤细胞增殖的抑制作用。化合物 1~18(1.25~20μmol/L)处理肿瘤细胞 72 h后,观测细胞生长抑制作用,分析其结构-疗效关系。结果发现具有相同结构特征即 R位上的N-OH基团和 R3′位上的Br(Cl)基团的化合物 10~15可显著抑制 6种肿瘤细胞的增殖,与此相反,无此结构特征的化合物 1~9的抑制作用大大降低。初步确定,R位上的N-OH基团和 R3′位上的Br(Cl)基团是 7-氮杂靛玉红衍生物抗肿瘤作用的主要活性部位。
青黛;7-氮杂靛玉红;靛玉红;抗肿瘤活性;MTT法;IC50值
青黛为爵床种植物马蓝B aphicacanthus cusia(Ness)Bremek.蓼科植物蓼蓝Polygonum tinctoriumAit.豆科植物木蓝Indigofrra tinctoriaL.或十字花科植物菘蓝 Isatis indigotica Fort.的茎叶经加工制得的粉末状物或团块,主产于福建、云南、江苏、安徽等地,以福建产者质量最佳,为建青黛。传统医学认为,青黛具有清热解毒,凉血止血、清肝泻火等功能,对温病热盛、斑疹、吐血、咯血、小儿惊痫、疮肿、丹毒、湿疹等病证有良好的疗效。现代药理学研究表明[1]:青黛具有抗菌和抗肿瘤等药理作用。
靛玉红 (indirubin)是中国在 70年代中期自主开发的抗肿瘤药物,它是从青黛中分离得到的抗肿瘤有效成分[2]。靛玉红及其衍生物是一类双吲哚杂环平面结构的化合物。国外学者近年来对靛玉红及其衍生物抗癌机理的研究表明[3,4],靛玉红及其衍生物对细胞内广泛存在的细胞周期依赖性蛋白激酶 (CDK)具有抑制作用,导致癌细胞的细胞周期停滞,从而抑制肿瘤细胞增殖。为进一步探讨靛玉红衍生物的抗肿瘤活性成分,我们用氮原子置换了原先靛玉红分子吲哚苯环 7号位上的碳原子,获得了新型的 7-氮杂靛玉红分子,并在此基础上进行了一系列的化学结构修饰,设计制得 59种 7-氮杂靛玉红衍生物[5]。本文首次对其中的 l8种单体化合物进行了体外抗肿瘤活性评价。

图 1 受试化合物的化学结构Fig.1 Chemical structure of the tested compounds
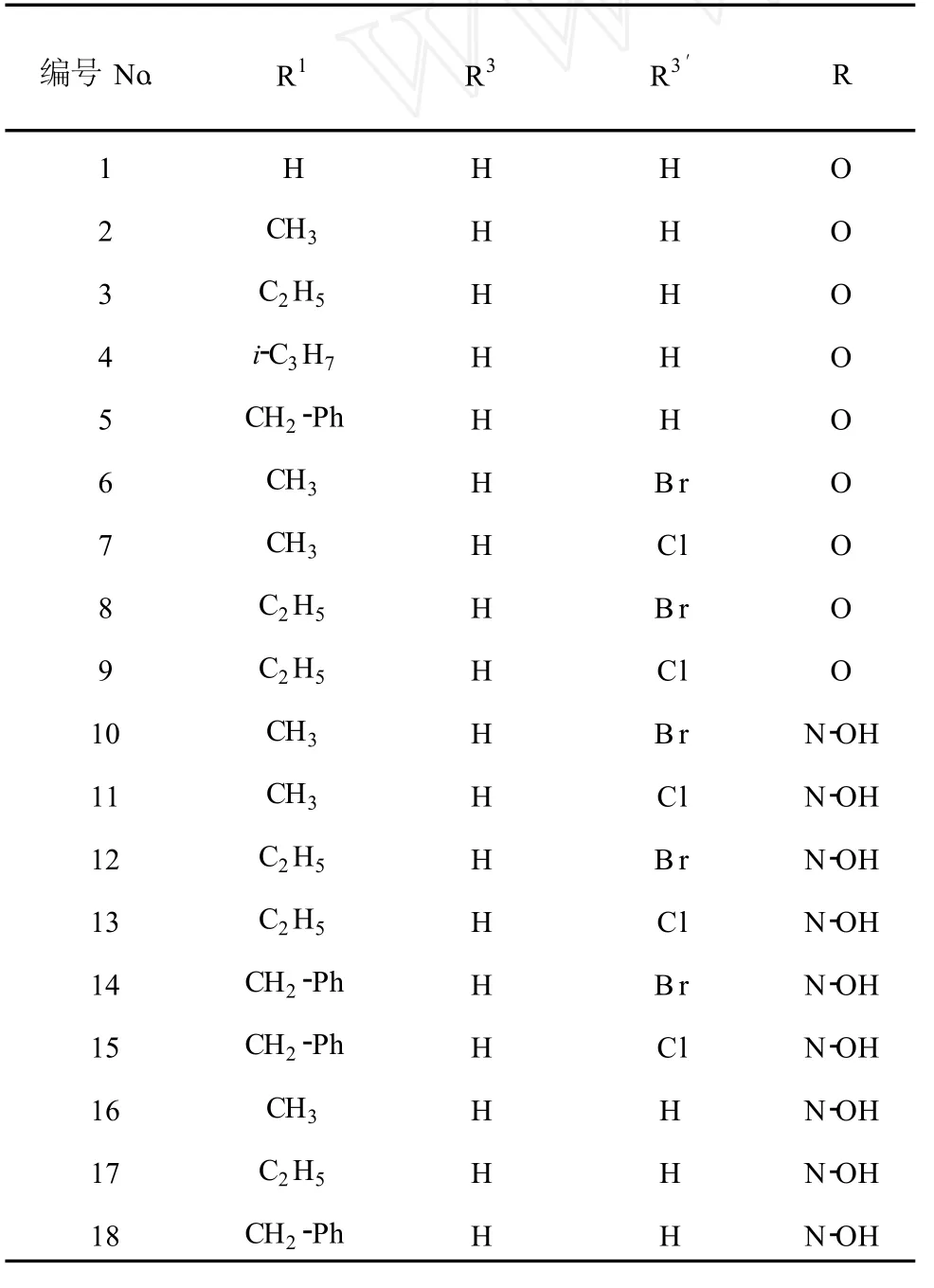
表 1 18种 7-氮杂靛玉红衍生物的结构Table 1 Chemical structure of eighteen 7-nitrogen substituted indirubin derivatives
1 材料与方法
1.1 药物
18种 7-氮杂靛玉红衍生物均由无锡杰西医药公司程景才老师提供,全部经红外光谱 (IR)、紫外光谱(UV/V IS)、质谱 (ESI-MS)、氢谱 (1H NMR)和元素分析结构确证,其化学结构见图 1和表 1;阳性对照药 N-1-甲基异靛蓝(甲异靛片,北京协和药厂,批号 H 20010652)。
1.2 细胞株
人白血病细胞株 HL-60、人卵巢癌细胞株 SKOV-3和人肝癌细胞株 Bel-7402由中科院上海药物研究所提供;人乳腺癌细胞株MDA-MB-231、人肝癌细胞株 HepG-2和小鼠黑色素瘤细胞株 B16由江南大学医药学院提供。
1.3 试剂与仪器
RPM IMedium 1640(批号 P1502,Gibco公司); DMEM Medium(批号 D1248,Gibco公司);胰蛋白酶 (批号 T0309,Gibco公司 );胎牛血清 (批号030909,Gibco公司);噻唑蓝 (MTT,批号 BS0887, Sino American biotec);HEPES(批号 B0021,Sanland-Chem International);L-谷氨酰胺 (批号 G0431,Sigma公司);二甲基亚砜 (DMSO,批号 T0724,Sigma公司)。
CO2培养箱 (Thermos8000,Ther mos);倒置相差显微镜 (CKX41,Olympus);酶标仪 (RS-232C, Thermos);低温高速离心机 (J2-HS,Beckman公司);磁力搅拌器(95-1,上海安亭电子仪器厂);电热恒温水槽(DK-8D型,上海精宏实验设备有限公司)。
1.4 方法
1.4.1 药物制备
受试化合物以DMSO配置成浓度为20 mmol的储备液,-20℃保存备用。实验时以 RPM I 1640或DMEM培养液 (含 10%的灭活胎牛血清,100μg/ mL的青链霉素)稀释,配制成梯度浓度为 1.25~20 μmol/L含药培养液(药物浓度以 2倍递增)。
1.4.2 肿瘤细胞培养
以 RPM I 1640培养液 (含 10%的灭活胎牛血清,100μg/mL的青链霉素)按照一般悬浮细胞传代培养的方法[6]培养白血病 HL-60细胞;以 RPM I 1640培养液(含 10%的灭活胎牛血清,100μg/mL的青链霉素)按照一般贴壁细胞传代培养的方法[7]培养人肝癌 BEL-7402,人乳腺癌 MDA-MB-231和小鼠黑色素瘤B16细胞;以DMEM培养液(含10%的灭活胎牛血清,100μg/mL的青链霉素)按照一般贴壁细胞传代培养的方法[8]培养人卵巢癌 SK-OV-3和人肝癌 HepG-2细胞。肿瘤细胞置于 37℃、5% CO2培养箱中培养,每 2~3 d传代一次。实验时取对数生长期细胞,混匀后计数,苔盼蓝染色。实验用活细胞应在 98%以上。
1.4.3 实验分组
取小鼠黑色素瘤 B16、人肝癌 HepG-2、人肝癌BEL-7402、人白血病 HL-60、人卵巢癌 SK-OV-3和人乳腺癌MDA-MB-231 6株细胞瘤株。每个瘤株设有 20、10、5、2.5、1.25μmol/L浓度梯度的试药组,另设培养液阴性对照组和甲异靛阳性对照组,每一浓度设 8个复孔。
1.4.4 MTT法测定 7-氮杂靛玉红衍生物对肿瘤细胞株的抑制作用[9]
取对数生长期细胞,离心,计数,以含 10%的灭活胎牛血清的 RPM I 1640或 DMEM培养液配成细胞浓度为 2.5×104/mL的细胞悬液,接种于 96孔板,每孔约 5000个细胞/200μL。细胞株于 37℃, 5%CO2条件下培养 24 h后,分别加入上述药物浓度(共接种7组,包括 2个对照组),每组设立 8个复孔。孵育 72 h后,进行MTT快速比色,在酶标仪上以 540 nm为测定波长,630 nm为参比波长测定吸光度(A)值。
细胞生长抑制率(%)=100×(1-实验组平均A540/阴性对照组平均 A540)
细胞生长抑制指数通过 I C50(药物半数抑制浓度)来表示,以浓度-抑制率曲线求出回归方程,得出50%抑制浓度 (I C50)。
1.4.5 数据统计学处理
实验数据来自 4次独立实验,所有数据以 x ±s表示,并采用 SPSS统计软件进行处理组间和区组间方差分析。
2 结果与讨论
青黛为我国传统中药材,历史悠久,具有较为广泛的生物活性。近些年来,国内外的药物化学工作者对青黛中抗肿瘤有效成分——靛玉红衍生物进行了广泛的结构修饰,以改善其溶解性,进而增强其抗肿瘤活性[10,11]。与靛玉红衍生物相比,7-氮杂靛玉红衍生物改变了其母核结构,即用氮原子置换了原先靛玉红分子吲哚苯环 7号位上的碳原子。有研究表明[5]:7-氮杂靛玉红类衍生物的脂溶性和水溶性都有所提高,预示其抗肿瘤活性有望增强。本文通过MTT实验,对新合成的 18种 7-氮杂靛玉红衍生物进行了体外抗肿瘤活性研究。MTT实验,即四甲基偶氮唑盐微量酶反应比色实验,是一种检测细胞存活和生长的有效方法,该方法已广泛用于一些生物活性因子的检测,大规模的抗肿瘤药物的筛选,细胞毒性试验以及肿瘤放射敏感性测定等。它的特点是灵敏度高,重复性好[12]。
表 2 18种 7-氮杂靛玉红衍生物对人肝癌细胞株 Bel-7402增殖的抑制作用(±s,n=4,72 h)Table 2 Effect of 18 compounds on Bel-7402 cell viability(±s,n=4,72 h)
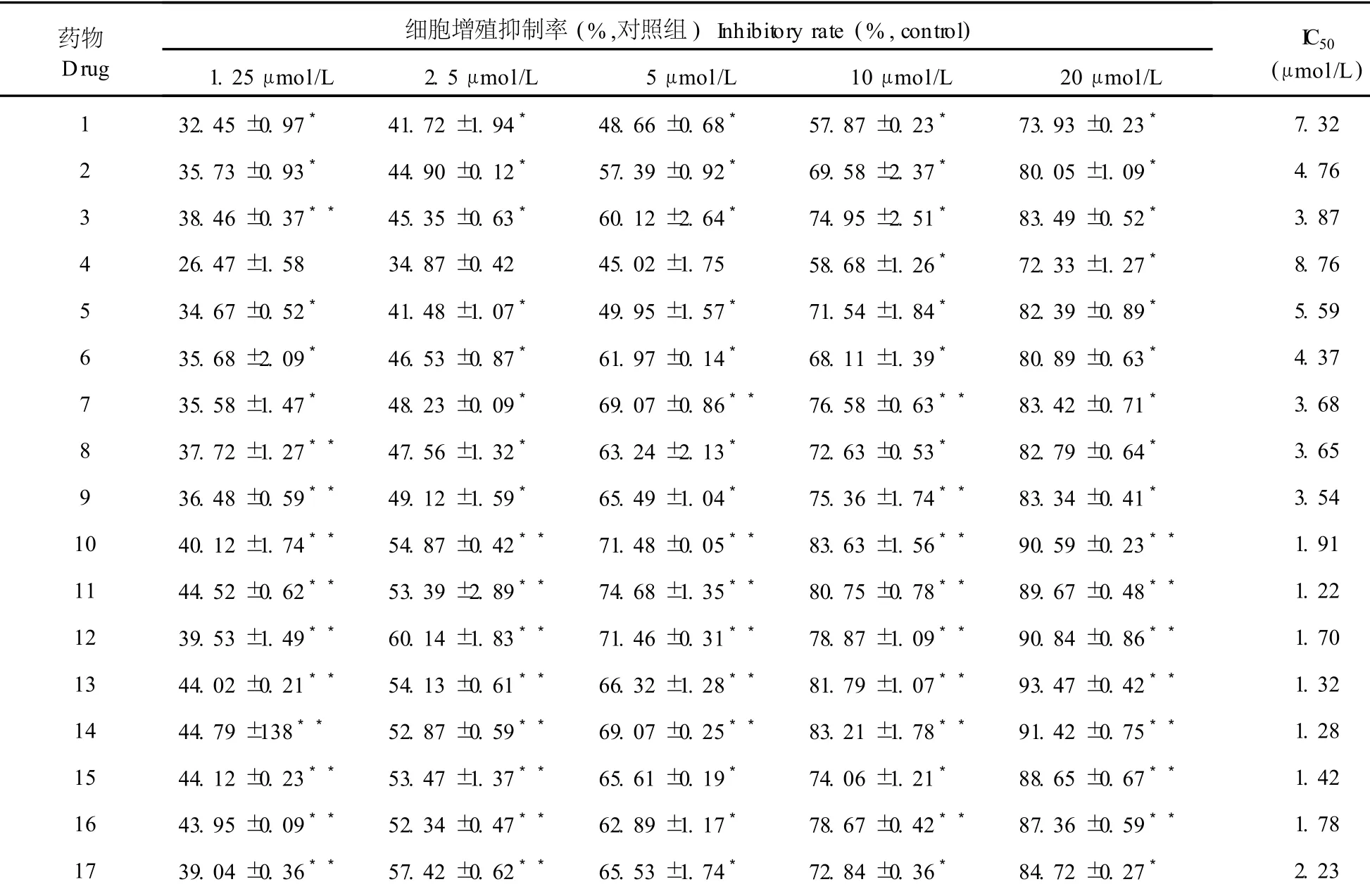
表 2 18种 7-氮杂靛玉红衍生物对人肝癌细胞株 Bel-7402增殖的抑制作用(±s,n=4,72 h)Table 2 Effect of 18 compounds on Bel-7402 cell viability(±s,n=4,72 h)
药物Drug细胞增殖抑制率(%,对照组)Inhibitory rate(%,control) 1.25μmol/L 2.5μmol/L 5μmol/L 10μmol/L 20μmol/L IC50(μmol/L) 1 32.45±0.97*41.72±1.94*48.66±0.68*57.87±0.23*73.93±0.23*7.32 2 35.73±0.93*44.90±0.12*57.39±0.92*69.58±2.37*80.05±1.09*4.76 3 38.46±0.37**45.35±0.63*60.12±2.64*74.95±2.51*83.49±0.52*3.87 4 26.47±1.58 34.87±0.42 45.02±1.75 58.68±1.26*72.33±1.27*8.76 5 34.67±0.52*41.48±1.07*49.95±1.57*71.54±1.84*82.39±0.89*5.59 6 35.68±2.09*46.53±0.87*61.97±0.14*68.11±1.39*80.89±0.63*4.37 7 35.58±1.47*48.23±0.09*69.07±0.86**76.58±0.63**83.42±0.71*3.68 8 37.72±1.27**47.56±1.32*63.24±2.13*72.63±0.53*82.79±0.64*3.65 9 36.48±0.59**49.12±1.59*65.49±1.04*75.36±1.74**83.34±0.41*3.54 10 40.12±1.74**54.87±0.42**71.48±0.05**83.63±1.56**90.59±0.23**1.91 11 44.52±0.62**53.39±2.89**74.68±1.35**80.75±0.78**89.67±0.48**1.22 12 39.53±1.49**60.14±1.83**71.46±0.31**78.87±1.09**90.84±0.86**1.70 13 44.02±0.21**54.13±0.61**66.32±1.28**81.79±1.07**93.47±0.42**1.32 14 44.79±138**52.87±0.59**69.07±0.25**83.21±1.78**91.42±0.75**1.28 15 44.12±0.23**53.47±1.37**65.61±0.19*74.06±1.21*88.65±0.67**1.42 16 43.95±0.09**52.34±0.47**62.89±1.17*78.67±0.42**87.36±0.59**1.78 17 39.04±0.36**57.42±0.62**65.53±1.74*72.84±0.36*84.72±0.27*2.23

注:与甲异靛组相比:*P<0.05,**P<0.01。Note:*P<0.05,**P<0.01 vsmeisoindigo group.
表 3 18种 7-氮杂靛玉红衍生物对人白血病细胞株 HL-60增殖的抑制作用(±s,n=4,72 h)Table 3 Effect of 18 compounds on HL-60 cell viability(±s,n=4,72 h)

表 3 18种 7-氮杂靛玉红衍生物对人白血病细胞株 HL-60增殖的抑制作用(±s,n=4,72 h)Table 3 Effect of 18 compounds on HL-60 cell viability(±s,n=4,72 h)
注:与甲异靛组相比:*P<0.05,**P<0.01。Note:*P<0.05,**P<0.01 vsmeisoindigo group.
表 4 18种 7-氮杂靛玉红衍生物对人卵巢癌细胞株 SK-OV-3增殖的抑制作用(±s,n=4,72 h)Table 4 Effect of 18 compounds on SK-OV-3 cell viability(±s,n=4,72 h)
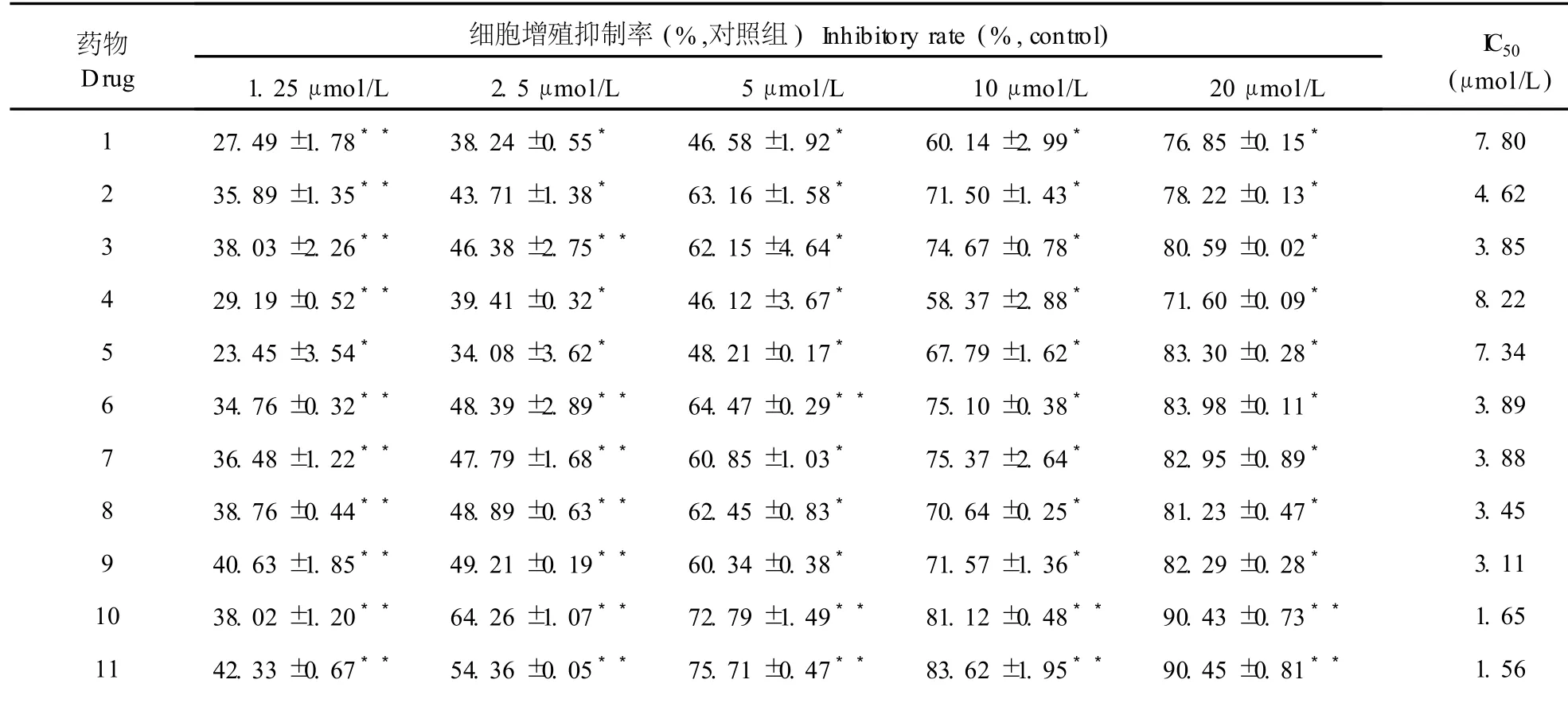
表 4 18种 7-氮杂靛玉红衍生物对人卵巢癌细胞株 SK-OV-3增殖的抑制作用(±s,n=4,72 h)Table 4 Effect of 18 compounds on SK-OV-3 cell viability(±s,n=4,72 h)
药物Drug细胞增殖抑制率(%,对照组)Inhibitory rate(%,control) 1.25μmol/L 2.5μmol/L 5μmol/L 10μmol/L 20μmol/L IC50(μmol/L) 1 27.49±1.78**38.24±0.55*46.58±1.92*60.14±2.99*76.85±0.15*7.80 2 35.89±1.35**43.71±1.38*63.16±1.58*71.50±1.43*78.22±0.13*4.62 3 38.03±2.26**46.38±2.75**62.15±4.64*74.67±0.78*80.59±0.02*3.85 4 29.19±0.52**39.41±0.32*46.12±3.67*58.37±2.88*71.60±0.09*8.22 5 23.45±3.54*34.08±3.62*48.21±0.17*67.79±1.62*83.30±0.28*7.34 6 34.76±0.32**48.39±2.89**64.47±0.29**75.10±0.38*83.98±0.11*3.89 7 36.48±1.22**47.79±1.68**60.85±1.03*75.37±2.64*82.95±0.89*3.88 8 38.76±0.44**48.89±0.63**62.45±0.83*70.64±0.25*81.23±0.47*3.45 9 40.63±1.85**49.21±0.19**60.34±0.38*71.57±1.36*82.29±0.28*3.11 10 38.02±1.20**64.26±1.07**72.79±1.49**81.12±0.48**90.43±0.73**1.65 11 42.33±0.67**54.36±0.05**75.71±0.47**83.62±1.95**90.45±0.81**1.56
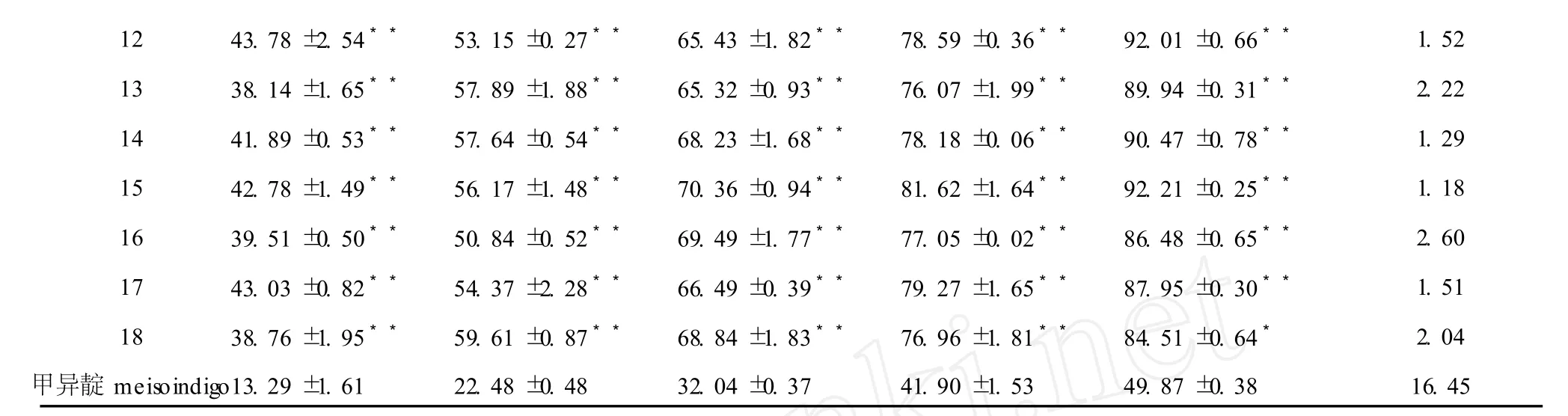
注:与甲异靛组相比:*P<0.05,**P<0.01。Note:*P<0.05,**P<0.01 vsmeisoindigo group.
表 5 18种 7-氮杂靛玉红衍生物对人乳腺癌细胞株MDA-MB-231增殖的抑制作用(±s,n=4,72 h)Table 5 Effect of 18 compounds onMDA-MB-231 cell viability(±s,n=4,72 h)
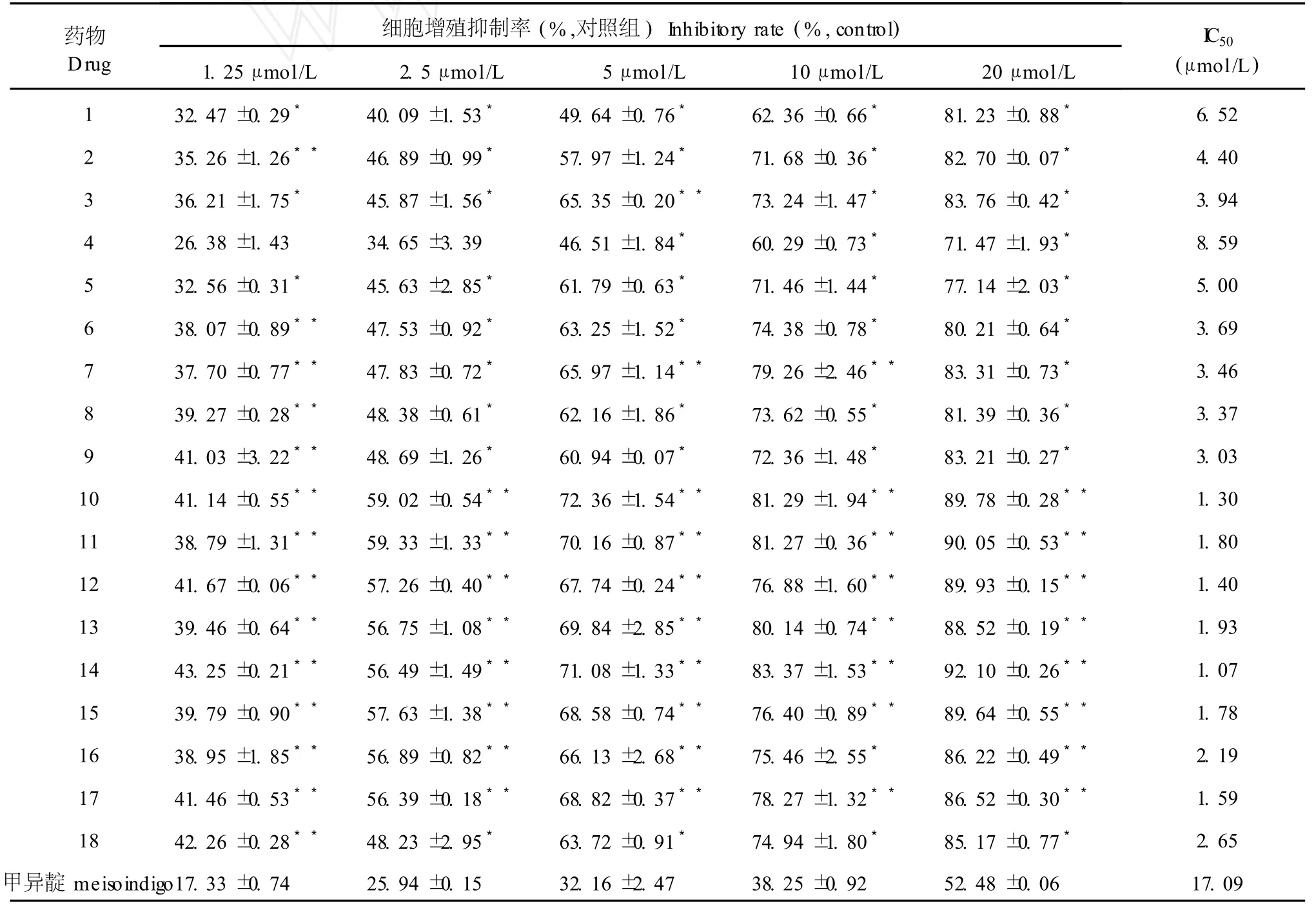
表 5 18种 7-氮杂靛玉红衍生物对人乳腺癌细胞株MDA-MB-231增殖的抑制作用(±s,n=4,72 h)Table 5 Effect of 18 compounds onMDA-MB-231 cell viability(±s,n=4,72 h)
注:与甲异靛组相比:*P<0.05,**P<0.01。Note:*P<0.05,**P<0.01vsmeisoindigo group.
药物Drug细胞增殖抑制率 (%,对照组)Inhibitory rate(%,control) 1.25μmol/L 2.5μmol/L 5μmol/L 10μmol/L 20μmol/L IC50(μmol/L) 1 32.47±0.29*40.09±1.53*49.64±0.76*62.36±0.66*81.23±0.88*6.52 2 35.26±1.26**46.89±0.99*57.97±1.24*71.68±0.36*82.70±0.07*4.40 3 36.21±1.75*45.87±1.56*65.35±0.20**73.24±1.47*83.76±0.42*3.94 4 26.38±1.43 34.65±3.39 46.51±1.84*60.29±0.73*71.47±1.93*8.59 5 32.56±0.31*45.63±2.85*61.79±0.63*71.46±1.44*77.14±2.03*5.00 6 38.07±0.89**47.53±0.92*63.25±1.52*74.38±0.78*80.21±0.64*3.69 7 37.70±0.77**47.83±0.72*65.97±1.14**79.26±2.46**83.31±0.73*3.46 8 39.27±0.28**48.38±0.61*62.16±1.86*73.62±0.55*81.39±0.36*3.37 9 41.03±3.22**48.69±1.26*60.94±0.07*72.36±1.48*83.21±0.27*3.03 10 41.14±0.55**59.02±0.54**72.36±1.54**81.29±1.94**89.78±0.28**1.30 11 38.79±1.31**59.33±1.33**70.16±0.87**81.27±0.36**90.05±0.53**1.80 12 41.67±0.06**57.26±0.40**67.74±0.24**76.88±1.60**89.93±0.15**1.40 13 39.46±0.64**56.75±1.08**69.84±2.85**80.14±0.74**88.52±0.19**1.93 14 43.25±0.21**56.49±1.49**71.08±1.33**83.37±1.53**92.10±0.26**1.07 15 39.79±0.90**57.63±1.38**68.58±0.74**76.40±0.89**89.64±0.55**1.78 16 38.95±1.85**56.89±0.82**66.13±2.68**75.46±2.55*86.22±0.49**2.19 17 41.46±0.53**56.39±0.18**68.82±0.37**78.27±1.32**86.52±0.30**1.59 18 42.26±0.28**48.23±2.95*63.72±0.91*74.94±1.80*85.17±0.77*2.65甲异靛meisoindigo17.33±0.74 25.94±0.15 32.16±2.47 38.25±0.92 52.48±0.06 17.09
表 6 18种 7-氮杂靛玉红衍生物对人肝癌细胞株 HepG-2增殖的抑制作用(±s,n=4,72 h)Table 6 Effect of 18 compounds on HepG-2 cell viability(±s,n=4,72 h)
药物Drug细胞增殖抑制率 (%,对照组)Inhibitory rate(%,control) 1.25μmol/L 2.5μmol/L 5μmol/L 10μmol/L 20μmol/L IC50(μmol/L) 1 28.76±0.02*36.52±3.63*48.45±0.03*61.39±2.38*76.23±0.98*7.64 2 33.28±2.48*45.76±1.82*57.32±1.72*67.91±1.36*82.87±0.12*4.96 3 37.89±1.39**47.18±2.26*60.27±1.17*71.35±0.75*82.43±0.74*3.85 4 25.27±2.66 32.78±1.72 41.49±2.79 56.94±2.74*75.36±0.70*9.11 5 31.57±2.38*42.62±1.29*54.29±1.03*67.45±5.77*81.26±0.20*5.75

注:与甲异靛组相比:*P<0.05,**P<0.01。Note:*P<0.05,**P<0.01 vsmeisoindigo group.
表 7 18种 7-氮杂靛玉红衍生物对小鼠黑色素瘤细胞株 B16增殖的抑制作用(±s,n=4,72 h)Table 7 Effect of 18 compounds on B16 cell viability(±s,n=4,72 h)
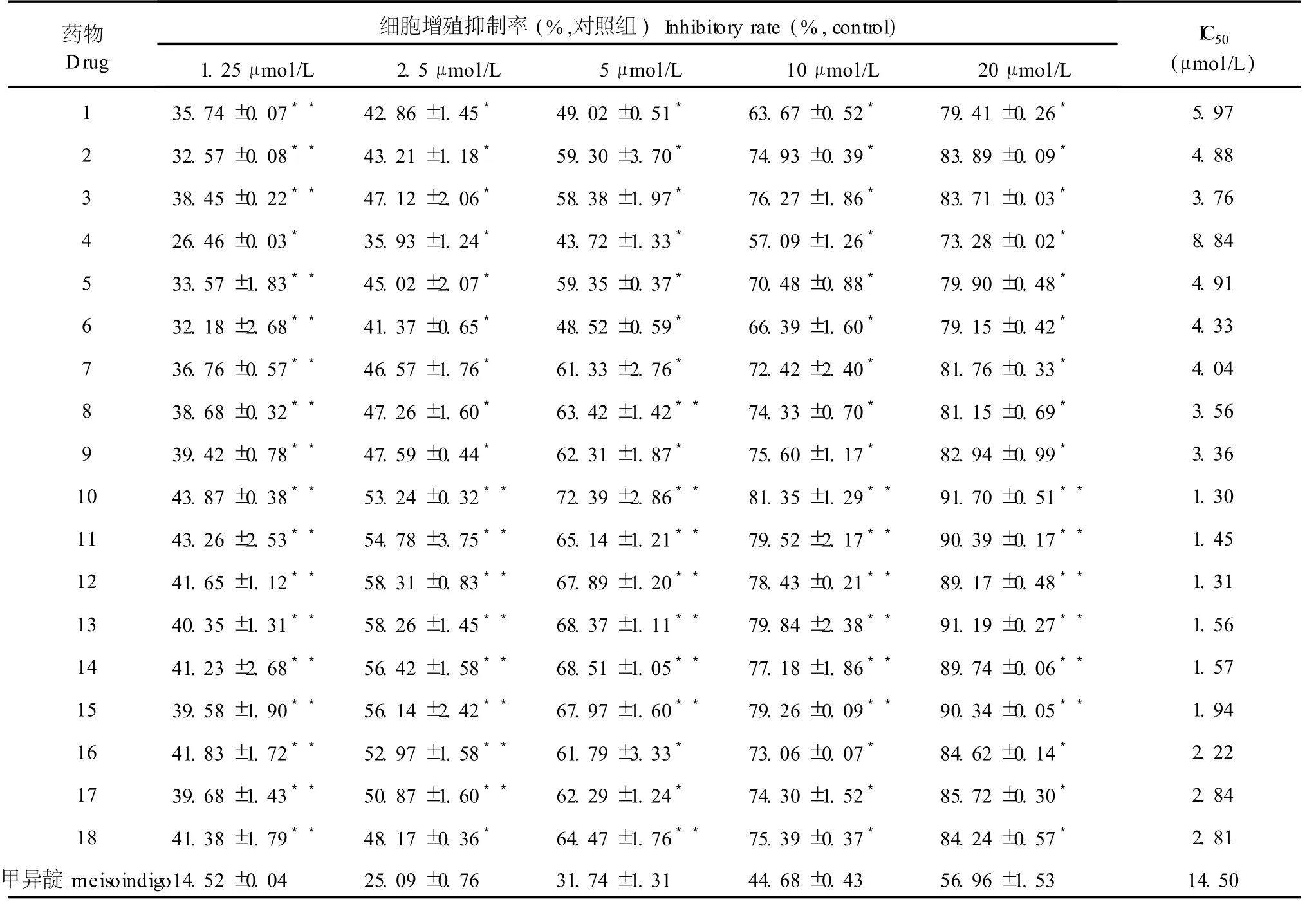
表 7 18种 7-氮杂靛玉红衍生物对小鼠黑色素瘤细胞株 B16增殖的抑制作用(±s,n=4,72 h)Table 7 Effect of 18 compounds on B16 cell viability(±s,n=4,72 h)
注:与甲异靛组相比:*P<0.05,**P<0.01。Note:*P<0.05,**P<0.01 vsmeisoindigo group.
药物Drug细胞增殖抑制率 (%,对照组)Inhibitory rate(%,control) 1.25μmol/L 2.5μmol/L 5μmol/L 10μmol/L 20μmol/L IC50(μmol/L) 1 35.74±0.07**42.86±1.45*49.02±0.51*63.67±0.52*79.41±0.26*5.97 2 32.57±0.08**43.21±1.18*59.30±3.70*74.93±0.39*83.89±0.09*4.88 3 38.45±0.22**47.12±2.06*58.38±1.97*76.27±1.86*83.71±0.03*3.76 4 26.46±0.03*35.93±1.24*43.72±1.33*57.09±1.26*73.28±0.02*8.84 5 33.57±1.83**45.02±2.07*59.35±0.37*70.48±0.88*79.90±0.48*4.91 6 32.18±2.68**41.37±0.65*48.52±0.59*66.39±1.60*79.15±0.42*4.33 7 36.76±0.57**46.57±1.76*61.33±2.76*72.42±2.40*81.76±0.33*4.04 8 38.68±0.32**47.26±1.60*63.42±1.42**74.33±0.70*81.15±0.69*3.56 9 39.42±0.78**47.59±0.44*62.31±1.87*75.60±1.17*82.94±0.99*3.36 10 43.87±0.38**53.24±0.32**72.39±2.86**81.35±1.29**91.70±0.51**1.30 11 43.26±2.53**54.78±3.75**65.14±1.21**79.52±2.17**90.39±0.17**1.45 12 41.65±1.12**58.31±0.83**67.89±1.20**78.43±0.21**89.17±0.48**1.31 13 40.35±1.31**58.26±1.45**68.37±1.11**79.84±2.38**91.19±0.27**1.56 14 41.23±2.68**56.42±1.58**68.51±1.05**77.18±1.86**89.74±0.06**1.57 15 39.58±1.90**56.14±2.42**67.97±1.60**79.26±0.09**90.34±0.05**1.94 16 41.83±1.72**52.97±1.58**61.79±3.33*73.06±0.07*84.62±0.14*2.22 17 39.68±1.43**50.87±1.60**62.29±1.24*74.30±1.52*85.72±0.30*2.84 18 41.38±1.79**48.17±0.36*64.47±1.76**75.39±0.37*84.24±0.57*2.81甲异靛meisoindigo14.52±0.04 25.09±0.76 31.74±1.31 44.68±0.43 56.96±1.53 14.50
N-1-甲基异靛蓝(甲异靛)是一种已用于临床治疗的靛玉红类抗肿瘤药物[13]。本MTT检测结果显示:与阳性对照药甲异靛相比,所有 18个 7-氮杂靛玉红衍生物在体外对 6种细胞瘤株均具有较好的抑制活性,它们的 I C50(μmol/L)在 1.06~9.12之间(表 2~7),其抗肿瘤活性比甲异靛强,且同一种衍生物对 6种不同肿瘤细胞的细胞毒作用无明显差异。对靛玉红衍生物电子结构与抗癌活性的构效关系的研究表明[14]:靛玉红衍生物的药效基团是 3号位碳原子,其上富集着负电荷,有活性的靛玉红衍生物在与肿瘤细胞的作用过程中是通过与受体的正电性原子结合而对肿瘤细胞产生抑制作用的。7-氮杂靛玉红衍生物 7号位氮原子的静电作用,降低了 3号位碳原子的净电荷数量,碳原子的负电性越大,它与受体的正电性原子结合能力就越强,对肿瘤细胞的抑制活性也越高。因此与靛玉红衍生物相比,7-氮杂靛玉红衍生物的抗肿瘤活性得到了显著提高。
本研究发现,化合物 10~15在 20μmol/L的浓度下作用 72 h对本实验所用 6种肿瘤细胞株均有很强的抑制作用,抑制率大都在 88%~93%,抑制作用基本上随着浓度的增高而增强。化合物 16~18在 20μmol/L的浓度下对实验所用 6种肿瘤细胞株均有较强的抑制作用,抑制率大都在 85%左右。化合物 1~9在 1~20μmol/L浓度范围对实验所用 6种肿瘤细胞增殖的抑制作用均较弱,抑制率几乎均在 84%以下(表 2~7)。由以上 18种化合物的化学结构可知:具有明显抗肿瘤活性的化合物10~15均具有相同的结构特征,即具有 R位上的N-OH基团和R3′位上的Br(Cl)基团。与此相反,无此结构特征的化合物 1~9的抗肿瘤活性降低。化合物 16~18在结构上只有 R3′位上的Br(Cl)基团,而无 R位上的N-OH基团,其抗肿瘤活性位于上述两者之间。综上所述,推测 7-氮杂靛玉红衍生物分子构型中,R位上的 N-OH基团和 R3′位上的 Br (Cl)基团可能是其具有显著抗肿瘤活性的重要结构修饰基团,苯环 3′位和 5′位可能是其抗肿瘤作用的主要活性部位,这和近年来国外对于靛玉红衍生物的研究结果是相似的[15]。
肿瘤分子生物学研究显示,靛玉红及其衍生物是通过抑制细胞周期激酶 (CDK)发挥抗肿瘤作用的。国外学者 Ralph Hoessel等[3]证实靛玉红及其衍生物可与ATP结合位点竞争性结合而抑制 CDK等激酶,如 CDK1/cyclin B,CDK2/cyclin A及 CDK2/ cyclin E,其中主要抑制 CDK2,致使L1210细胞株细胞周期 G1/S期和 G2/M期停滞,以及 Jurkat敏感细胞株 G1/S期停滞。此外,Marko等[4]用乳腺癌细胞株实验证实,靛玉红及其衍生物可选择性结合 CDK的ATP结合位点,从而抑制 CDK1/cyclinB结合,诱导乳腺癌细胞的细胞周期 G1/S期和 G2/M期停滞。CDK激酶参予多种人类肿瘤的生长过程,由此推测7-氮杂靛玉红类衍生物可能有类似的抗肿瘤机理。本课题组将通过体内抗肿瘤试验来进一步探讨 7-氮杂靛玉红类衍生物的作用机制。
1 Chen TQ(陈体强),Wu JZ(吴锦忠),LinWX(林文雄),et al.Inorganic element compositions of indigo naturalis analysed by SEM/EDS,ICP-AES and IR.Nat Prod Res Dev(天然产物研究与开发),2007,19:837-840.
2 Eisenbrand G,Hippe F,Jakobs S,et al.Molecular mechanisms of indirubin and its derivatives:novel anticancermoleculeswith their origin in traditional Chinese phytomedicine.Cancer Res Clin Oncol,2004,130:627-635.
3 Hoessel R,Leclerct S,et al.Indirubin,the active constituent of a Chinese antileukaemia medicine,inhibits cyclin-dependent kinases.Nature Cell B iology,1999,5(1):60-67.
4 Marko D,Schatzle S,FriedelA,et al.Inhibition of cyclin-dependent kinase 1(CDK1)by indirubin derivatives in human tumour cells.B r J Cancer,2001,84:283-289.
5 Yao QZ(姚其正),Wang ZH(王朝晖),Cheng JC(程景才),et al.The preparation and phar maceutical function of 7-nitrogen substituted indirubin and isoindigo derivatives. CN200710023347.8,2007-06-08.
6 Cao W(曹蔚),Li XQ(李小强),et al.Physicochemical properties and anti-tumor activityin vitroof polysaccharide APS-3c fromAngelica sinensis(O liv.)Diels.Nat Prod Res Dev(天然产物研究与开发),2008,20:217-222.
7 GuoWJ(郭文杰),TaoWY(陶文沂),Xu ZH(许正宏),et al.Directed screening of myxobaceria producing high bioactive antitumormetabolites.Nat Prod ResDev(天然产物研究与开发),2007,19:1032-1036.
8 Shi J,Shen HM.Critical role of Bid and Bax in indirubin-3-monoxime-induced apoptosis in human cancer cells.B iochem ical Phar m acology,2008,75:1729-1742.
9 Yang ZY(杨振宇),Guo W(郭薇),Wu DY(吴东媛),et al.Study on extraction,isolation and anti-tumor activity of daphnoretin fromW ikstroem ia indica.Nat Prod Res Dev(天然产物研究与开发),2008,20:522-526.
10 Perabo FG,Frossler C,Landwehrs G,et al.Indirubin-3′-monoxime,a CDK inhibitor induces growth inhibition and apoptosisindependent up-regulation of surviving in transitional cell cancer.Anticancer Res,2006,26:2129-2135.
11 Ferandin Y,et al.3′-substituted,7-halogenoindirubins,a new class of cell death inducing agents.M ed Chem,2006,49: 4638-4649.
12 Zhao JL(赵江林),Xu LJ(徐利剑),Huang YF(黄永富),et al.Detection of antimicrobial components from extracts of the endophytic fungi associatedwithParis polyphyllavar.yunnanensisusing TLC-bioautography-MTT assay.Nat Prod Res Dev(天然产物研究与开发),2008,20:28-32.
13 Xiao Z,Hao Y,Liu B,et al.Indirubin and meisoindigo in the treatment of chronic myelogenous leukemia in China.Leuk Lym phom a,2002,43:1763-1768.
14 Xu X(许旋),Luo YF(罗一帆),et al.Relationship between electronic structure and antitumor activity of indirubin derivatives.Chin J Cancer,2001,20:1383-1386.
15 MoonMJ,Lee SK,Lee JW,et al.Synthesis and structure-activity relationships of novel indirubin derivatives as potent antiproliferative agents with CDK2 inhibitory activities.B ioorg M ed Chem,2006,14:237-246.
Effects of Eighteen 7-Nitrogen Substituted Indirubin Derivatives on the Proliferation of Six Cancer CellL ines
L IU Ya-bo1,TAO Wen-yi2*
1School ofM edicine and Phar maceutics,Jiangnan University,W uxi 214122,China;2The Key Laboratory of Industrial B iotechnology,M inistry of Education,Jiangnan University,W uxi 214122,China
Indirubin is an active anticancer component isolated from Qingdai.In this study,effects of eighteen 7-nitrogen substituted derivatives of indirubin on the proliferation of six cancer cell lines were evaluated byMTT assay,and their structure-function relationship was analyzed.After treatment of the cancer cells with compounds 1-18 at concentration range from 1.25 to 20μmol/L for 72 h,growth inhibitory effectswere determined.Results showed that compounds 10-15 with two substitutions,i.e.a N-OH group at the R-position and a bromide or chloride atom replaced H at the R3′-position,could significantly inhibit the proliferation of six human cancer cell lines.However,compounds 1-9 without these substitutions showed relatively lower inhibitory effects.This study suggested that the N-OH group at the R-position and the bromide or chloride atom at the R3′-position might be important for the anti-tumor activities of 7-nitrogen substituted indirubin derivatives.
Qingdai;7-nitrogen substituted indirubin derivatives;indirubin;anti-tumor activity;MTT assay;IC50value
Q946.91;R285
A
1001-6880(2010)05-0899-08
2009-01-15 接受日期:2009-03-30
*通讯作者 Tel:86-013771028802;E-mail:angel20070611@163.com

