镧系稀土四元配合物Ln(NO3)2(phen)2(CH3COCHCOCH3)的合成及晶体结构表征
林 苗 杨 勇 咸春颖
(1化学化工与生物工程学院,生态纺织教育部重点实验室,东华大学,上海 201620)
(2工业品与原材料检测技术中心,上海出入境检验检疫局,上海 200135)
镧系稀土四元配合物Ln(NO3)2(phen)2(CH3COCHCOCH3)的合成及晶体结构表征
林 苗1杨 勇*,2咸春颖1
(1化学化工与生物工程学院,生态纺织教育部重点实验室,东华大学,上海 201620)
(2工业品与原材料检测技术中心,上海出入境检验检疫局,上海 200135)
以乙酰丙酮(Hacac)、邻菲咯啉(phen)、硝酸根为配体,8-羟基喹啉为酸度调节剂合成出一个系列的镧系轻稀土四元配合物Ln(NO3)2(phen)2(CH3COCHCOCH3)(Ln=La,Ce,Pr,Nd,Sm)。配合物的结构与性质由元素分析,IR,1H NMR和TGA等表征。单晶Ce(NO3)2(phen)2(CH3COCHCOCH3)·H2O结构经由X射线衍射仪分析表明,晶体属单斜晶系,空间群P21/n,晶胞参数为a= 1.11017(8)nm,b=0.98401(7)nm,c=1.34453(10)nm,β=102.0530(10)°,V=1.43641(18)nm3,Dc=1.715 g·cm-3,Z=2,F(000)=742。配合物呈单核结构,中心离子Ce(Ⅱ)配位数为10。
镧系稀土配合物;合成;表征;晶体结构
近年来,稀土与β-二酮类的配合物在新型发光材料,免疫试剂等方面已有广泛的研究及应用[1-6]。但一直以来,对于相应的四元混配配合物的研究较少。本文力求打破传统的繁琐的合成方法,采用比较简单的合成条件合成目标产物,其方法具有反应条件温和、操作简便易行、易培养单晶等优点。在常温下,以8-羟基喹啉为pH调节剂,用稀土硝酸盐与阴离子配体乙酰丙酮、硝酸根及中性配体邻菲咯啉合成了一个系列的5种镧系轻稀土四元混配配合物Ln(NO3)2(phen)2(CH3COCHCOCH3)(Ln=La,Ce,Pr,Nd, Sm),并通过元素分析,IR、1H NMR和TGA对其结构进行了表征,单晶Ce(NO3)2(phen)2(CH3COCHCOCH3) ·H2O结构经由X射线衍射仪所得数据进行了解析。
1 实验部分
1.1 试剂与仪器
乙酰丙酮,化学纯,中国医药(集团)上海化学试剂公司;邻菲咯啉,分析纯,中国医药(集团)上海化学试剂公司;8-羟基喹啉,分析纯,上海化学试剂中心化工厂;稀土氧化物,纯度不低于99.9%,上海跃龙有色金属有限公司;乙醇,分析纯,上海振新化工一厂;其余试剂均为分析纯。
Carlo Erba 1106型元素分析仪;Nicolet 760红外光谱仪;AV400型核磁共振波谱仪;TGA 2050 Thermogravimetric Analyzer热重分析仪;Rigaku AFC 7R型X射线四圆衍射仪。
1.2 配合物的合成
称取0.3 mmol的稀土氧化物加入稍过量的6 mol·L-1HNO3溶解,在70~80℃下蒸发至干(铈的配合物直接由铈的硝酸盐合成),溶于4 mL水和10 mL无水乙醇的混合液中,另称取0.6 mmol邻菲咯啉,1.0 mmol 8-羟基喹啉,0.16 mol的乙酰丙酮溶于10 mL无水乙醇中,混合上述两溶液,室温下放置,控制溶液的挥发速率,约2 d可析出目标产物。过滤并用乙醇洗涤3次,置于干燥器内干燥。
1.3 晶体结构测定
选取尺寸为0.453 mm×0.321 mm×0.148 mm的单晶Ce(NO3)2(phen)2(CH3COCHCOCH3)·H2O在X射线四圆衍射仪上,用石墨单色化的Mo Kα射线(λ= 0.071073 nm)在2.07°<θ<27.00°的范围内于293(2) K测试温度下以ω-2θ扫描方式收集8 198个衍射点,其中独立衍射点3113个(Rint=0.0664)。晶体结构由直接法解出,并进行全矩阵最小二乘法修正,全部氢原子由差值Fourier合成得到,非氢原子进行各向异性精修,用于全矩阵最小二乘法精修的可观察衍射点为3113个(I>2σ(I)),212个可变参数,残差因子R=0.0342,wR=0.0798,最后差值Fourier图的最大残余电子密度峰值和最小峰值为1 523和-728 e· nm-3。所有计算均用Bruker SHELXTL晶体软件包进行[7]。配合物的晶体学数据列于表1。
CCDC:738798。
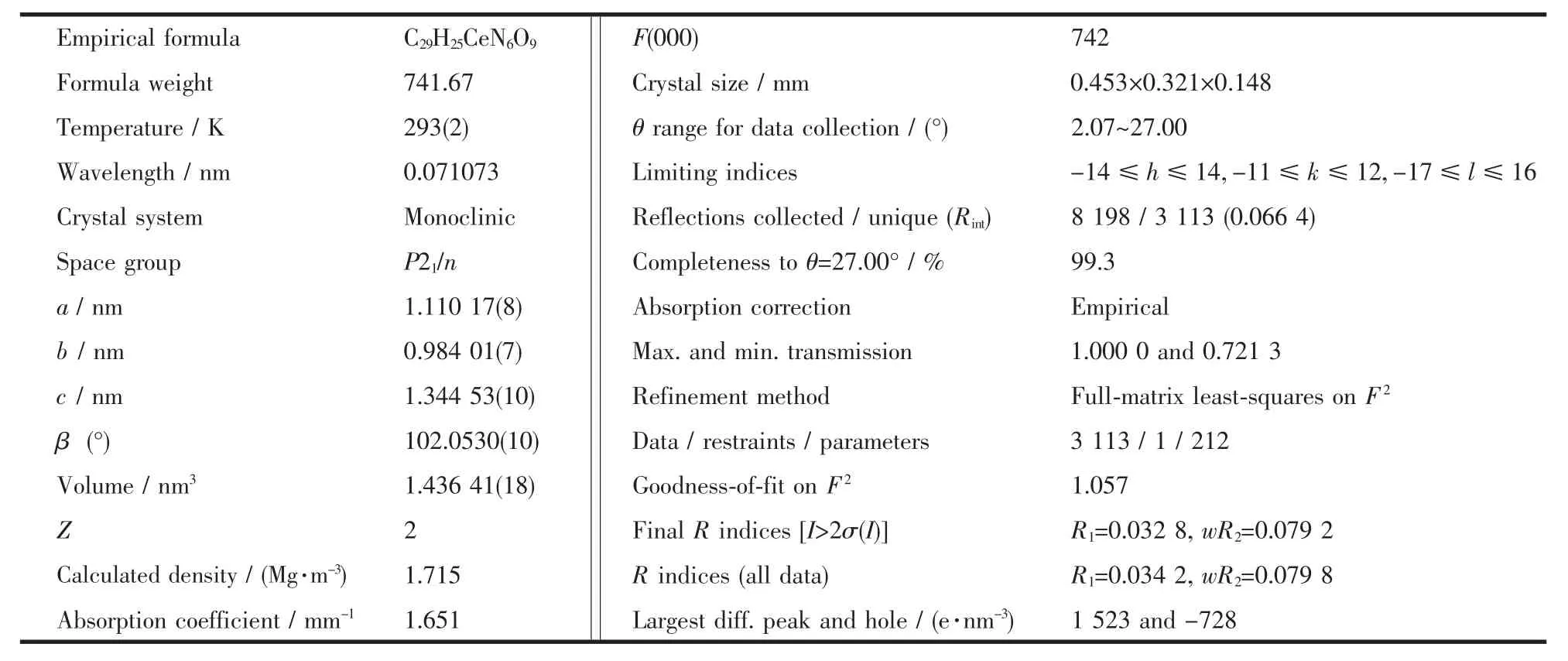
表1 配合物Ce(NO3)2(phen)2(CH3COCHCOCH3)·H2O的晶体学数据Table 1 Crystal data and structure refinement for the complex Ce(NO3)2(phen)2(CH3COCHCOCH3)·H2O
2 结果与讨论
2.1 配合物的组成
用Carlo Erba 1106型元素分析仪对铈配合物的碳、氢、氮3种元素进行元素分析,从分析结果可以确定铈配合物的化学组成为:Ce(NO3)2(phen)2(CH3COCHCOCH3)·H2O,与单晶解析结果一致。元素分析值(理论值)%:C 46.62(46.95);H 3.371(3.373);N 11.32(11.34)。
2.2 配合物的红外光谱分析
对于phen红外光谱的分析,文献上有以下看法:自由phen的环振动峰位于1 588 cm-1处,碳氢面外弯曲振动峰δC-H位于852和739 cm-1处,在配合物中均会发生红移[8];另有看法认为邻菲咯啉位于3 064 cm-1的吸收峰消失,位于1 564和1 588 cm-1处振动峰发生红移是配位的证据之一,而位于740 cm-1处吸收峰红移是phen中2个氮原子配位的证据[9]。还有看法认为phen的环伸缩振动峰在配位后,会分裂为1540和1518 cm-12个吸收峰[10]。通过对本系列配合物红外谱图的分析以及综合考虑各文献提出的观点,我们认为以1588 cm-1的环振动吸收峰及碳氢面外弯曲振动峰852和739 cm-1的位移情况来作为判断phen配位分析依据较为合理。从铈配合物的红外谱图中(图1)可以看出,phen的ν-N=C由自由配体中的1 588 cm-1红移到了1 512 cm-1,δC-H由自由配体中的852和739 cm-1分别红移到了848和729 cm-1,表明phen以双齿螯合方式参与配位。其他配合物中参与配位的phen数据如表2所示。
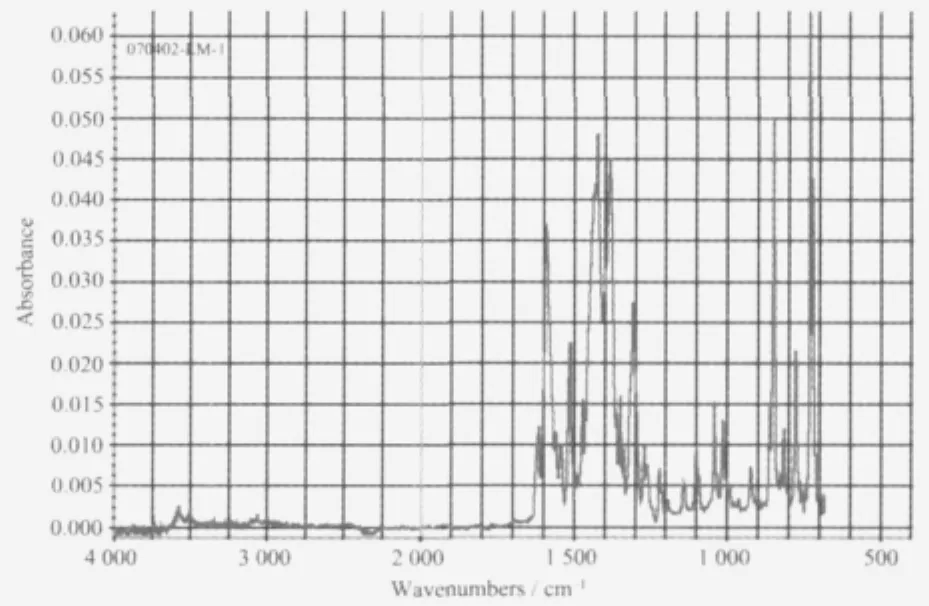
图1 铈配合物红外光谱图Fig.1 Figure of IR spetrum for cerium complex
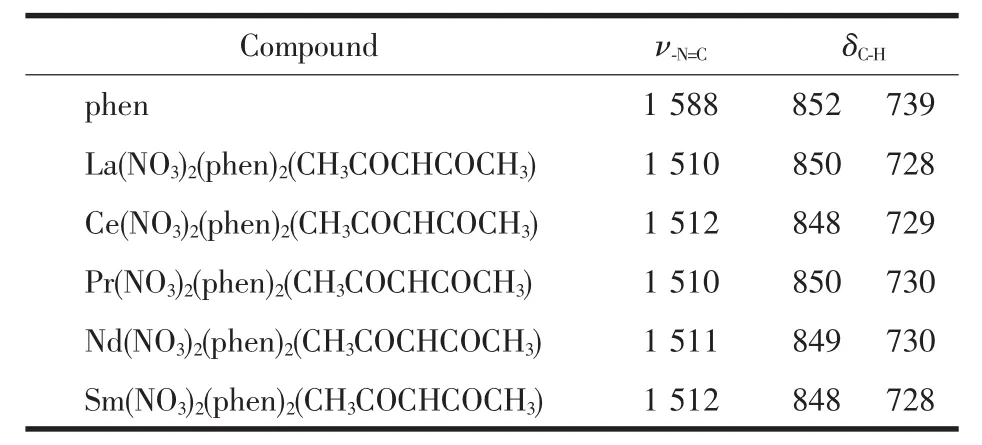
表2 邻菲咯啉特征峰配位前后红外光谱数据Table 2 Selected IR data of the lidand phen cm-1
在自由配体乙酰丙酮(Hacac)中,特征吸收峰分别是酮式异构体中的νC=O~1728 cm-1和烯醇式异构体中的νC=O~1624 cm-1。在配合物中,配体Hacac以acac-与稀土离子配位后形成螯环,使C=O上电子云密度降低,原先在1720 cm-1左右的酮式异构体C=O峰消失,νC=O皆向低波数~1600 cm-1位移(见表4),这是烯醇式配位的证据之一[11]。
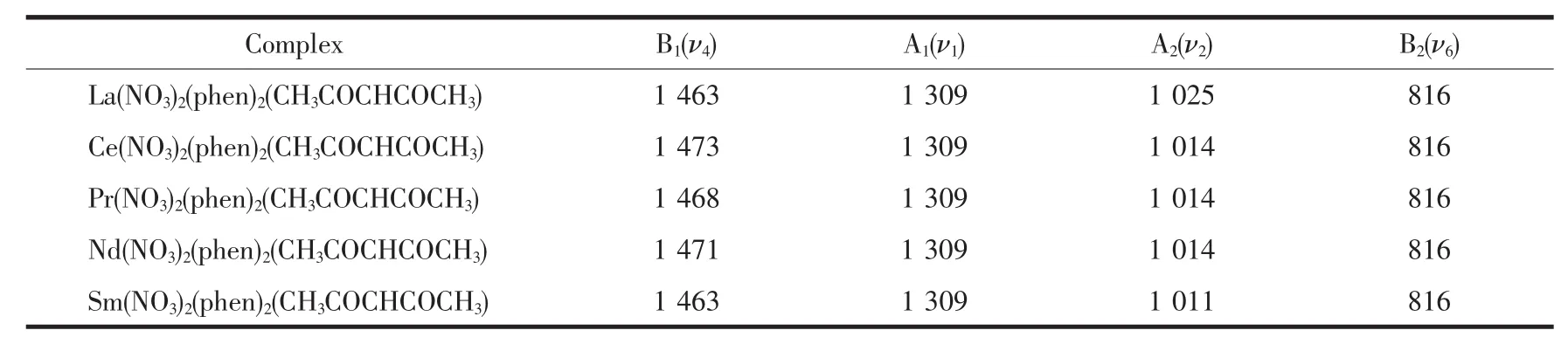
表3 配位NO3-(C2v)主要红外谱峰归属Table 3 Selected IR data of NO3-(C2v) cm-1

表4 乙酰丙酮特征峰配位前后红外光谱数据Table 4 Selected IR data of the lidand acetylacetone cm-1
由以上红外光谱分析的phen中的N、NO3-中的O、Hacac中的O原子的配位方式都与单晶结构解析结果一致。
2.3 配合物的1H NMR分析
室温下,在氘代 DMSO中测定了配合物La(NO3)2(phen)2(CH3COCHCOCH3)的核磁共振谱,见图2,其峰值归属见表5。
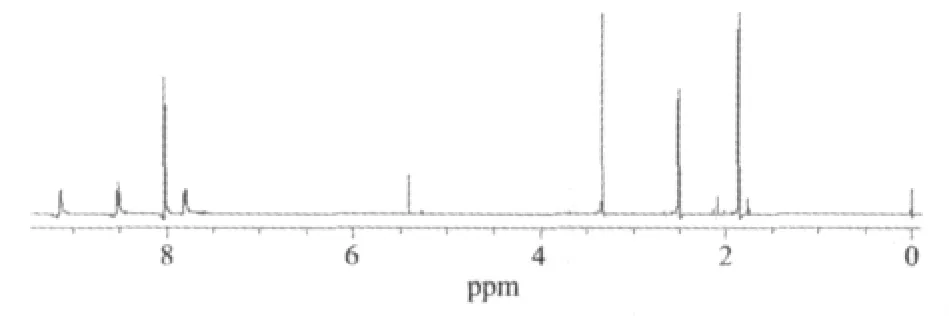
图2 La(NO3)2(phen)2(CH3COCHCOCH3)的核磁共振谱氢谱Fig.2 1H NMR spectra of La(NO3)2(phen)2(CH3COCHCOCH3)
与Na(acac)中的两类氢核相比,La(NO3)2(phen)2(CH3COCHCOCH3)中对应的两类氢核共振峰的δ值移向低场。这是因为在La(NO3)2(phen)2(CH3COCHCOCH3)中,乙酰丙酮(acac-)与中心离子配位后,离域大π键的电子云由于稀土离子的较强吸引而偏向于La3+,γ-H的核外电子云密度随之降低,受到的屏蔽作用减小,所以δ向低场移动达0.62 ppm。这种La3+对离域大π键电子云的吸引通过电子诱导效应进而影响到连接在鳌合环上的2个甲基中的氢原子,使得这6个化学环境相同的氢原子核外电子云的密度降低,因而屏蔽作用减小,δ值增大,但由于受到的影响较γ-H核小,所以δ值增幅较小,为0.25 ppm。而Na(acac)中Na+对(acac)-的影响比La3+对(acac)-的影响要小得多,所以Na(acac)中(acac)-上各氢核周围的电子云密度相对较大,屏蔽作用较大,δ值较小。
与游离配体phen比较,配合物的δ值略有增大,这是由于配位后phen的菲环上的氮原子给出电子,使得菲环上的电子云密度降低,各碳上氢核向低场移动。
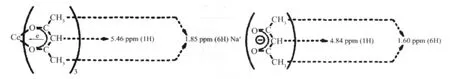

表5 La(NO3)2(phen)2(CH3COCHCOCH3)的核磁共振峰值归属Table 5 Ascription of peak value for La(NO3)2(phen)2(CH3COCHCOCH3)
2.4 配合物的热重分析
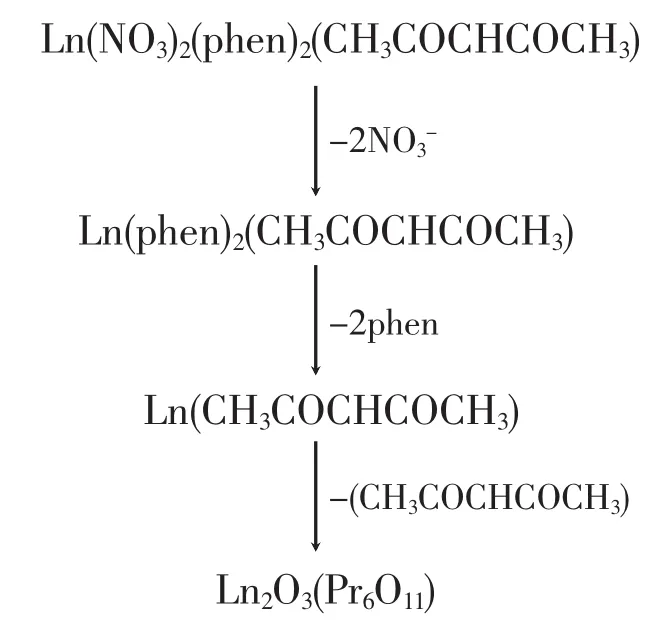
配合物的TGA数据列于表6。从表中可以看出配合物的热分解数据基本相似,表明热分解过程相似,推断该系列稀土四元配合物的热分解机理为:
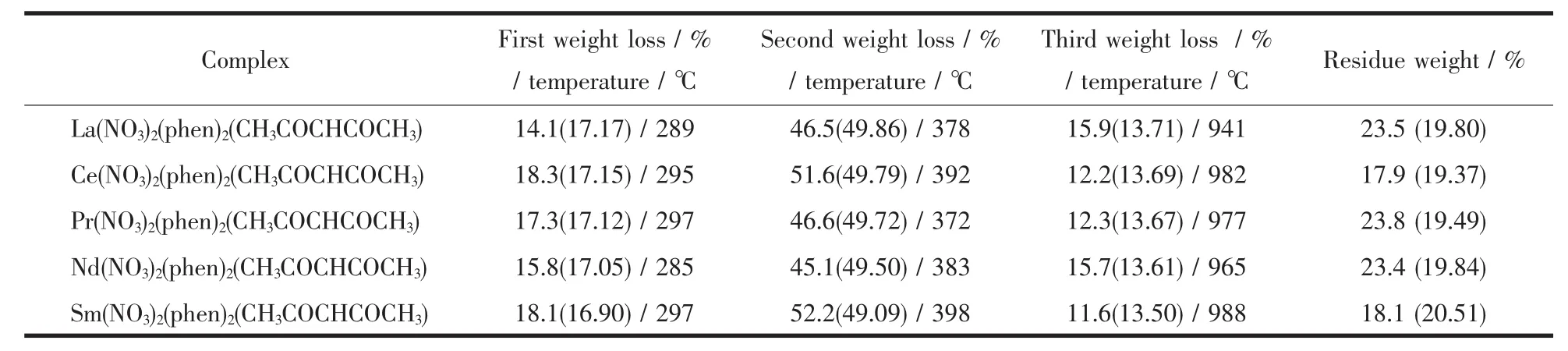
表6 配合物Ln(NO3)2(phen)2(CH3COCHCOCH3)的TGA数据Table 6 TGA data of the complexes Ln(NO3)2(phen)2(CH3COCHCOCH3)
2.5 配合物Ce(NO3)2(phen)2(CH3COCHCOCH3)· H2O晶体结构分析
单晶分子结构见图3。主要键长和键角数据列于表7中。
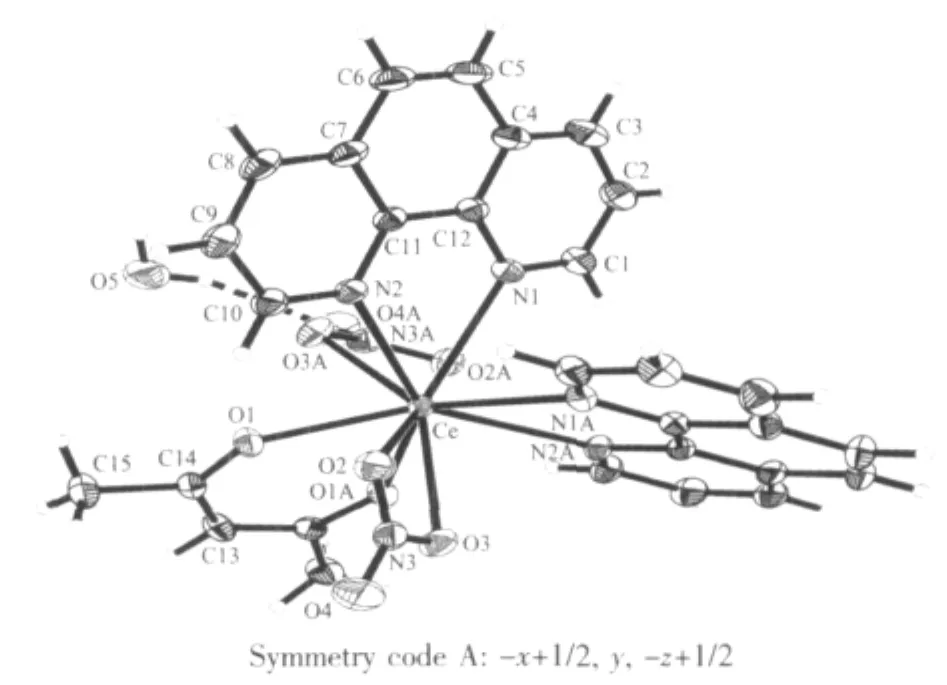
图3 配合物Ce(NO3)2(phen)2(CH3COCHCOCH3)· H2O分子结构图Fig.3 Molecular structure of complex Ce(NO3)2(phen)2(CH3COCHCOCH3)·H2O
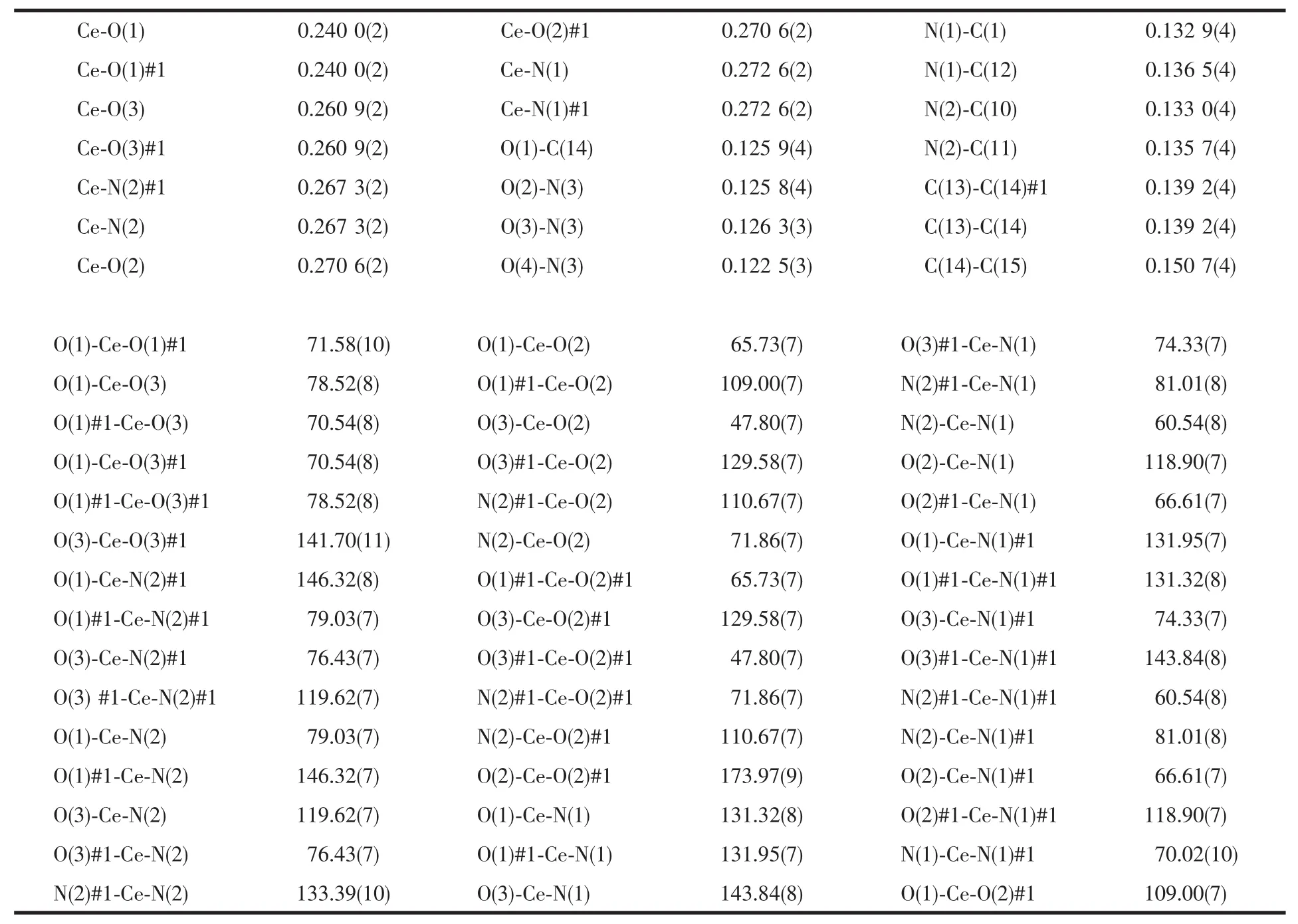
表7 配合物Ce(NO3)2(phen)2(CH3COCHCOCH3)·H2O部分键长与键角Table 7 Selected bond lengths(nm)and angles(°)of complex Ce(NO3)2(phen)2(CH3COCHCOCH3)·H2O
在配合物 Ce(NO3)2(phen)2(CH3COCHCOCH3)· H2O中,单晶呈单核结构,中心离子Ce(Ⅱ)配位数为10。乙酰丙酮以O1,O1#1原子与1个Ce原子螯合配位,Ce-O(1)和 Ce-O(1)#1的键长均为 0.240 0(2) nm;硝酸根以O2,O3原子与Ce原子双齿方式配位,Ce-O(2)[或 O(2)#1]和 Ce-O(3)[或 O(3)#1]的键长分别为 0.270 6(2)和 0.260 9(2)nm,平均值为0.2658(2)nm;邻菲咯啉分子以N1,N2原子与Ce原子配位,Ce-N(1)[或N(1)#1]和Ce-N(2)[或N(2)#1]的键长分别为0.272 6(2)和0.267 3(2)nm,平均值为0.270 0(2)nm。除此之外,晶体中还存在1个结晶水,水分子中的1个氢原子H(5A)与其中1个配位硝酸根离子中未参与配位的氧原子O(4)#2形成氢键,见表8。根据键长数据可以判断,配合物中乙酰丙酮的稳定性最强,硝酸根与邻菲咯啉稳定性比较接近,但是由于邻菲咯啉与中心离子之间形成五元环,较为稳定,而硝酸根与Ce(Ⅱ)间形成了较不稳定的三元环,故其稳定性有所降低。据此,单晶解析结果与TGA的分析结果一致。
通常情况下,按Schomaker-Stevenson半径值计算键长,纯的C-C单键键长为0.1544 nm,C=C键长为0.1334 nm;正常的C-O单键键长为0.141 nm,C= O双键键长为0.121 nm。在配合物中乙酰丙酮的C(14)-O(1)键长为0.125 9(4)nm,与双键键长接近,C(13)-C(14)、C(13)-C(14)#1键长皆为0.139 2(4)nm,C(14)-C(15)键长值为0.1507(4)nm,分别接近于双键和单键键长,说明乙酰丙酮此时以烯醇式,而非酮式异构体参与配位,与红外光谱的分析结果一致。
硝酸根中N(3)-O(2)键长为0.1258(4)nm,N(3)-O(3)键长为0.1263(3)nm,O(4)-N(3)键长为0.1225(3) nm,而N-O单键的键长为0.144 nm,N=O双键键长为0.120 nm[12],因而在配合物中O(4)-N(3)更接近双键,N(3)-O(2)与N(3)-O(3)介于单键和双键之间。
从分子晶胞图可知,邻菲咯啉与邻菲咯啉平面部分交叠,同时分子间的邻菲咯啉环相互平行,说明分子间的邻菲咯啉环之间存在芳环堆积作用。这些堆积作用对配合物的稳定化起到了一定的作用。

表8 配合物Ce(NO3)2(phen)2(CH3COCHCOCH3)·H2O氢键数据Table 8 Data of hydrogen bond for complex Ce(NO3)2(phen)2(CH3COCHCOCH3)·H2O
3 结 论
本文合成了一个系列的镧系稀土四元混配配合物 Ln(NO3)2(phen)2(CH3COCHCOCH3)(Ln=La,Ce,Pr,Nd,Sm;phen=邻菲咯啉)。通过X射线单晶衍射对配合物晶体 Ce(NO3)2(phen)2(CH3COCHCOCH3)· H2O的配位情况进行了研究,实验结果表明:配合物Ce(NO3)2(phen)2(CH3COCHCOCH3)·H2O属单斜晶系,中心离子Ce(Ⅱ)的配位数为10,乙酰丙酮、硝酸根和phen均参与配位,并以螯合、双齿方式参与配位。通过热重图谱分析了该系列配合物的热分解机理,结果表明配体的配位能力为:乙酰丙酮>邻菲咯啉>硝酸根。
[1]ZHU Qin-Yu(朱琴玉),DAI Jie(戴 洁),BIAN Guo-Qing(卞国庆),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao), 1999,15(6):831-834
[2]LI Jian-Yu(李建宇),MA Jie-Feng(马洁峰),YU Qun(于 群), et al.Chemical Reagents(Huaxue Shiji),2006,28(5):264-266
[3]YANG Xiu-Li(杨秀利),ZHANG Shu-Xiang(张书香),REN Hao(任 嗥),et al.Journal of Shandong Education Institute (Shangdong Jiaoyu Xueyuan Xuebao),2004(103):97-98
[4]GE Hong-Mei(葛红梅),XIANG Hai-Bo(项海波),YANG Jing-He(杨景和),et al.Physical Testing and Chemical Analysis Part B:Chemical Analysis(Lihua Jianyan:Huaxue Fence),2001,37(10):436-437,445
[5]YUAN Ji-Bing(袁继兵),LI Jia-Hang(李嘉航),LIANG Wan-Li(梁万里),et al.Journal of the Chinese Rare Earth Society (Zhongguo Xitu Xuebao),2004,22(5):600-604
[6]AN Bao-Li(安保礼),LIU Xiao-Lan(刘晓岚),YE Jian-Qing (叶剑清),et al.Acta Scientiarum Naturalium Universitatis Sunyatseni(Zhongshan Daxue Xuebao),2001,40(4):61-65
[7]SHELXTL 6.1,Bruker Analytical Instrumentation,Madison, Wisconsin,USA,2000.
[8]YANG Yong-Li(杨永丽),DENG Yu-Heng(邓玉恒),WANG Shao-Ting(王少亭),et al.Spectroscopy and Spectral Analysis (Guangpuxue Yu Guangpu Fenxi),2001,21(5):680-681
[9]DA Zu-Lin(笪祖林),ZHU Fu-Hong(朱复红),YANG Dong-Ya(杨冬亚),et al.Applied Chemical Industry(Yingyong Huagong),2008,37(3):257-259,271
[10]XIAN Chun-Ying(咸春颖),ZHU Long-Guan(朱龙观),YU Qing-Sen(俞庆森).Journal of the Chinese Rare Earth Society (Zhongguo Xitu Xuebao),1999,17(4):296-299
[11]WU Hui-Xia(吴惠霞),XIAO Liang-Liang(肖亮亮),CHEN Li(陈 丽),et al.Chinese Journal of Spectroscopy Laboratory (Guangpu Shiyanshi),2004,21(1):163-166
[12]Pauling L,Translated by LU Jia-Xi(卢嘉锡),HUANG Yao-Zeng(黄耀曾),ZENG Guang-Zhi(曾广植).The Nature of the Chemical Bond and the Structure of Molecules and Crystals(化学键的本质,兼论分子和晶体的结构).Shanghai: Shanghai scientific&Technical Publishers,1966.334-335
Synthesis and Crystal Structure Analysis of Lanthanide Complexes Ln(NO3)2(phen)2(CH3COCHCOCH3)
LIN Miao1YANG Yong*,2XIAN Chun-Ying1
(1College of Chemistry,Chemical Engineering and Biotechnology,Key Laboratory of Science&Technology of Eco-Textile(Donghua University),Ministry of Education,Donghua University,Shanghai201620)
(2Inspection Center of Industrial Product&Raw Materials,Shanghai Entry-Exit Inspection&Quarantine Bureau,Shanghai200135)
A series of quaternary lanthanide complexes Ln(NO3)2(phen)2(CH3COCHCOCH3)(Ln=La,Ce,Pr,Nd, Sm)were synthesized with acetyl acetone(Hacac),1,10-phenanthroline(phen)and nitrate radical as ligands and 8-hydroxyquinoline as the acidity conditionor.The structure and property of complexes were characterized by elemental analysis,IR,1H NMR spectroscopy and TGA,and the single crystal structure of Ce(NO3)2(phen)2(CH3COCHCOCH3)·H2O was studied by X-ray diffraction analysis.It is shown that the complex is monoclinic, space group P21/n,a=1.11017(8)nm,b=0.984 01(7)nm,c=1.344 53(10)nm,β=102.053 0(10)°,V=1.436 41(18) nm3,Dc=1.715 g·cm-3,Z=2,F(000)=742.The complex is mononuclear and the coordination number of central ion Ce(Ⅱ)is 10.CCDC:738798.
lanthanide rare earth complexes;synthesis;characterization;crystal structure
O614.33+1
A
1001-4861(2010)01-0120-06
2009-07-07。收修改稿日期:2009-11-07。
*通讯联系人。E-mail:yyangk@online.sh.cn
林 苗,女,46岁,博士,教授;研究方向:稀土配位化学。

