两种方法建立多囊卵巢综合征大鼠模型的实验研究
孙秀红 韦相才 苗竹林 钟兴明 崔 蓉 王小兰 黄密琼
1.暨南大学附属第一医院妇产科(广州,510632);2.广东省计划生育科学技术研究所
多囊卵巢综合征(PCOS)是育龄期妇女常见的生殖内分泌疾病,以持续性排卵障碍、高雄激素血症、卵巢多囊化为特征,常于青春期开始发病,在育龄妇女中发病率约为 6%~10%[1]。临床症候具有高度异质性,不同患者的病理生理特征差异较大,发病机制不清,患者主要以药物治疗为主,临床标本获取较困难,故对其发病机制及治疗机制的人体研究存在诸多局限,寻找理想的接近人类 PCOS病理特征的动物模型对深入研究 PCOS的发生发展及治疗有深远意义。本研究对孕激素联合人绒毛膜促性腺激素(hCG)法以及脱氢表雄酮(DHEA)法 2种方法构建的 PCOS大鼠模型进行实验研究,以期为后续研究提供适宜的动物模型。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SPF级 21日龄 Sprague-Daw ley(SD)雌性大鼠 120只(购于广东省医学实验动物中心 ),体重 45 ~55g。
1.1.2 主要试剂 DHEA粉剂(施瑞科技);左旋18-甲基炔诺酮硅胶棒(上海达华制药);注射用hCG(丽珠制药);大鼠胰岛素检测酶免(ELISA)试剂盒(广州达瑞抗体工程技术有限公司)。
1.2 实验方法
1.2.1 分组和建模 120只 SD大鼠按随机数字表分为 4组:模型组 I、II各 44只,对照组 Ⅰ、Ⅱ各 16只。模型组Ⅰ大鼠于 24日龄 5%利多卡因局麻后,股部内侧皮埋避孕棒,每只 3~4mm。对照组Ⅰ不予处理;于 27日龄时,模型组Ⅰ大鼠开始颈背部皮下注射 hCG 1.5×103U/L和 0.2ml生理盐水,对照组Ⅰ大鼠皮下注射生理盐水 0.2m l;连续用 9d后停药。模型组Ⅱ大鼠于 24日龄时开始,每天颈背部皮下注射 DHEA 3mg/100g和 0.2m l注射用油剂,对照组Ⅱ大鼠皮下注射注射用油剂 0.2ml;连续注射 20d后停药。停药后,连续阴道涂片 7d,观察阴道上皮周期性变化,初步判断建模是否成功。
1.2.2 观察指标 ①从大鼠阴道口开放日龄起,每日 8:00及 20:00观察并记录大鼠阴道口开放情况;②动情周期变化,阴道涂片并湿片观察阴道脱落细胞形态变化;③相关指标检测:模型组Ⅰ大鼠在 42日龄、模型组Ⅱ大鼠在 51日龄、对照组大鼠在阴道涂片示动情间期时,晚 8:00禁食,次日晨 8:00称重。腹腔注入 10%水合氯醛麻醉,腹主动脉取血 5~8ml。静置 0.5h后将全血 3 000rpm/min离心10min得血清。血糖仪测定空腹血糖值(FPG);大鼠胰岛素 ELISA试剂盒测定空腹血清胰岛素水平(FINS);血清雌二醇(E2)、睾酮 (T)、孕酮(P)采用微粒子酶免分析法测定。按照公式计算稳态模型评估(HOMA)指数 =FINS(mμ/L)×FPG(mmol)/22.5[2];④卵巢形态学观察,在采血同时各组另取大鼠解剖双侧卵巢,尽量分离去除卵巢周围脂肪组织,滤纸包裹后迅速置于电子天平称其湿重,计算卵巢指数[3](OC,表示卵巢组织的单位重量);甲醛固定称量后的卵巢,石蜡包埋切片,HE染色。
1.3 统计学方法
2 结果
2.1 阴道口开放日龄
模型组Ⅰ为 31±3d,对照组Ⅰ为 36±2d;模型组Ⅱ为 27±2d,对照组Ⅱ为 35±2d。模型组大鼠阴道口开放日龄均早于对照组(t=2.534,P<0.001)。
2.2 动情周期变化
模型组Ⅰ中 38只大鼠、模型组Ⅱ中 34只大鼠连续阴道涂片观察显示持续处于动情间期,提示无排卵。两对照组显示有规律的动情周期,两模型组失去规律动情周期的大鼠的比例分别为 86.4%和77.3%(P<0.05),模型组Ⅰ建模成功率高于组Ⅱ,有统计学差异。
2.3 大鼠体重和卵巢湿重
模型组 I体重、卵巢湿重、卵巢指数等均高于对照组(P<0.05);而模型组Ⅱ体重较对照组明显减轻,但解剖发现其卵巢重量及卵巢指数均高于对照组(P<0.05),见表 1。
表1 两种建模方法大鼠体重及卵巢情况比较(±s)
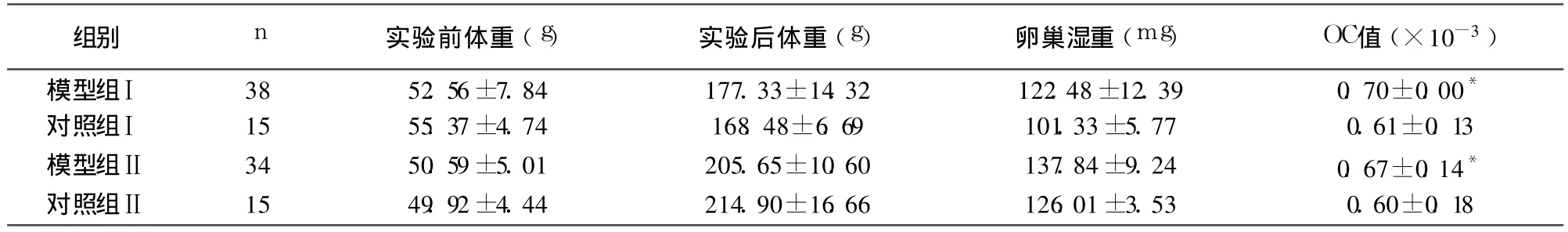
表1 两种建模方法大鼠体重及卵巢情况比较(±s)
*与相应的对照组比较 P<0.05
组别 n 实验前体重(g) 实验后体重(g) 卵巢湿重(mg) OC值(×10-3)模型组Ⅰ 38 52.56±7.84 177.33±14.32 122.48±12.39 0.70±0.00*对照组Ⅰ 15 55.37±4.74 168.48±6.69 101.33±5.77 0.61±0.13模型组Ⅱ 34 50.59±5.01 205.65±10.60 137.84±9.24 0.67±0.14*对照组Ⅱ 15 49.92±4.44 214.90±16.66 126.01±3.53 0.60±0.18
2.4 血清性激素及胰岛素抵抗的比较
模型组 I血清 P、T水平较对照组升高(P<0.05),但 E2水平与对照组相差不大。模型组 II血清 E2、P、T水平均较对照组高(P<0.05)。两种建模方法显示 FPG、FINS及 HOMA指数均高于相应对照组,两模型组行两样本 t检验,血清 E2、P水平有统计学差异(P<0.05),余指标无明显差异,见表 2。
2.5 卵巢形态学观察
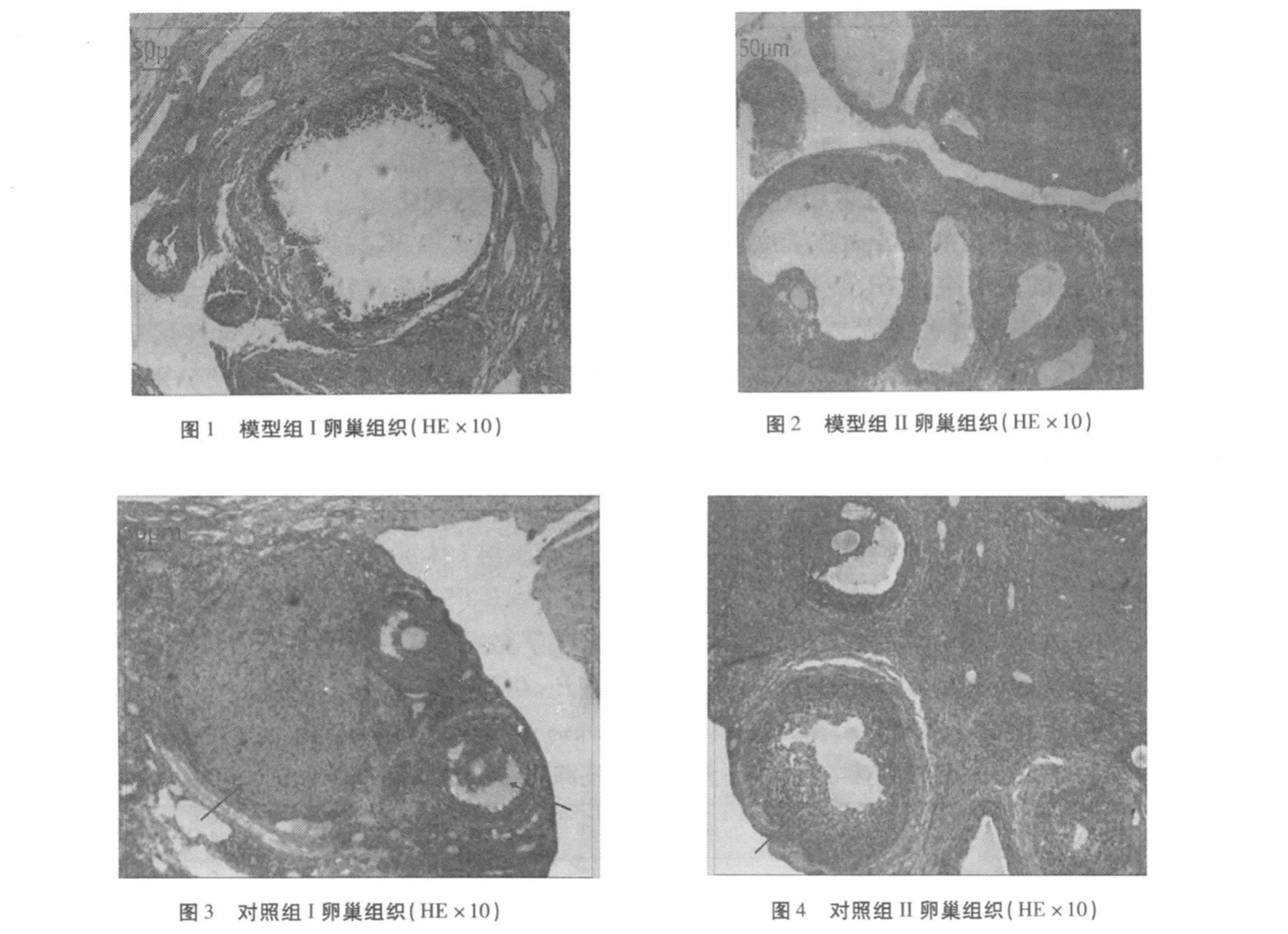
2.5.1 大体形态 对照组卵巢色泽红润,卵巢表面多个黄体;模型组卵巢表面苍白,体积增大,卵巢表面多个扩张的透明囊泡。
2.5.2组织形态 模型组Ⅰ(图 1)光镜下见多个扩张的囊泡,闭锁卵泡常见,囊泡内卵母细胞或放射冠消失,颗粒细胞层数减少(2~3层),排列疏松,极少见黄体形成;模型组Ⅱ(图 2)中见多个扩张的囊泡,颗粒细胞疏松,可见黄体组织;对照组(图 3、4)大鼠卵母细胞清晰,颗粒细胞层数多(6~10层),排列紧密,有黄体形成。
表 2 两种建模方法大鼠血清性激素水平及胰岛素抵抗的比较(±s)

表 2 两种建模方法大鼠血清性激素水平及胰岛素抵抗的比较(±s)
*与相应的对照组比较 P<0.05
项目 模型组Ⅰ(n=38)对照组Ⅰ(n=15) 模型组Ⅱ(n=34)对照组Ⅱ(n=15)E2(pg/m l) 8.79±5.83 7.58±5.83 43.43±9.74* 31.63±9.35 P(ng/m l) 36.98±4.38* 32.14±5.41 29.71±6.34* 37.07±4.82 T(ng/dl) 1.21±0.24* 0.75±0.06 1.16±0.13 0.80±0.14 FPG(mmol/L) 5.76±0.37* 4.74±0.23 5.24±0.34* 4.14±0.46 FINS(μU/m l) 18.12±4.47* 13.48±2.27 21.73±3.30* 15.25±3.92 HOMA-IR 4.00±1.24* 2.67±0.33 4.26±1.01* 2.84±0.77
3 讨论
因大鼠有较稳定的动情周期,利用其开展实验研究经济方便,一直是 PCOS建模的首选。PCOS动物模型的建模方法众多,如雄激素建模法、雌激素建模法、孕激素联合 hCG建模法、胰岛素联合 hCG建模法、芳香化酶抑制剂建模法及近年来雄激素联合hCG建模法[4,5]等。本实验从中选取了目前较为公认的两种方法进行了验证和比较。
目前普遍认为下丘脑 -垂体 -卵巢(HPO)轴功能紊乱导致的促性腺激素(Gn)分泌异常,主要是黄体生成激素(LH)分泌增加,是 PCOS发病的中间环节。LH与高雄激素血症、胰岛素抵抗等典型 PCOS的病理生理变化均密切相关。早在 1989年Bogovich K就提出孕激素联合hCG建模法。其机制是皮下埋植缓释孕激素避孕剂左旋 18-甲基炔诺酮抑制 HPO轴,使性激素分泌呈低水平,导致不排卵。而 hCG发挥类 LH的作用,在卵泡早期使用致卵泡闭锁,故孕激素联合使用 hCG可构建 PCOS动物模型。
大量临床研究发现,PCOS多起病于女性的围初潮期[6]。青春发育前 2年,肾上腺重量及肾上腺皮质厚度增加,肾上腺雄激素合成分泌增多,临床上表现为血清 DHEA和硫酸脱氢表雄酮(DHEAS)水平显著升高,促进了伴有肾上腺源性雄激素升高的PCOS的发生[7]。在此理论基础上,1991年 Lee等首先用 DHEA成功构建了类 PCOS模型,机理为:DHEA是孕烯醇酮经△5途径转化为雄烯二酮的中间产物,该途径受 LH的调节。通过外源性途径提高 DHEA水平造成雄烯二酮水平增高,进而睾酮及雌酮水平升高,造成 PCOS高雄激素血症,升高的雌酮水平对 FSH负反馈使促卵泡素(FSH)相对不足,卵泡发育停滞,从而导致排卵障碍及卵巢多囊改变。
有学者提出 PCOS“青春期发育亢进学说”[8],假性性早熟已被确定为儿童日后发展成 PCOS的危险因素之一[9]。故以刚离乳 SD大鼠作为研究对象的建模方法更符合临床实际而受到研究者的推崇,本实验也选取刚离乳的幼龄 SD大鼠开始建模。研究结果显示,两种方法建立的 PCOS模型与对照组相比,在青春期表现出早熟、高雄激素、胰岛素抵抗及卵泡大量闭锁卵巢多囊性改变等,基本具备了临床 PCOS患者基本的病理生理学特征。
本研究显示,孕激素联合 hCG建模法采用皮下埋植孕激素避孕棒缓慢而稳定地释放孕激素,用生理盐水溶解 hCG皮下注射,方法简便易于操作,建模周期较短。DHEA因其不溶于水配制成油剂,注射后短期内很难完全吸收,吸收率的差异会影响大鼠建模成功率的高低,国内外实验各种指标存在较大差异[10]。本实验在实际操作中出现 DHEA粉剂不易溶解,注射油剂时较困难,注射部位局部皮肤出现硬结影响药物吸收等问题,较难操作,且相比孕激素联合 hCG建模所需时间长。孕激素联合 hCG建模组大鼠表现为明显的肥胖,血清 E2呈低水平,而DHEA建模组未出现明显的肥胖,相反还出现了体重较对照组减轻,E2水平也高于对照组,与临床 P-COS表现不同。这些结果说明,避孕硅胶棒联合 hCG建模组大鼠的形态学和内分泌学改变都与 PCOS患者极为相似,是较为理想的 PCOS动物模型。本研究结果与桂文武等[11]、朱亮等[12]、夏燕等[10]的结果较吻合。结合实际应用,由于所用避孕棒长期而持续地释放孕激素抑制 HPO轴,一方面模型的持续时间长,可用于做药物疗效的长期观察模型;另一方面可能影响促排卵药物治疗疗效的观察研究。而 DHEA建模法可能适合促排卵药物疗效的观察研究,停用DHEA后恢复排卵的周期尚需进一步探讨。
综上,鉴于 PCOS病理生理及临床症候的高度异质性决定了 PCOS动物模型的多样,动物模型适合与否取决于所要研究的 PCOS相关疾病[13]。本研究显示两种方法均获得理想的效果,证明其在疾病动物模型研究中的应用价值。
1 Reckelhoff JF.Polycystic ovary syndrome:Androgens and Hypertension[J].Hypertension,2007,49(6):1220-1221.
2 Bahceci M,Tuzcu A,Canoruc N.,et al.Serum C-reactive protein(CRP)Levels and Insulin Resistance in Non-Obese Women with Polycystic Ovarian Syndrome,and Effect of Bicalutamide on Hirsutism,CRP Levels and Insulin Resistance[J].Hormone research,2004,62(6):283~ 287.
3 胡颜霞,张展.来曲唑诱导多囊卵巢综合征大鼠模型的研究[J].中国妇幼保健.2006,21(7):957~959.
4 曾蕾,赵红艳,罗颂平.改良 PCOS-IR大鼠模型的设计与实验[J].中华中医药杂志,2010,25(12):2341~2345.
5 杨正望,周芳.不同造模方法对大鼠多囊卵巢综合征模型的影响[J].中国实验动物学报,2010,18(1):13~16.
6 Kent SC,Legro RS.Polycystic ovary syndrome in asolesecents[J].Ado-lescMed,2002,13(1):73~88.
7 蒋优君,梁黎.血清脱氢表雄酮水平与女性性早熟关系的探讨[J].浙江大学学报(医学版),2005,34(4):308~312.
8 曹泽毅.中华妇产科学[M].北京:人民卫生出版社,1999:2176~2216.
9 Rosenfield RL.Identifying children at risk for polycystic ovary syndrome[J].JClin Endocrinol Metab,2007,92(3):787~ 796.
10 夏燕,王惠仔.多囊卵巢综合征大鼠模型诱导的实验研究[J].中国优生与遗传杂志,2010,18(7):124~125.
11 桂文武,陈静.类多囊卵巢综合征大鼠模型的比较研究[J].中国比较医学杂志,2006,16(6):330~332.
12 朱亮,全松.两种 SD大鼠多囊卵巢综合征模型的比较研究[J].中国优生与遗传杂志,2009,17(3):81~85.
13 Szukiewicz D,Vilenbroek JT.Polycystic ovary syndrome searching for an animalmodel[J].JMed,1998,29(5-6):259.

