6月龄内诊断1型糖尿病的患者需进行再评估
琼斯
病例介绍
一位17岁的女性患者被送至我院,对其1型糖尿病的诊断进行再评估。该患者曾于15周龄时因乏力、不适3天就诊。体格检查示:呼吸频率增快、心动过速及脱水。实验室检查示:血糖浓度41mmol/L,严重代谢性酸中毒(pH<7.0,正常值7.35~7.45),碱剩余-27mmol/L(正常值-2~2mmol/L),尿酮强阳性(>80mg/dl)。患者既往无疾病史,孕龄41周,出生体重3.17kg。当时诊断为酮症酸中毒,1型糖尿病。患者无糖尿病家族史或神经系统疾病家族史。
患儿接受糖尿病酮症酸中毒的标准静脉疗法后恢复良好,开始使用每天两次的预混胰岛素皮下注射治疗,随后儿童期一直持续胰岛素治疗。胰岛素剂量为每日0.7~1.3U/Kg。患者儿童期HbA1c水平持续于8%~10%,血糖控制不佳,经常发生中度至重度低血糖反应。患者存在轻度发育迟滞,5岁时被发现运动能力发展落后。同年脑电图检查显示癫痫部分性发作,符合肌阵挛性癫痫的诊断。7岁时,认知能力评估提示患儿存在学习障碍、注意力受限、语言能力发展迟缓、空间视觉能力差及协调能力差。患儿就读于普通学校但需要额外辅助。
本次就诊检查结果示,患者血清C肽水平不可测,GAD抗体阴性。新生儿糖尿病诊断性分子遗传学检查结果示KCNJ11基因的59>M突变杂合子,此基因编码ATP-敏感性钾离子内流通道11(KATP通道)的亚单位Kir6.2。
遂开始磺脲类治疗,采用格列本脲,起始剂量每日0.1mg/kg,每日渐增,10天后剂量为每日1mg/kg。胰岛素用量显著减少,仅在患者出现高血糖症状时应用,4周后完全停用胰岛素。停用胰岛素治疗而采用磺脲类治疗6个月后,患者血糖控制得到显著改善,HbA1c水平由之前的8.7%降至6.1%(图1)。
除疗程开始最初两天出现轻微腹泻外,格列本脲治疗无其他副作用。格列本脲治疗后,患者未出现需要他人帮助的低血糖症状,且所需血糖监测频率显著降低。格列本脲治疗前3个月及治疗后20个月的认知能力评估显示其运动能力、执行指令能力及记忆力轻度增高。磺脲类治疗20个月后,患者血糖控制仍保持良好,HbA1c水平持续低于6.1%,且无低血糖发生,而格列本脲剂量已渐减至每日0.6mg/kg(每日分两次服用)。现每四个月对病人进行一次随访,内容包括评估血糖控制情况、检查可能的糖尿病相关并发症及认知能力评估。
诊断讨论
患者的酮症酸中毒、C肽水平不可测及需要完全胰岛素替代治疗提示显著的胰岛素缺乏情况。对于大多数此类患儿,医生会依上述临床症状得出1型糖尿病的诊断结论。在诊断为1型糖尿病17年后的此次检查中发现的GAD自身抗体阴性并不足以否定1型糖尿病的诊断。若在初诊为1型糖尿病时立即进行多种自身抗体检测,阴性结果可能成为证明患者并非1型糖尿病的证据。然而,确实有小部分具1型糖尿病临床特征(约10%~15%)的患者抗体检查结果呈阴性,且在诊断后检测阳性率逐渐随病程发展显著降低。
本例患者需要对1型糖尿病的诊断进行再评估的关键原因是患者在出生6个月内被诊断为1型糖尿病。之前关于HLA类型确定、自身抗体检测及分子遗传学检测结果均显示6月龄前发病的1型糖尿病极少(<1%)。大部分6月龄前被诊断为糖尿病的患者为新生儿糖尿病而非1型糖尿病(图2)。
由已知单基因突变引起的新生儿糖尿病患儿约95%在出生6个月内得以诊断,约3%于生后6~12个月内得以诊断。以上数据说明,对所有在出生6个月内及6~12月龄诊断为1型糖尿病而胰岛自身抗体检测为阴性的患者,均应进行新生儿糖尿病相关的分子遗传学检测。
新生儿糖尿病
多种与β细胞发展相关的基因的突变均可导致新生儿糖尿病的发生。不同的基因突变引起不同的糖尿病表型及胰腺外表现特征(表1)。
其中,最主要的临床亚型为暂时性新生儿糖尿病(TNDM)及永久性新生儿糖尿病(PNDM)。前者的糖尿病症状可自行缓解,而后者自诊断起即需要持续治疗。
大多数(70%)TNDM患者染色体6q24区存在印记基因异常,这些患者通常出生体重明显减轻(中位数为2.0kg),生后1周内出现高血糖症状,但很少发生酮症酸中毒。对于此类患者,一般在糖尿病自行缓解前只需要使用约12周胰岛素治疗。超过半数的TNDM患者发生糖尿病复发,通常发生于20~40岁阶段,且起初能以口服药控制。25%TNDM患者存在编码β细胞的基因(KCNJ11或ABCC8)突变,较染色体6q24区基因突变患者,他们发病较晚(生后4~20周),宫内发育迟滞程度较轻(出生体重中位数为2.6kg)。
PNDM最主要的发病原因亦为编码β细胞的基因KCNJ11(31%)或ABCC8(10%)突变,及胰岛素原(INS)(12%)基因突变。PNDM患者通常于出生后1月内显现糖尿病症状,且出生体重中位数轻度减低(2.6kg)。从临床表型区分PNDM的遗传病因非常困难,除非出现神经系统疾病的表型,后者可基本排除INS突变的可能性。PNDM罕见的隐性病因在同族联姻夫妻的后代中频率显著增加。Wolcott-Rallison综合征由EIF2AK3基因突变引起,临床表现包括肝衰竭、肾衰竭及骨质异常等胰腺外表现。
分子遗传病因学为疾病的临床病程及最佳治疗方案提供了重要信息,因此对每个诊断为糖尿病的不足6月龄的患儿均应积极进行分子遗传学检查,而不仅是等待临床症状的进一步发展显现。检查的首要任务是检测最常见的病因,特别是当结果可能影响治疗方案时。若患儿在出生2周内被诊断为糖尿病,首先应对KCNJ11、ABCC8及INS进行测序,同时应对染色体6q24区进行检测。
KATP离子通道突变
此例患者编码KATP通道Kir6.2亚单位的KCNJ11基因发生突变。具有KCNJ11基因突变的患者常在生后4~20周内发生酮症酸中毒。KCNJ11基因突变的另一特征是运动功能、语言能力及学习能力的发育迟滞。KATP离子通道于大脑、神经、肌肉及胰腺β细胞处表达。约20%的Kir6.2亚单位变异患者及5%由ABCC8基因编码的SUR1亚单位变异患者出现神经系统症状。行走及语言能力发育迟滞、学习困难及注意力持续时间短是发育迟滞的最常见特征性表现。神经系统症状的程度在不同患者间存在差异。DEND综合征(developmental delay, epilepsy and neonatal diabetes/发育延
迟、癫痫和新生儿糖尿病)一词被用来描述神经系统受累最严重的患者,他们童年时期通常无法行走、说话,1岁前出现癫痫全面性发作,脑电图显示高峰节律紊乱。另外一些病人,如本例患者,发育迟滞程度较轻,癫痫发作频率较低,通常表现为较轻的部分性发作,且生后1年内不显现症状。这些症状被称为中度DEND综合征。大多数中度DEND患者存在59V>M基因突变。
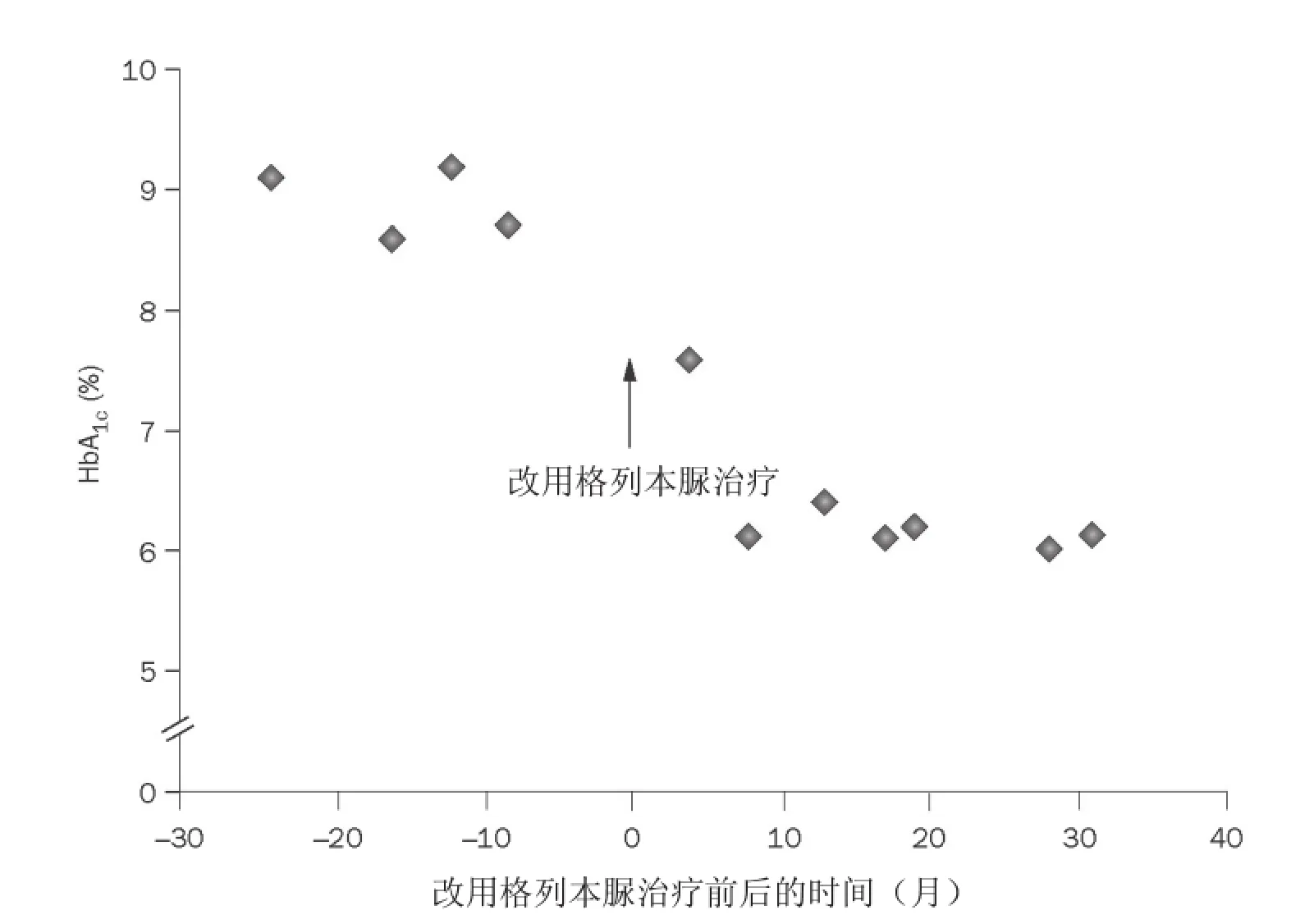
图1 患者由胰岛素治疗(每日0.7U/kg)改为磺脲类治疗(格列本脲每日0.6~1.0mg/kg)前后的HbA1c水平
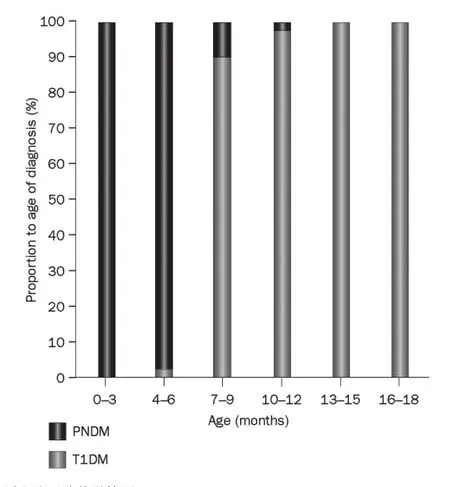
图2 18月龄前非短暂性糖尿病中永久性新生儿糖尿病与1型糖尿病比例

表1 新生儿糖尿病临床特征
治疗
对早期诊断为1型糖尿病的患者进行再评估,考虑其是否为新生儿糖尿病患者的重要原因是KATP离子通道突变将使治疗方案发生极大改变。90%因KCNJ11突变所致糖尿病的患者采用磺脲类药物治疗后可成功停止胰岛素治疗。血糖水平得到良好控制,平均HbA1c水平由磺脲类治疗前的8.1%降至治疗后12周时的6.4%,且低血糖发生率并无增加。由ABCC8基因突变所致糖尿病患者对磺脲类药物治疗的反应相似。对于大多数患者,医生建议使用格列本脲,其效果可能优于其他磺脲类药物。患者的格列本脲所需剂量一般大于2型糖尿病患者,Kir6.2相关新生儿糖尿病的格列本脲所需剂量中位数为每日0.45mg/kg。对于本例患者,血糖控制随药物治疗时间延长而逐渐改善,且药物剂量可逐渐减少。治疗中可能发生暂时性腹泻,但其他副作用极少见。即使至婴儿期之后多年(如本例)方采用磺脲类药物治疗,神经系统功能仍可得到部分改善。但神经功能的最佳恢复需要尽早开始磺脲类药物治疗,最好于出生后6月内即开始。
结论
本病例说明分子遗传学的相关进展对于病人的诊断及治疗可产生重要影响。出生后6个月内初诊为1型糖尿病的患者应该接受分子遗传学检测的再评估,因为出生后6个月内的糖尿病为新生儿糖尿病而非1型糖尿病。不论现年龄大小,所有出生后6个月内出现糖尿病症状的患者均应接受新生儿糖尿病常见单基因突变病因学检查。缺乏β细胞自身免疫标识、于出生后6个月~12个月内诊断为1型糖尿病的患者亦应接受检查。通过磺脲类药物治疗替代胰岛素注射治疗,大多数Kir6.2或SUR1亚单位突变所致新生儿糖尿病患者的血糖控制将得到改善。

