碳热还原法制取铝硅合金的反应机理及其动力学
杨 栋, 冯乃祥, 王耀武, 彭建平, 王紫千, 狄跃忠
(东北大学 材料与冶金学院, 沈阳 110004)
碳热还原法制取铝硅合金的反应机理及其动力学
杨 栋, 冯乃祥, 王耀武, 彭建平, 王紫千, 狄跃忠
(东北大学 材料与冶金学院, 沈阳 110004)
利用XRD、TG/DTA技术分别分析真空碳管炉内不同反应温度下的物相组成和碳热共还原Al2O3、SiO2的反应过程,并在此基础上探讨碳热还原法制取铝硅合金的反应机理。分别采用10、15、20和25 K/min升温速率的差热分析,研究动态氩气气氛中碳热法制取铝硅合金的反应动力学。结果表明:碳热还原反应过程可分为4个阶段,其中,以碳化物的生成与分解阶段为主。碳热还原反应的4种还原机理中,碳化物的生成与分解理论能较好地解释反应过程中出现的反应现象。各个吸热峰的表观活化能分别为848.9、945.4、569.7、325.7、431.9和723.1 kJ/mol,给出了各个吸热峰的动力学方程。同时,利用XRF和红外定硫定碳仪对碳管炉和电炉所得产物组成的定量分析,验证了动力学分析结果的可行性。
碳热还原;差热分析;铝硅合金;反应机理;动力学方程
关于碳热共同还原氧化铝、氧化硅制取铝硅合金的反应机理,国内外学者提出了各种不尽相同的观点:邱竹贤[1]认为还原过程中首先生成单质硅,而后硅在高温下作为还原剂还原氧化铝生成铝硅合金,即硅热还原学说:

前苏联学者拉勃勃尔特等[2]认为当Al2O3和SiO2一起被还原时,还原反应过程是分段、分带进行的:低温带生成SiC、Si、SiO,高温带Si、SiC、SiO与Al2O3反应生成Al2O,最后Al2O、SiO、C、Si和碳化物SiC、Al4C3等相互作用生成铝硅合金,即两段还原学说;这一观点认为,Al2O3、SiO2先被还原为低价氧化物(SiO、Al2O),低价氧化物进一步被还原为单质金属。
狄鸿利[3]认为还原反应过程中存在碳化物相SiC、Al4C3等的生成与分解反应,反应首先生成SiC、Al4C3等碳化物,然后在高温下这些碳化物与低温下未反应的Al2O3反应分解碳化物而生成铝硅合金,即碳化物的生成与分解理论:

STEVENSON[4]和BRUNO[5]认为碳热共还原氧化铝、氧化硅制取铝硅合金遵循铝氧碳化物的生成与分解理论,整个反应过程分3个步骤进行:首先是氧化硅和碳在低温下反应生成SiC,而后氧化铝与碳反应生成Al4O4C,最后生成的SiC和Al4O4C在更高的反应温度下生成铝硅合金。即:

但是,到目前为止,关于碳热共同还原Al2O3、SiO2的反应机理还未能得到最后澄清。
开展冶金与材料动力学的研究,对于阐明反应机理,强化冶金过程,优化过程操作工艺,提高生产效率具有十分重大的意义[6−7]。然而关于碳热共还原Al2O3、SiO2固相反应制取铝硅合金的动力学研究国内外尚未见文献报道。近几年来,TG-DTA技术已广泛应用于材料与冶金的固相反应动力学研究[8−10],其中EBRAHIMI-KAHRIZSANGI等[11]已将TG-DTA技术应用于碳热还原氧化物制取碳化物的动力学研究。鉴于此,本文作者采用DTA技术研究碳热法制取铝硅合金的动力学过程,并结合热力学分析和实验结果,对碳热还原法制取铝硅合金的反应机理进行深入的探讨,以期为生产提供理论指导和借鉴。
1 实验
将工业纯Al2O3、SiO2和优质神府烟煤按质量比为1.3:1:1.55混匀,以文献[12]所获的工艺条件制团,而后分别在真空碳管炉和直流电炉内进行还原冶炼。真空碳管炉功率为50 kW,以氩气为保护气体,样品烧结温度为1 600~2 000 ℃。从室温到1 200 ℃,升温速率为20 ℃/min,从1 200 ℃到2 000 ℃,升温速率为5 ℃/min。直流矿热炉变压器容量为100 kW,输入电压为380 V。采用可控硅整流器,输出电压为0~40 V,电流为0~1 350 A,电极直径为50 mm。采用德国耐驰STA409 CD综合热分析仪,在以高纯氩气为吹扫气体的动态气氛下进行TG-DTA分析,所用Al2O3和SiO2为分析纯,氩气流量为50 mL/min,温度测试范围为室温到2 000 ℃。
为克服试样的温度在产生热效应期间与程序温度间的偏离、试样内部存在温度梯度等缺点, 采用4种不同的升温速率分别测试样品的 DTA 曲线(差热曲线). 运用 Flynn-Wall-Ozawa(FWO) 法和 Kissinger法计算碳热还原过程中各个反应阶段的表观活化能、反应级数、 频率因子等动力学参数, 并给出各个反应阶段的速率方程。
2 结果与讨论
2.1 碳热还原制取铝硅合金的反应机理
2.1.1 真空碳管炉中产物的XRD分析
通过对烧结产物的XRD分析可以了解不同反应阶段体系内所发生的化学反应。图1所示为反应温度为1 600、1 700、1 800、1 900和2 000 ℃,保温时间为1 h时反应产物的XRD谱。由图1可见,反应温度对产物的物相组成影响很大。1 600 ℃时,产物的物相组成主要是Al2O3、SiO2和C,同时SiO2相已开始转化为SiC相,证明体系中有反应(2)发生;当升温至1 700℃时,产物中已有少量Al4C3相出现, 根据化学方程式(3),反应在1 991 ℃才开始发生,远远高于本实验的1 700 ℃。这主要是因为热力学计算假设CO气体的压力为0.1 MPa,而实际在以氩气作为保护气体的真空碳管炉内还原反应产生的CO气体分压远小于0.1 MPa。继续升温至1 800 ℃时,产物的物相组成主要是Al4C3和SiC相,此后进一步升高温度至1 900 ℃,SiC和Al4C3的峰高逐渐减小,并在2 000 ℃时有Al-Si相和Al相出现,这可能是基于如下反应的发生:因此,可以认为,Al2O3和SiO2的碳热共还原过程中可能存在着碳化物的生成与分解反应。此外,XRD谱中自始至终并没有发现有铝氧碳化物的生成。


图1 真空碳管炉中不同温度下产物的XRD谱Fig.1 XRD patterns of products at various temperatures in vacuum graphite furnace: (a) 1 600 ℃; (b) 1 700 ℃; (c) 1 800℃; (d) 1 900 ℃; (e) 2 000 ℃
2.1.2 TG-DTA分析
图2所示为分析纯Al2O3、SiO2与煤粉在以高纯氩气为吹扫气氛,升温速率为10 ℃/min时整个还原反应过程的TG-DTA曲线。由图3可见,反应的质量损失很大,高达92%,这主要是Al2O3、SiO2等氧化物碳热还原过程产生大量的CO及低价氧化物气体所致。按照TG曲线,可将整个反应过程可分为4个阶段:第1阶段(0~850 ℃),这一阶段因有水分的蒸发及烟煤热解产生CO等气体的逸出而产生质量损失,为7.8%,DTA曲线在这一段几乎没有明显的放热峰和吸热峰出现;第2阶段(850~1 250 ℃),TG曲线几乎走平,对应DTA曲线在950和1 140 ℃左右各有一个吸热峰,对应于α–石英向亚稳态α–方石英的晶型转变[13]以及氧化铝的晶型转变[14](对原料SiO2进行XRD分析发现,分析纯SiO2主要为α–石英);第3阶段(1 250~1 780℃),Al2O3、SiO2等与碳粉发生剧烈的反应,产生大量的CO气体而被氩气带出反应体系,整个反应系统的质量损失达76.5%,对应DTA曲线在1 415、1 588、1 703和1 838 ℃分别出现吸热峰,可能分别对应于反应(2)、(3)、(9)和(4);第4阶段(1 850~2 000 ℃),物料的质量损失变小,为7.7%,DTA曲线可能还有吸热峰出现。这种质量损失可能是生成的Al、Si进一步发生反应而导致产物的损失。上述讨论的各个峰所对应的化学反应是结合热力学分析、前述的XRD和 TG-DTA曲线测试结果推测而得的,但是由于高温固相反应本身就是极为复杂的复相反应,因此并不排除其他化学反应参与的可能性。
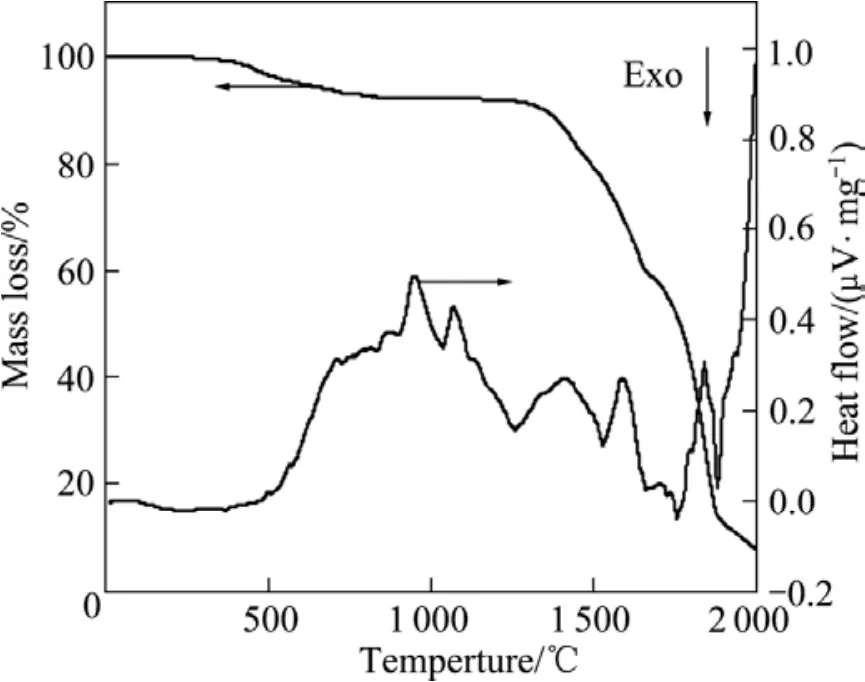
图2 碳热还原Al2O3和SiO2的TG-DTA曲线Fig.2 TG-DTA curves for carbothermal reduction of Al2O3and SiO2
2.1.3 反应机理的讨论
对于硅热还原理论,其关键的反应步骤为反应(1),即:Al2O3+ 3Si = 2Al + 3SiO(g),这一反应的起始温度为2 128 ℃,而根据文献[15],1 900 ℃可以通过硅热还原法制取金属Al,本实验根据真空碳管炉所得试样XRD分析也证实了这一点,如图3所示。但是通过这一理论去解释碳热共还原Al2O3和SiO2似乎并不可行。这主要是因为反应过程中SiC的生成率高达65.9 %而SiO2的残留率为24.7%(以原料SiO2中Si元素为参照), 所以使得所生成的游离态Si含量较少,另外,反应(10)比反应(1)更容易进行,因为反应(10)为放热反应,在低温下就可自发进行。

图3 硅热还原氧化铝所得产物的XRD谱Fig.3 XRD pattern of products obtained by silicon thermal reduction of Al2O3
对于两段还原理论,高温下,反应Al2O3+2C= Al2O(g)+2CO的起始温度比反应(4)的起始温度几乎高100 ℃,因此导致Al4C3的生成率必将远远高于Al2O的生成率。同时,由于高的SiC生成率使得SiO的生成率较低,因此用两段还原理论解释碳热共还原过程是比较困难的。
从真空碳管炉不同反应温度带的XRD分析结果来看,整个反应过程一直没有Al4O4C相出现,这和MURRAY[16]的实验结果相吻合。另外,根据前面的热力学分析,在有C存在的情况下,即使有Al4O4C生成,也会进一步反应生成Al4C3。因此,利用铝碳氧化物的生成与分解理论不能解释整个反应过程。
从前面真空碳管炉所获产物的XRD分析,以及反应过程的TG-DTA分析均表明以碳化物的生成与分解理论能较好地解释反应过程。此外,根据文献[17],Fe2O3在碳热共还原Al2O3和SiO2的反应过程中有重要的作用,这主要是因为Fe可以提高Al2O3的还原率并有助于Al4C3、SiC等碳化物的分解,从而使整个还原过程更容易进行。同时,这也表明利用碳化物的生成与分解理论去解释碳热共还原Al2O3和SiO2的反应过程是可行的。
2.2 碳热还原制取铝硅合金的反应动力学研究
2.2.1 数据处理
化学反应动力学研究化学反应速率随时间、浓度、压力、温度、催化剂等因素的变化关系,最终建立化学反应速率方程。用热分析法研究化学反应的动力学一般用非等温法,即在线性升温条件下测出差热曲线,再利用差热曲线求出有关的动力学参数。采用多个升温速率所得的多条差热曲线可使计算更为简单和准确。在利用热分析的数据进行动力学研究的过程中常常用到以下几个基本关系式。
1) 质量作用定律

式中:K为反应速率常数;α为反应的转化率;t为时间;n为反应级数。
2) Arrhenius公式

式中:E为表观活化能J/mol;A 为频率因子,min−1;R为气体常数,R=8.314 J/(mol·K); T为温度,K。
将式(12)代入式(11)得

在恒定的程序升温速率β下,β=dT,将dt=d T dt β代入式(13),得

依据上述4个公式,用Flynn-Wall-Ozawa法和Kissinger法分别计算动力学参数。
2.2.1.1 Flynn-Wall-Ozawa(FWO) 法
将式(14)移相,两边积分,进一步处理得

2.2.1.2 Kissinger 法
将式(13)作微分处理即为Kissinger法。

KISSINGER[20]假定差热曲线上峰值温度Tm处的反应速率最大,并遵守动力学方程式,则对于式(16)在Tm处有

将式(16)代入式(17),得

KISSINGER认为,An(1−αm)n−1与β无关,其值近似等于1。因此,从式(18)可知,

两边取对数得


2.2.2 动力学结果与讨论
图4所示为升温速率分别为10、15、20和25 K/min,碳热共还原Al2O3和SiO2时的DTA曲线。由图4可见,在4次测量过程中,曲线都出现了6个吸热峰。如前所述,这6个吸热峰分别对应于α–石英向亚稳态α–方石英的晶型转变,Al2O3的晶型转变,SiC、Al4C3的生成以及这两者与Al2O3和SiO2反应生成铝硅合金的反应。同时,鉴于高温固相反应的复杂性,不排除其他反应发生的可能性。表1给出了每个升温速率下各个吸热峰所对应的DTA曲线峰温数值Tm。

图4 不同升温速率下碳热还原反应的DTA曲线Fig.4 DTA curves of carbothermal reduction reaction at different heating rates: (a) 10 K/min; (b) 15 K/min; (c) 20 K/min; (d) 25 K/min

表1 不同升温速率下碳热还原反应的DTA峰温数值Table 1 DTA peak temperatures of carbothermal reduction reaction at different heating rates
图5所示为利用FWO法分别对上述6个吸热峰以lg β对1/Tm作图,通过各直线斜率−0.4567E/R计算反应的活化能E。图5中的点由表1中数据计算而得,分别对其拟合得到图中直线。表2列出了由各直线斜率求得的表观活化能E值及其相关系数r。
同理,为了验证FWO法的可行性,实验又利用Kissinger法对实验数据进行动力学处理。取表1中数据,以ln(β/T)对1/Tm作图,可得一条直线。通过直线斜率–E/R可求得反应的活化能E,通过截距可求出频率因子A,相关结果见表3。比较表2和表3中的各个吸热峰表观活化能E值可以发现,两种方法所得的表观活化能E值基本一致,并且回归直线方程的回归系数r相关性良好。因此,将分别利用FWO法和Kissinger 法计算的每个峰的表观活化能取平均值,可得每个峰的平均表观活化能如表4所示。
根据Kissinger法,采用DTA峰前后缘拐点处切线与平行于横坐标的任意直线构成的三角形中,底边被高所截成两段之间的比例作为该峰的峰形因子I[21],并根据式(11)得出反应级数n,相关结果列于表5。
用非等温过程求取动力学参数后,进一步判断反应机制。SATAVA和SETAK[22]认为:假设在无限小的时间间隔内,非等温过程可以看成是等温过程。根据质量作用定律Arrhenius公式和动力学参数,6个峰的速率方程分别如下:

表2 FWO法所得的各个吸热峰的活化能E和相关系数rTable 2 Activation energies (E) and linear related coefficients (r) of endothermic peaks obtained by FWO method

图5 各个吸热峰在不同升温速率下的 lg β与1/Tm的关系Fig.5 Relationship between lg β and 1/Tmat different heating rates for very peaks: (a) Peak 1; (b) Peak 2; (c) Peak 3; (d) Peak 4; (e) Peak 5; (f) Peak 6

表3 Kissinger法所得的各个吸热峰的活化能E、频率因子A和相关系数rTable 3 Activation energies (E),frequency factor (A) and linear related coefficients (r) of endothermic peaks obtained by Kissinger method

表4 利用FWO法和Kissinger法所得的平均活化能Table 4 Average activation energies calculated using FWO and Kissinger methods

表5 不同加热速率下的峰形因子I和反应级数nTable 5 Peak shape index (I) and reaction order (n) at different heating rates

从表5可以看出,碳热还原反应Al2O3和SiO2过程所涉及的6个吸热峰中,SiO2和Al2O3的晶型转变以及高温下SiC的分解反应的E值比其他几个反应的E值大。这是因为α–石英到亚稳态α–方石英的晶型转换属于迟缓转化。由于这种转化由表面逐步向内部进行,转化后发生结构变化,形成新的亚稳晶型,因此需要较高的活化能[13]。而氧化铝晶型转变由于是从氧离子排列为fcc骨架的中间型向氧离子排列为hcp骨架的转变,属于晶格重构相变,涉及离子半径较大的氧离子的移动,所以需要很高的能量[23]。在实际工业生产中,大量SiC因为缺少活化能难于分解而积累在炉底,常常导致炉底上涨直至被迫停炉。由于Al2O3因晶型转变而使得自身活性减小,SiO2的晶型转变伴随着较为剧烈的体积膨胀,二者都不利于碳热还原反应的进行,同时,SiC生成的E值较低而分解的E值较高,因此,在碳热还原制取铝硅合金过程中,宜采用快速升温及适当延长高温下的反应时间,以求获取较高的金属收率,避免炉底上涨。
表6列出了相同配比的物料在真空碳管炉和电弧炉中所获产物主要成分的XRF及定硫定碳仪测试结果。碳管炉虽可以达到碳热法制取铝硅合金反应温度,但因为升温速度较慢(5 ℃/min),所以产物中有大量的SiC,另外,还有较多的氧化物残余和其他杂质,而Al、Si的含量较低。电弧炉利用阴阳电极起弧产生热量,热量较为集中,普通电弧炉就能在很短时间内由室温升温至2 000 ℃左右,因此,在炉底熔炼带残余的SiC及其他杂质较少,Al、Si的含量也相应地大幅提高。由此可见,提高升温速率对铝硅合金的熔炼至关重要。二者比较,验证了动力学研究结果的可行性。

表6 真空碳管炉和电弧炉所获产物的主要组成Table 6 Main composition of samples obtained in vacuum graphite furnace and arc furnace
3 结论
1) 碳热共还原Al2O3、SiO2的反应过程可分为4个阶段:烟煤热解阶段;Al2O3、SiO2的晶型转变阶段;碳化物的生成与分解阶段;生成物的损失阶段。其中,以碳化物的生成与分解阶段为主。
2) 碳热还原反应的4种还原机理中,碳化物的生成与分解理论能较好地解释反应过程中出现的反应现象,具体的反应方程为:SiO2+3C=SiC+2CO,2Al2O3+ 9C=Al4C3+6CO,3SiO2+2Al4C3=8Al+3Si+6CO,3SiC+ Al2O3=2Al+3Si+3CO;
3) 不同升温速率的DTA曲线测试表明,整个反应过程均存在6个吸热峰,6个峰所处的温度范围大致为1 220~1 240、1 340~1 360、1 680~1 730、1 850~ 1 950、1 970~2 050和2 100~2 160 K;
4) 利用FWO法和Kissinger法计算了碳热还原过程中各个吸热峰的表观活化能,每个峰的平均表观活化能依次为848.9、945.4、569.7、325.7、431.9和723.1 kJ/mol。应用Kissinger法获得了峰形指数、反应级数和频率因子等重要的动力学参数,确定了反应动力学方程, 并通过理论分析,结合真空碳管炉实验及直流电弧炉实验结果解释和验证了动力学计算结果的可行性。
REFERENCES
[1] 邱竹贤. 有色金属冶金学[M]. 北京: 冶金工业出版社, 1988: 86-87. QIU Zhu-xian. Nonferrous metals metallurgy[M]. Beijing: Metallurgical Industry Press, 1998: 86-87.
[2] 东北工学院轻金属教研组. 轻金属冶金学[M]. 北京: 冶金工业出版社, 1960: 366−392. School of Metallurgy of Northeastern University. Light metals metallurgy [M]. Beijing: Metallurgical Industrial Press, 1960: 366−392.
[3] 狄鸿利. 炭还原法熔炼铝硅合金[J]. 轻金属. 1982(11): 38−41. DI Hong-li. Preparation of aluminium-silicon alloys by carbothermal reduction method [J]. Light Metals, 1982(11): 38−41.
[4] STEVENSON D T. Feasibility of an aluminum-silicon blast-arc process [C]//McGeer J P. Lights Metals. Warrendale, P A: TMS, 1984: 1571−1579.
[5] BRUNO M J. Overview of ALCOA direct reduction process technology[C]//McGeer J P. Light Metals. Warrendale, PA: TMS, 1984: 1613−1631.
[6] 阮艳莉, 唐致远. LiFePO4的合成及其热分析动力学[J]. 物理化学学报, 2008, 24(5): 873−879. RUAN Yan-Li,TANG Zhi-Yuan. Synthesis of LiFePO4and thermal dynamics of the precursor[J]. Acta Phys Chim Sin, 2008, 24(5): 873−879.
[7] 李文超. 冶金与材料物理化学[M]. 北京: 冶金工业出版社, 2001: 68. LI Wen-chao. Metallurgy and material physicochemistry[M]. Beijing: Metallurgical Industry Press, 2001: 168.
[8] 李春宏, 仇卫华, 康晓丽, 周国治, 鲁雄刚, 李福燊. 固相反应合成Ba1.0Co0.7Fe0.2Nb0.1O3的动力学[J]. 物理化学学报, 2008, 24(5): 767− 771. LI Chun-hong, QIU Wei-hua, KANG Xiao-li, CHOU Kuo-chih, LU Xiong-gang, LI Fu-shen. Kinetics of synthesis of Ba1.0Co0.7Fe0.2Nb0.1O3through solid-solid reaction[J]. Acta Phys Chim Sin, 2008, 24(5): 767−771.
[9] 李智敏, 仇卫华, 胡环宇, 赵海雷, 高长贺. 锂离子电池正极材料锰酸锂的优化合成[J]. 无机材料学报, 2004, 19(2): 333−348. LI Zhi-min, QIU Wei-hua, HU Huan-yu, ZHAO Hai-lei, GAO Chang-he. Optimized synthesis of LiMn2O4cathode materials for Li-ion batteries[J]. Journal of Inorganic Materials, 2004, 19(2): 333−348.
[10] 赵铭姝, 汪 飞, 宋晓平. 锂离子电池正极材料锰钴酸锂的表征与分解动力学[J]. 中国有色金属学报, 2005, 15, 9: 1396−1402. ZHAO Ming-shu, WANG Fei, SONG Xiao-ping. Synthesizing kinetics and characteristics of LiMnCoO4using as lithium-ion battery cathode material[J]. The Chinese Journal of Nonferrous Metals, 2005, 15(9): 1396−1402.
[11] EBRAHIMI-KAHRIZSANGI R, AMINI-Kahrizsangi E. Zirconia carbothermal reduction: Non-isothermal kinetics[J]. Int, Journal of Refractory Metals & Hard Materials, 2009, 27: 637−641.
[12] 杨 栋, 傅大学, 王耀武, 冯乃祥. 以铝土矿尾矿为原料碳热法制取铝硅合金中生团块的性能[J]. 过程工程学报, 2008, 8(5): 920−925. YANG Dong, FU Da-xue, WANG Yao-wu, FENG Nai-xiang. Properties of green pellets used to produce Al−Si alloy from bauxite tail by carbothermal method[J]. The Chinese Journal of Process Engineering, 2008, 8(5): 920−925.
[13] 黄 金, 张仁元, 伍 彬. 多晶 Na2SO4/ SiO2复合相变储能材料晶型转变及热膨胀特性分析[J]. 材料工程, 2006(12): 16−20. HUANG Jin, ZHANG Ren-yuan, WU Bin. Crystal forms transformation and thermal expansion property of polycrystalline Na2SO4/ SiO2composite phase change energy storage materials[J]. Journal of Materials Engineering, 2006(12): 16−20.
[14] HE Zeng-xian, HUANG Dan, CHEN Wei-ping. Study on the fabrication of Al2O3/SiC composites by in-situ carbothermal reduction of kaolin[J]. Science Technology and Engineering,2008, 8(11): 2870−2873.
[15] 姚广春. 电热法制取铝硅合金[M]. 沈阳: 东北大学出版社, 1998: 20. YAO Guang-chun. Preparation of Al-Si alloy by electrothermal process[M]. Shenyang: Northeastern University Press, 1998: 20.
[16] MURRAY J P. Solar production of aluminum by direct reduction: preliminary results for two processes[J]. Journal of Solar Energy Engineering, 2001, 123: 125−132.
[17] 张 烽, 李蒙姬. 含铝50%的硅铝合金生产技术[J]. 铁合金, 2003, (4): 17−21. ZHANG Feng, LI Meng-ji. Technology of producing aluminum-silion alloys (50%)[J]. Ferro-Alloys, 2003, (4): 17−21.
[18] OZAWA T A. New method of analyzing thermogravimetric data[J]. Bulletin of Chemistry Society of Japan, 1965, 38(11): 1881−1883.
[19] FLYNN J H, WALL L A. A quick, direct method for the determination of activation energy from thermogravimetric data[J]. J Polym Sci Part B: Polymer Lettlers, 1966, 4(5): 323−328.
[20] KISSINGER H E. Reaction kinetics in differential thermal analysis[J]. Analytical Chemstry, 1957, 29(11): 1702−1704.
[21] GAO Chuan-hui, LI Xian-guo, FENG Li-juan, XIANG Zhan-chang, ZHANG Da-hai. Preparation and thermal decomposition of 5Mg(OH)2·MgSO4·2H2O nanowhiskers[J]. Chemical Engineering Journal, 2009, 150: 551−554.
[22] SATAVA V, SETAK J. Computer calculation of the mechanism and associated kinetic data using a nonisothermal integral Method [J]. J Therm Anal, 1975, 8(3): 477−489.
[23] 吴玉程, 宋振亚, 杨 晔, 李 勇, 崔 平. 氧化铝α相变及其相变控制的研究[J]. 稀有金属, 2004, 28, 6: 1044−1088. WU Yu-cheng, SONG Zhen-ya, YANG Ye, LI Yong, CUI Ping. Mechanism and control of α-phase transformation of alumina[J]. Chinese Journal of Rare Metals, 2004, 28, 6: 1044−1088.
(编辑 何学锋)
Reaction mechanism and kinetics of preparation of aluminium-silicon alloys by carbothermal reduction method
YANG Dong,FENG Nai-xiang, WANG Yao-wu,PENG Jian-ping, WANG Zi-qian,DI Yue-zhong
(School of Materials and Metallurgy, Northeastern University, Shenyang 110004, China)
The composition of products obtained under different temperatures in vacuum graphite furnace was studied by XRD, and the reaction process of carbothermal reduction of Al2O3and SiO2was analysed by TG-DTA as well. Based on these, the reaction mechanism of carbothermal reduction method was discussed. The kinetics of preparation of Al-Si alloys by carbothermal reduction of Al2O3and SiO2was studied by means of differential temperature analysis (DTA) at different temperature rising rates of 10, 15, 20 and 25 K/min. The results show that the carbothermal reduction process can be divided into 4 stages, and the key stage is the formation and decomposition of carbides period. Among the 4 mechanisms of carbothermal reduction of Al2O3and SiO2, the formation and decomposition of carbides theory may be the best one to interpret the reaction process. The apparent activation energy of each endothermic peak is obtained by Flynn-Wall-Ozawa and Kissinger methods as follows: 848.9, 945.4, 569.7, 325.7, 431.9 and 723.1 kJ/mol, and the kinetic equations are also determined. Meanwhile, the feasibility of the results of kinetics analysis is verified using the products obtained in vacuum graphite furnace and arc furnace by XRF and infrared absorption carbon-sulfur analysis unit.
carbothermal reduction;differential thermal analysis;aluminium-silicon alloy;reaction mechanism;kinetics equation
TF655.3.2
A
1004-0609(2011)01-0227-09
国家高技术研究发展计划资助项目(2007AA06Z116)
2009-05-27;
2010-10-29
冯乃祥, 教授, 博士; 电话: 024-83686463; E-mail: fengnaixiang@163.com

