RQ-PCR检测Ig/TCR基因重排监测急性淋巴细胞白血病患儿治疗过程微小残留白血病
李彦媚 叶铁真 赖冬波 何映谊 林慧玲
目前,随着治疗方法的进步,90%以上的儿童急性淋巴细胞白血病(ALL)在诱导化疗后可获得完全缓解(CR),并有70%~80%可获得5年持续完全缓解(CCR)。然而,仍有20%~30%患儿在缓解后复发,这与体内仍然存在形态学上无法检测的残留白血病细胞,即微小残留白血病(MRD)有关。大量研究证明,MRD是最能反映个体治疗效果和预后情况的指标之一,也是引起白血病复发的最主要原因之一。在白血病治疗过程中准确检测MRD并分析其意义,对临床追踪病情和判断预后,并据此制定更具针对性的个体化治疗方案等,具有重要意义[1]。
RQ-PCR检测免疫球蛋白(Ig)/T细胞抗原受体(TCR)基因重排是目前定量追踪ALL-MRD的可靠方法[2,3]。本研究以RQ-PCR检测[4,5]Ig/TCR基因重排,监测广州市妇女儿童医疗中心(我院)收治ALL患儿在治疗过程中MRD的变化趋势,以评价该方法在儿童ALL中的应用价值。
1 方法
1.1 纳入标准 ①2009年3月至2011年3月在我院血液肿瘤科初诊和治疗的ALL患儿;②均经骨髓细胞形态学[6]和免疫分型诊断[7];③以广东地区儿童ALL 2008化疗协作组方案(GD2008ALL)进行危险度分型及化疗[8];④采集的骨髓样本除用于细胞学检测外的剩余标本被用于Ig/TCR基因重排检测。
1.2 伦理审核 本研究经我院伦理委员会审核通过。
1.3 随访观测时点 以下时间点采集骨髓标本用于临床评估:①初诊时(0个月);②诱导缓解治疗末d33(随访1个月);③巩固治疗前(随访2个月);④早期强化治疗前(随访4个月);⑤维持治疗前(随访6 个月);⑥维持治疗阶段(由维持治疗开始后每90天随访1次)。连续随访至早期强化治疗前的患儿进入分析。以上时间同时检测Ig/TCR基因重排表达量。
1.4Ig/TCR基因重排检测
1.4.1 标本处理 骨髓标本以Ficoll密度梯度离心法分离单个核细胞,并使用分离柱试剂盒(购自中国TRANSGEN公司)提取单个核细胞DNA。
1.4.2 PCR检测初诊患儿Ig/TCR基因重排 ①选取欧洲Biomed-1和Biomed-2研究中的12对引物(表1),以PCR扩增每例初诊ALL患儿骨髓标本的IgH、Igκ、TCRγ和TCRδ基因重排[9,10]。PCR反应体系包括PCR MixBuffer (10×)5.0 μL(日本TOYOBO公司)、上下游引物(由广州英骏生物公司合成)各70 pmol、模板DNA 100 ng,加去离子水至终体积50 μL。PCR反应条件:94℃ 7 min;94℃30 s,60℃ 45 s,72℃ 90 s,共35个循环;72℃ 10 min,4℃保存。每次反应均设阳性对照(Jurkat细胞或Reh细胞DNA)、阴性对照(正常人DNA)和空白对照(以双蒸水取代模板DNA);②1.5%琼脂糖凝胶电泳鉴定PCR产物。
表1 PCR检测Ig/TCR基因重排的引物序列
Tab 1 Sequence of primers forIg/TCRgene rearrange-ments detection
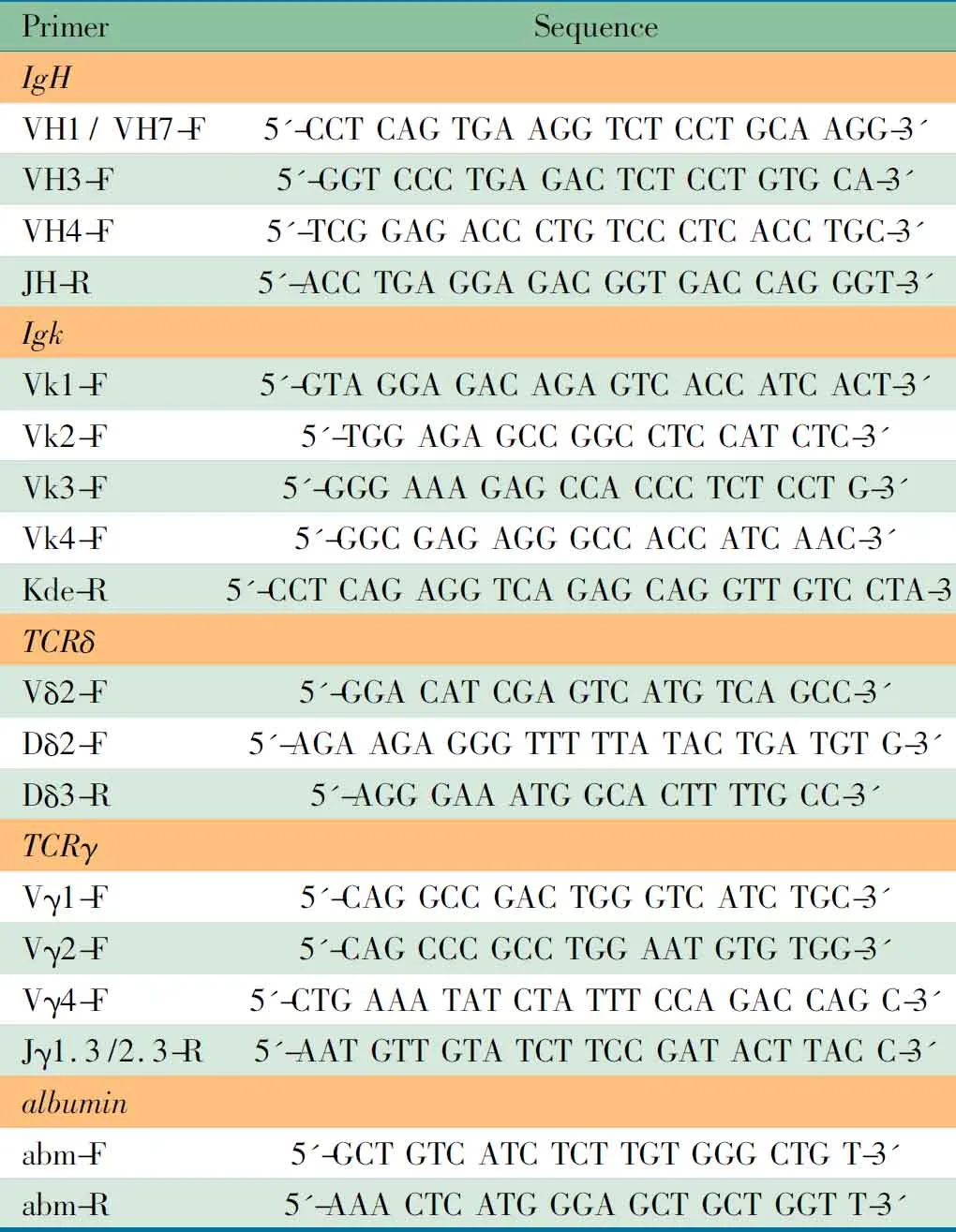
PrimerSequenceIgHVH1/VH7-F5'-CCTCAGTGAAGGTCTCCTGCAAGG-3'VH3-F5'-GGTCCCTGAGACTCTCCTGTGCA-3'VH4-F5'-TCGGAGACCCTGTCCCTCACCTGC-3'JH-R5'-ACCTGAGGAGACGGTGACCAGGGT-3'IgkVk1-F5'-GTAGGAGACAGAGTCACCATCACT-3'Vk2-F5'-TGGAGAGCCGGCCTCCATCTC-3'Vk3-F5'-GGGAAAGAGCCACCCTCTCCTG-3'Vk4-F5'-GGCGAGAGGGCCACCATCAAC-3'Kde-R5'-CCTCAGAGGTCAGAGCAGGTTGTCCTA-3'TCRδVδ2-F5'-GGACATCGAGTCATGTCAGCC-3'Dδ2-F5'-AGAAGAGGGTTTTTATACTGATGTG-3'Dδ3-R5'-AGGGAAATGGCACTTTTGCC-3'TCRγVγ1-F5'-CAGGCCGACTGGGTCATCTGC-3'Vγ2-F5'-CAGCCCGCCTGGAATGTGTGG-3'Vγ4-F5'-CTGAAATATCTATTTCCAGACCAGC-3'Jγ1.3/2.3-R5'-AATGTTGTATCTTCCGATACTTACC-3'albuminabm-F5'-GCTGTCATCTCTTGTGGGCTGT-3'abm-R5'-AAACTCATGGGAGCTGCTGGTT-3'
Notes F:forward primer;R:reverse primer,reverse primer labeled with FAM at 5′ site
1.4.3 基因扫描分析Ig/TCR基因重排产物克隆特性[10]①取上述PCR的阳性产物1 μL,加入9.5 μL甲酰胺和0.5 μL Genescan-500荧光标记分子量标准品(美国ABI公司),置于PCR仪上反应,95℃ 2 min,4℃ 60 min,以形成异源双链DNA;②将异源双链DNA置基因扫描仪(美国ABI公司)上检测,使用仪器配置的软件分析Ig/TCR基因重排的克隆性。
1.4.4 RQ-PCR检测Ig/TCR基因重排相对表达量 ①对经上述基因扫描鉴定为单克隆的PCR产物进行测序;②将测序结果输入IMGT数据库(http://imgt.cines.fr/imgt-vquest/ share/ textes/)进行同源性比对,确定每例患儿特异的Ig/TCR基因重排序列,以此序列为MRD追踪靶目标,在Primer 3.0软件中设计特异性引物,根据IgH、Igκ、TCRγ、TCRδ基因的J片段保守序列设计探针[11];③用正常人DNA将初诊患儿骨髓DNA(600 ng)梯度稀释至1.0×10-1~1.0×10-6浓度以建立Ig/TCR基因重排的标准曲线;以去离子水将正常人DNA梯度稀释至1 000、500、100、50和10 ng以建立内参基因albumin的标准曲线。RQ-PCR反应体系见表2,反应条件:95℃ 60 s;95℃ 15 s,60°C 60 s,共40个循环,退火温度可根据特异性引物Tm值调整。③对各观察时间标本以标准曲线计算Ig/TCR基因重排表达量。每份样本设2个复管,同时以albumin基因为阳性对照、正常人DNA为阴性对照和双蒸水为空白对照。以Ig/TCR基因重排的表达量与albumin管基因表达量之比,即Ig/TCR基因重排的相对表达量反映MRD水平。
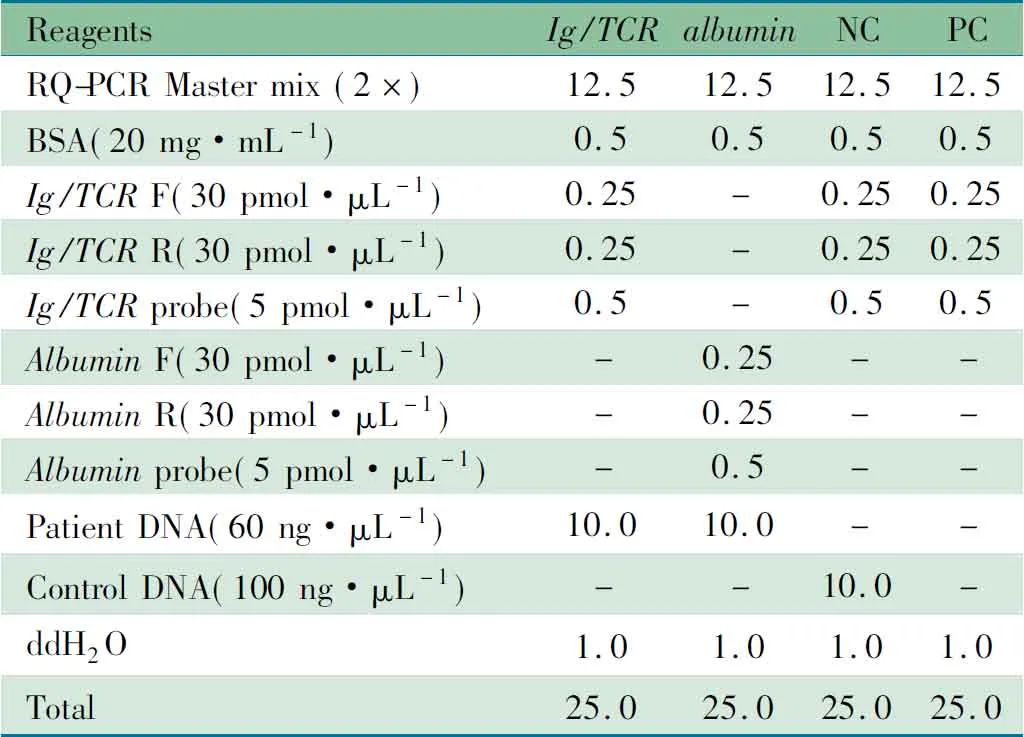
表2 RQ-PCR反应体系(μL)
Notes NC: negative control; PC: positive control; F:forward primer;R:reverse primer
1.5 研究指标的定义 ①临床危险度:诱导治疗前按GD2008ALL方案[8]分为高危(HR)、标危(SR)和中危(IR)。②Ig/TCR基因重排表达量危险度分期:在诱导缓解治疗结束时(d33)划分危险度:Ig/TCR基因重排相对表达量<1.0×10-4为SR,~1.0×10-3为IR,≥1.0×10-3为HR;③MRD阴性:Ig/TCR基因重排相对表达量<1.0×10-4;④ CCR:经治疗获得完全缓解后,持续3~5年或更长时间无复发者。⑤复发:治疗达到缓解后发生以下任一项:a.骨髓原始细胞+幼稚细胞>0.05但<0.20,经过有效抗白血病治疗1个疗程仍未达到骨髓CR标准者;b.骨髓原始细胞+幼稚细胞≥0.20者;c.骨髓外白血病浸润者。
2 结果
2.1 一般情况 86例初诊ALL患儿进入分析,其中男52例,女34例;年龄1~13(4.3±3.0)岁;1~5岁63例,≥6岁23例;L1型50例,L2型30例,L3型6例;B-ALL 76例,T-ALL 10例; 临床危险度SR 28例,IR 40例和HR 18例。随访至2011年4月30日,随访时间1~26(14.3±7.0)个月,复发5例(5.8%)。
2.2 初诊ALL患儿Ig/TCR基因重排的总检出率 86例初诊ALL患儿中,83例(96.5%)检出1种或以上Ig/TCR基因重排,共检出209个Ig/TCR基因重排,平均每例检出2.52个。1种基因重排者占13.2%(11/83例);同时存在2、3和4种Ig/TCR基因重排分别为34.9%(29例)、38.6%(32例)和13.2%(11例)。4种Ig/TCR基因重排的比例依次为IgH80.7%(67例)、TCRδ67.5%(56例)、Igκ55.4%(46例)和TCRγ49.4%(41例)。
2.3 初诊患儿Ig/TCR基因重排的克隆特性 83例检出Ig/TCR基因重排的病例中,根据患儿来院随访条件最大限度的依从性,61例患儿的172个Ig/TCR基因重排行基因扫描。56/61例(91.8%)可检出1种或以上单克隆性Ig/TCR基因重排;172个Ig/TCR基因重排中,单克隆性、寡克隆性和多克隆性Ig/TCR基因重排的检出率分别为58.1%(100个)、30.8%(53个)和11.0%(19个),差异有统计学意义(P=0.000)。
2.4 随访患儿Ig/TCR基因重排相对表达量 26/56例单克隆性Ig/TCR基因重排患儿完成连续3次随访,其中22例CCR和4例复发。如表3所示,22例CCR患儿初诊时Ig/TCR基因重排的相对表达量为2.70×10-1±2.55×10-1,诱导缓解治疗结束时d33降至9.91×10-4±2.08×10-3,差异有统计学意义(P=0.000);在巩固治疗开始前,Ig/TCR基因重排的相对表达量进一步下降至7.85×10-5±2.76×10-4,与诱导缓解结束时d33比较差异有统计学意义(P=0.036);其后至维持治疗9个月期间,各检测时点Ig/TCR基因重排相对表达量在1.0×10-5~1.0×10-6,与相近上个随访时点比较差异均无统计学意义;在维持治疗12个月后,均未检出Ig/TCR基因重排相对表达量。
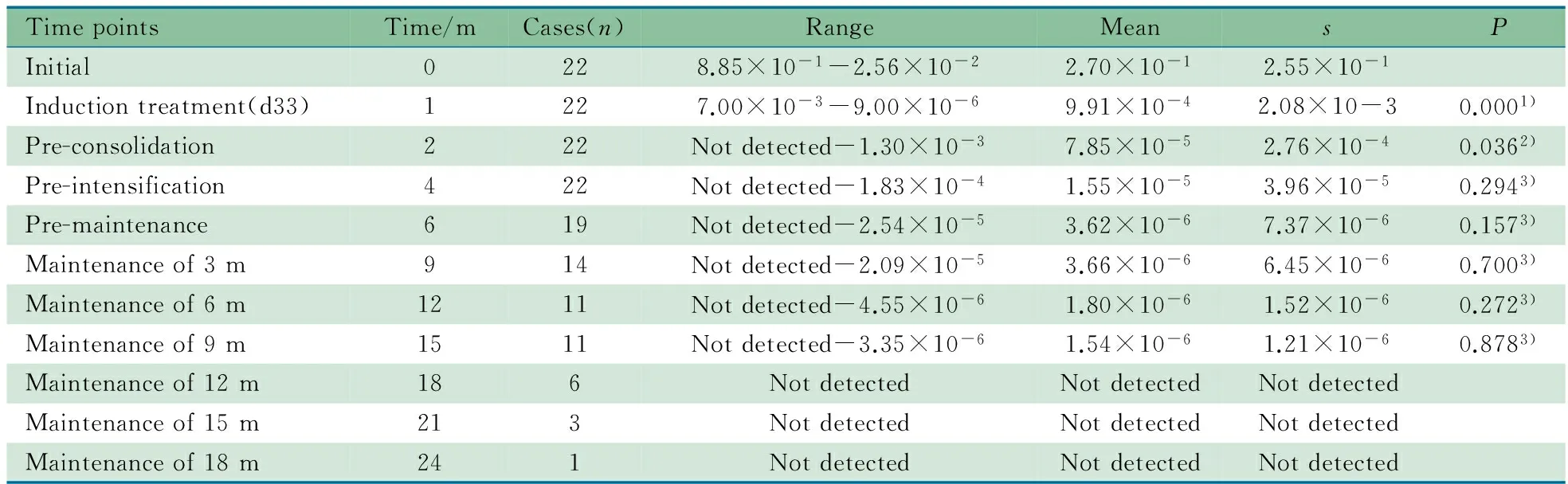
表3 22例CCR患儿不同治疗时点的Ig/TCR基因重排相对表达量
Notes m: month; 1)vsinitial; 2)vsd33; 3)compared with the last follow-up point
表4显示,4例复发患儿初诊时Ig/TCR基因重排相对表达量均>1.0×10-1;在诱导缓解治疗结束时(d33)均明显下降,处于同期CCR病例水平。例1Ig/TCR基因重排相对表达量在早期强化治疗前开始升高,其后继续升高,并一直维持在同期CCR病例的均值水平以上,至维持治疗6个月时骨髓复发,从回升至骨髓复发为8个月;例2的Ig/TCR基因重排相对表达量在诱导缓解治疗结束时(d33)至早期强化治疗前呈下降趋势,但一直高于同期CCR病例水平,至维持治疗前开始回升,在维持治疗3个月时出现骨髓复发,从回升至骨髓复发为3个月;例3和4Ig/TCR基因重排的相对表达量在巩固治疗前回升至同期CCR病例水平以上,均在早期强化前即出现骨髓复发,从回升到骨髓复发均为2个月。复发病例4经再予诱导缓解治疗后,Ig/TCR基因重排表达量降至8.66×10-4。4例患儿Ig/TCR基因重排的相对表达量开始回升至临床复发的平均时间为3.75(2~8)个月。

表4 4例复发患儿不同治疗时点的Ig/TCR基因重排相对表达量
Notes m: month; red fonts indicated relapse
2.4 临床危险度与Ig/TCR基因重排划分危险度的关系 表5显示,26例随访患儿诱导治疗结束时(d33)根据Ig/TCR基因重排相对表达量划分危险度,SR 10例(38.5%),IR 12例(46.2%),HR 4例(15.4%);诱导治疗前SR 7例(26.9%),IR 13例(50.0%),HR 6例(23.1%)。两者分级一致11例(42.3%),其中SR 4例、IR 5例、HR 2例。
4例复发患儿初诊时IR 3例,SR 1例;根据Ig/TCR基因重排相对表达量重新划分危险度,例3原为SR调整为IR(Ig/TCR基因重排相对表达量为8.00×10-4),例2原为IR调整为HR(Ig/TCR基因重排相对表达量为1.20×10-3),例1和4的分级不变。
表5 临床危险度分级与根据Ig/TCR基因重排相对表达量划分危险度分级结果(n)
Tab 5 Comparison of risk stratification by clinical data andIg/TCR(n)
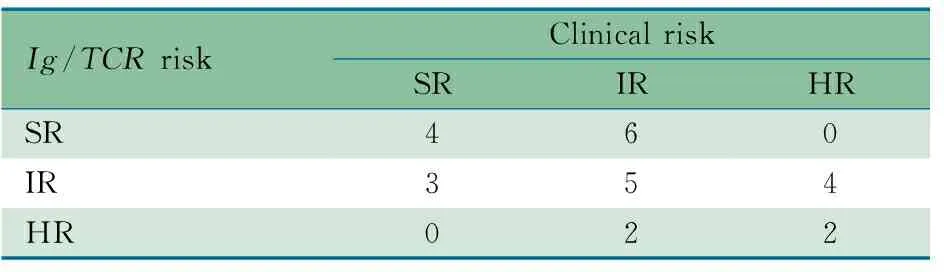
Ig/TCRriskClinicalriskSRIRHRSR460IR354HR022
Notes SR: standard risk; IR: intermediate risk; HR: high risk
3 讨论
3.1 联合检测多种Ig/TCR基因重排可保证检出率 文献报道,Ig/TCR基因重排在儿童和成人ALL中均具有极高的检出率,97%以上B-ALL患者可检出1种Ig/TCR基因重排[12]。欧洲白血病治疗协作组通过Biomed-1和Biomed-2研究,已建立了PCR检测Ig/TCR基因重排的通用引物系统,该系统所使用的引物共108对,Ig/TCR基因重排的检出率达到100%。但该系统引物数量较多,不利于其临床应用。Szczepański等[13]选用Biomed-1引物系统中的25对引物检测96例初诊B-ALL患儿的IgH、Igκ、TCRδ和TCRγ基因重排,结果显示98%患儿可检出Ig/TCR基因重排。本研究初诊ALL患儿Ig/TCR基因重排的检出率达96.5%,提示通过联合检测多种Ig/TCR基因重排,既可减少引物的数量,同时又可获得较高的检出率,这可能更适合儿科临床实际,提高临床应用的可行性。
3.2 基因扫描可有效筛选出不同克隆特性的Ig/TCR基因重排 寡克隆性基因重排在儿童B-ALL中常见,其中寡克隆性IgH和TCRδ基因重排发生率为30%~40%[13];并且不同克隆来源的基因重排在白血病治疗过程中可发生优势变化,若以寡克隆性基因重排作为MRD检测的靶目标,则可因为随访过程中靶目标的丢失,使MRD检测出现假阴性结果。因此,多个研究机构均建议初诊时应对Ig/TCR基因重排进行克隆性分析[5,11,13],首选单克隆性基因重排作为MRD检测的靶目标。本研究采用基因扫描方法,对ALL患儿的Ig/TCR基因重排PCR产物进行克隆性分析,结果符合白血病淋巴细胞Ig/TCR基因重排的克隆特点,提示基因扫描可准确分析Ig/TCR基因重排的克隆性,有效筛选出不同克隆特性的Ig/TCR基因重排。
3.3Ig/TCR基因重排可评价疗效和判断预后 本研究22例CCR患儿的Ig/TCR基因重排相对表达量在诱导治疗后明显下降,并随着治疗时间的延长而持续下降,直至阴性。Li等[14]用RQ-PCR扩增Ig/TCR基因重排,对36例诱导缓解化疗d29的B-ALL患儿进行MRD定量检测,MRD水平≥1.0×10-3与复发显著相关(P=0.002 5)。Zhou等[15]以RQ-PCR检测284例B-ALL患儿Ig/TCR基因重排,诱导治疗结束时Ig/TCR基因重排相对表达量<1.0×10-3者5年复发风险为12%,≥1.0×10-3者为72%。Ryan等[16]分别在诱导治疗15 d、巩固治疗、强化治疗结束等时间点检测Ig/TCR基因重排相对表达量,发现以上各时点的MRD水平均与复发显著相关,尤其≥1.0×10-3者在短期内有复发倾向。本研究中4例复发的ALL患儿,复发前Ig/TCR基因重排相对表达量均已回升,从开始回升至复发的平均时间为3.75(2~8)个月,并在复发时Ig/TCR基因重排相对表达量均升至1.0×10-2以上;提示Ig/TCR基因重排相对表达量下降后又重新回升,有预示复发的意义,对此部分患儿应加强监测或调整治疗。
本研究在诱导治疗后根据Ig/TCR基因重排表达量划分危险度,15/26例与初诊时的危险度分级不一致,其中4例复发患儿诱导化疗结束时,以Ig/TCR基因重排相对表达量重新划分危险度,1例原为IR调整为HR,1例SR患儿调整为IR,即2例患儿的危险度升级。提示在诱导缓解治疗结束时,按Ig/TCR基因重排相对表达量重新划分危险度可准确地评价疗效、判断预后。
3.4 本研究的不足之处和局限性 ①由于患儿入组时间不一致,部分患儿未完成本研究设定的连续3次随访;同时部分患儿失访,导致本研究进入Ig/TCR基因重排相对表达量动态分析的样本量不多;②纳入复发患儿仅4例,因此无法按B-ALL 和T-ALL进一步分析。
[1]Campana D. Minimal residual disease in acute lymphoblastic leukemia. Semin Hematol, 2009, 46(1): 100-106
[2]Li YM(李彦媚), Ye TZ. 以Ig/TCR基因重排为靶目标检测微小残留白血病的研究进展.International Journal of Blood Transfusion and Hematology(国际输血及血液学杂志), 2009, 32(3): 229-232
[3]He YY(何映谊), Ye TZ. Detection of minimal residual disease in children leukemia patients by using pcr-review. Journal of Experimental Hematology(中国实验血液学杂志), 2007, 15(3): 652-656
[4]van der Velden VH, Cazzaniga G, Schrauder A, et al. Analysis of minimal residual disease by Ig/TCR gene rearrangements: guidelines for interpretation of real-time quantitative PCR data. Leukemia, 2007, 21(4): 604-611
[5]Flohr T, Schrauder A, Cazzaniga G, et al. Minimal residual disease-directed risk stratification using real-time quantitative PCR analysis of immunoglobulin and T-cell receptor gene rearrangements in the international multicenter trial AIEOP-BFM ALL 2000 for childhood acute lymphoblastic leukemia. Leukemia, 2008, 22(4): 771-782
[6]Lilleyman JS, Hann IM, Stevens RF, et al. French American British (FAB) morphological classification of childhood lymphoblastic leukaemia and its clinical importance. J Clin Pathol, 1986, 39(9): 998-1002
[7]Bene MC, Castoldi G, Knapp W, et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias(EGIL). Leukemia, 1995, 9(10): 1783-1786
[8]Fang JP(方建培), Ye TZ, Luo XQ, et al. 753例GD2008ALL化疗协作方案治疗ALL病人的临床疗效.中华医学会第十七次全国儿科学术大会.106
[9]Pongers-Willemse MJ, Seriu T, Stolz F, et al. Primers and protocols for standardized detection of minimal residual disease in acute lymphoblastic leukemia using immunoglobulin and T cell receptor gene rearrangements and TAL1 deletions as PCR targets. Report of the Biomed-1 Concerted Action: Investigation of minimal residual disease in acute leukemia. Leukemia, 1999, 13(1): 110-118
[10]van Dongen JJ, Langerak AW, Brüggemann M, et al. Design and standardization of PCR primers and protocols for detection of clonal immunoglobulin and T-cell receptor gene recombinations in suspect lymphoproliferations: report of the BIOMED-2 Concerted Action BMH4-CT98-3936. Leukemia, 2003, 17(12): 2257-2317
[11]Cui L(崔蕾), Li ZG, Gao C, et al. Quantitative determination of immunoglobulin heavy chain gene rearrangements in childhood acute lymphoblastic leukemia. Chinese Journal of Laboratory Medicine(中华检验医学杂志), 2007, 30(10): 1119-1122
[12]Thorn I, Forestier E, Thuresson B, et al. Applicability of IG/TCR gene rearrangements as targets for minimal residual disease assessment in a population-based cohort of Swedish childhood acute lymphoblastic leukaemia diagnosed 2002-2006. Eur J Haematol, 2010, 84(2): 117-127
[13]Szczepański T, Flohr T, van der Velden VH, et al. Molecular monitoring of residual disease using antigen receptor genes in childhood acute lymphoblastic leukaemia. Best Pract Res Clin Haematol, 2002, 15(1): 37-57
[14]Li AH, Forestier E, Rosenquist R, et al. Minimal residual disease quantification in childhood acute lymphoblastic leukemia by real-time polymerase chain reaction using the SYBR green dye. Exp Hematol, 2002, 30(10):1170-1177
[15]Zhou J, Goldwasser MA, Li A, et al. Quantitative analysis of minimal residual disease predicts relapse in children with B-lineage acute lymphoblastic leukemia in DFCI ALL Consortium Protocol 95-01. Blood, 2007, 110(5): 1607-1611
[16]Ryan J, Quinn F, Meunier A, et al. Minimal residual disease detection in childhood acute lymphoblastic leukaemia patients at multiple time-points reveals high levels of concordance between molecular and immunophenotypic approaches. Br J Haematol, 2009, 144(1): 107-115

