含组氨酸标签的小分子抗体临床应用现状
刘晓,屈琳,黄昌发,余馨,罗勤
单链抗体(scFv)是由免疫球蛋白的重链可变区(VH)和轻链可变区(VL)通过一条连接肽,如 (GGGGS)4连接而成的小分子抗体(图 1)。与全抗相比,它因分子小、容易进入实体肿瘤、体内清除快、免疫原性低、成像清晰等优点成为目前医用抗体研究的热点[1]。另外,单链抗体易于实现基因操作,可采用微生物细胞规模生产,因而相对于哺乳动物细胞生产线,其制造成本低,在制药工业得到了广泛的应用。重组蛋白质药物生产的关键技术之一是目的蛋白的纯化,即如何将重组蛋白从微生物细胞产生的总蛋白中分离纯化出来。使用蛋白标签进行亲和纯化是目前最有效的蛋白分离纯化方法。近年来,多种蛋白标签相继发明应用。其中,组氨酸标签 [(His)6-Tag] 由于其分子量小,被广泛应用于重组蛋白的亲和纯化。此外,组氨酸标签还可用于蛋白的定性定量检测,最近还发现组氨酸标签可用于特定同位素标记。因此,组氨酸标签在医用蛋白,包括小分子抗体中的应用已经越来越普遍。本文综述了含组氨酸标签小分子抗体在生物制药领域中的应用现状,以期为组氨酸标签在重组蛋白药物中的应用提供有价值的参考。
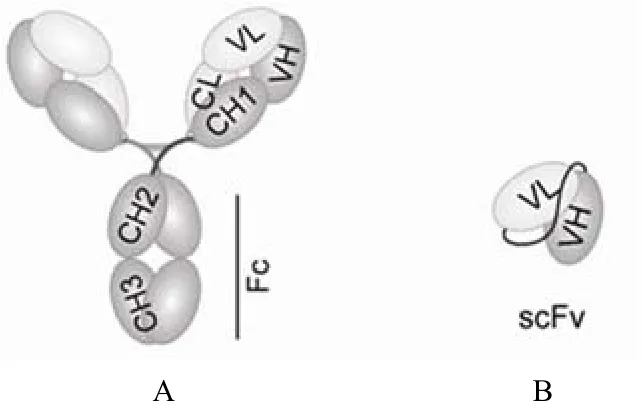
图 1 抗体结构图
1 组氨酸标签简介
组氨酸标签一般由连续 6 个组氨酸组成,即 (His)6,连续 5 ~ 9 个组氨酸标签也有报道,可直接连接到蛋白N-端或 C-端,产生融合蛋白,一般不影响蛋白的结构及功能。组氨酸标签特定结合 NTA(氨基三乙酸)金属离子络合物(图 2),其亲合力为 1 μmol/L。Ni2+是常用的金属离子,其他离子,如 Co2+、Cu2+、Zn2+也可使用。
NTA 可固定到不同的固相载体上,从而产生不同类型的层析柱。固定化金属亲和层析(immobilised metal affinity chromatography,IMAC)是广泛使用的亲和分离纯化技术[2]。该技术操作简单、快速,可在天然或变性条件下,一步将目标蛋白从总细胞液中分离出来。许多酶或荧光标记的特定抗体和 NTA 衍生物也相继出现,它们都是检测组氨酸标签的灵敏试剂。
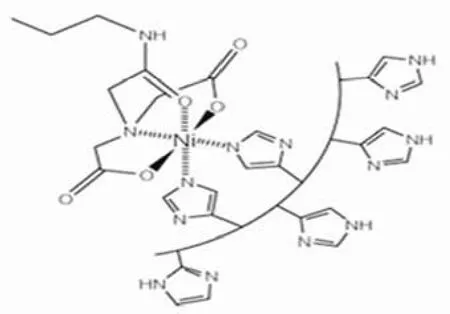
图 2 Ni-NTA 与组氨酸标签结合示意图
2 组氨酸标签是特定的同位素标记位点
将放射性同位素与特定的抗体进行偶联,可以产生理想的靶向分子。这样的靶向分子既可以作为体内肿瘤定位“显影”试剂,也可作为肿瘤治疗性分子。然而,如何定点标记小分子抗体一直是抗体药物研发的焦点。
诊断药物的标记方法应该是可在常温下操作的,具有可重复性、高效性和特异性,且不影响标记蛋白活性。目前广泛采用的赖氨酸标记法,因蛋白质本身赖氨酸含量高,易造成标记分子嵌入蛋白结合区域,从而使蛋白质失活。Cai等[3]研究表明,一种 CEA 双特异抗体用 N-琥珀酰亚胺4-[18F] 氟苯甲酸酯标记后,其免疫活性仅为原来的 57%。Tavaré 等[4]发现采用非特异性的“氨基酸定向标记”方法标记细胞死亡 SPECT 显影试剂 C2A,导致 C2A 不能与靶点结合,然而采用新的 C-末端组氨酸标签作为标记位点,则完整保留了其蛋白质功能。
组氨酸标记法操作简便,只需要将同位素衍生物与带有组氨酸标签的小分子简单混匀即可,该法稳定、高效、特异性好。Tavaré 等[4]首次将组氨酸标签和半胱氨酸残基联合作为重组蛋白的标记位点,在 C2AcHd 的 C-端额外加上CKLAAALEHHHHHH 序列。结果表明常温下(37 ℃,10 min)同位素化合物三羰基锝 [99mTc(CO)3]+标记效率和比放射性均高于仅加入组氨酸标签(C2AcH-A,~ 83%;C2AcH-F,~ 60%) 或仅加入半胱氨酸残基(C2Ac,~ 15%)。用瞬时薄层色谱(ITLC)测量放射量,C2AcH 浓度在1 μg/μl 以下,其标记率通常高于 96%;使用三羰基铼[Re(CO)3]+标记的质谱结果表明,即使标记物浓度超过蛋白质浓度 10 倍情况下,C2AcH 与 [Re(CO)3]+的结合效率未见增加,也没有证据表明其与 C2Ac 结合。Waibel 等[5]将此方法应用于带有组氨酸的一种医用小分子抗体,获得了高活性的 99 mTc 标记分子(90 mCi/mg),而且该标记的抗体在体内非常稳定,其药代动力学及体内分布均与共价键非定点碘标记的抗体无区别。由于这种定点标记新技术可用于标记不同的同位素,所以此方法不仅可以标记抗体诊断“显影”试剂,还可用于标记治疗性抗体[5]。
目前,一些同位素标记组氨酸标签的小分子抗体正应用于肿瘤临床研究[6]。试验表明,这种标记的放射自显影小分子抗体不仅体内稳定性良好,而且能准确定位人体肿瘤。另外,此方法也被用于标记其他蛋白药物,进行不同时期的临床研究[7]。
3 组氨酸标签的非免疫原性
由于越来越多带有组氨酸标签的小分子抗体进入不同时期的临床研究。人们开始关心组氨酸标签在人体内的安全性。近几年来,一些研究机构相继报道了带有组氨酸标签的重组蛋白在人体是非免疫原性的,不会影响其在临床上的应用。Kennedy 等[8]将顶膜抗原 1(AMA1)基因使用毕赤酵母进行表达,纯化得到带有组氨酸标签的 AMA1 抗原。将抗原对兔子进行免疫,产生了高效价的抗 AMA1 抗体。AMA1 疫苗的成人、儿童临床 I 期试验结果表明疫苗具有良好的耐受性,未观察到疫苗相关的异乎寻常的、严重的不良反应。在临床 I 期研究基础上,进行了临床 II 期试验,同样未观察到疫苗引起的严重的不良反应[9-12]。最近,英国伦敦大学癌症研究中心专门对带有组氨酸标签的小分子抗体在人体中的免疫原性问题进行了系统性研究。通过重复注射带有组氨酸标签的小分子抗体,并采用高灵敏度的荧光检测免疫原性反应,结果表明:尽管患者对小分子抗体的其他组分产生了强烈的免疫反应,但其组氨酸标签未表现出任何免疫原性[13]。该研究证明了含有组氨酸标签的小分子抗体是安全的,对人体是非免疫原性的。
4 含组氨酸标签小分子抗体的临床研究
小分子抗体正成为当今新药研发的趋势。至 2009 年已有 19 种小分子抗体进入临床研究,包括临床 III 期研究[14]。其中,大部分小分子抗体带有组氨酸标签。
带有组氨酸标签的抗癌胚抗原(CEA)小分子抗体-酶融合蛋白已经进入癌症治疗的临床 I 期、II 期试验。带有6 个组氨酸的单链抗体 CIGB-M3(center for genetic engineering and biotechnology M3)通过基因工程手段在大肠杆菌中可溶表达,能特异地和癌胚抗原 CEA 结合[15]。临床I 期结果表明,17 例结直肠癌患者接受131I 标记的CIGB-M3 注射后,没有出现严重的药物反应;并且注射后6 个月内,患者血清中没有检测到抗 CIGB-M3 的抗体[16]。125I 标记的 CEA 小分子抗体 MFE-23-his也正用于放射性免疫介导手术的临床 I 期试验。34 例结肠癌患者(17 例原发性肿瘤、16 例肝转移、1 例复发)以及 1 例肝转移的胰腺癌患者在手术前 24、48、72 或 96 h 分别接受125I 标记的 CEA 小分子抗体注射。结果显示125I 标记 CEA 抗体 MFE-23-his,在血液中清除快,具有良好的肿瘤定位能力,总体精确度达到 84%[17]。该产品已经成功应用于表达CEA 的乳腺肿瘤和骨髓瘤在人体内的显影[18]。另外,与上皮细胞生长因子(EpCAM)靶向结合的小分子抗体VB4-845 已完成膀胱癌治疗的临床 I 期试验,试验结果表明带有组氨酸标签的 VB4-845 是安全有效的[19]。使用VB4-845 与假单胞菌外毒素 A 融合而成的融合蛋白,对头颈部鳞状细胞癌患者每周进行瘤内注射的 I 期临床试验也表明 VB4-845 瘤内疗法是安全可行的[20],87.5%(临床I 期试验总共 20 例晚期或者复发性头颈部鳞状细胞癌)的EpCAM 阳性患者对 VB4-845 疗法具有疗效反应。
5 小结
组氨酸标签是一种多功能标签,正广泛应用于重组蛋白包括小分子抗体的亲和纯化、定性定量检测及同位素定点标记。临床试验表明组氨酸标签对人体是非免疫原性的。目前已有越来越多带有组氨酸标签的小分子抗体进入临床研究。
[1] Kaur S, Venktaraman G, Jain M, et al. Recent trends in antibody-based oncologic imaging. Cancer Lett, 2012, 315(2):97-111.
[2] Block H, Maertens B, Spriestersbach A, et al. Immobilized-metal affinity chromatography (IMAC): a review. Methods Enzymol, 2009,463:439-473.
[3] Cai W, Olafsen T, Zhang X, et al. PET imaging of colorectal cancer in xenograft-bearing mice by use of an 18F-labeled T84.66 anti-carcinoembryonic antigen diabody. J Nucl Med, 2007, 48(2):304-310.
[4] Tavaré R, Torres Martin De Rosales R, Blower PJ, et al. Efficient site-specific radiolabeling of a modified C2A domain of synaptotagmin I with [99mTC(CO)3]+: a new radiopharmaceutical for imaging cell death. Bioconjug Chem, 2009, 20(11):2071-2081.
[5] Waibel R, Alberto R, Willuda J, et al. Stable one-step technetium-99m labeling of His-tagged recombinant proteins with a novel Tc(I)-carbonyl complex. Nat Biotechnol, 1999, 17(9): 897-901.
[6] Badar A, DeFreitas S, McDonnell JM, et al. Recombinant complement receptor 2 radiolabeled with [99mTc(CO)3]+: A potential new radiopharmaceutical for imaging activated complement. PLoS One,2011, 6(4):e18275.
[7] Francis RJ, Mather SJ, Chester K, et al. Radiolabelling of glycosylated MFE-23::CPG2 fusion protein (MFECP1) with 99mTc for quantitation of tumour antibody-enzyme localisation in antibody-directed enzyme pro-drug therapy (ADEPT). Eur J Nucl Med Mol Imaging, 2004,31(8):1090-1096.
[8] Kennedy MC, Wang J, Zhang Y, et al. In vitro studies with recombinant Plasmodium falciparum apical membrane antigen 1(AMA1): production and activity of an AMA1 vaccine and generation of a multiallelic response. Infect Immun, 2002, 70(12):6948-6960.
[9] Dicko A, Diemert DJ, Sagara I, et al. Impact of a Plasmodium falciparum AMA1 vaccine on antibody responses in adult Malians.PLoS One, 2007, 2(10):e1045.
[10] Dicko A, Sagara I, Ellis RD, et al. Phase 1 study of a combination AMA1 blood stage malaria vaccine in Malian children. PLoS One,2008, 3(2):e1563.
[11] Mullen GE, Ellis RD, Miura K, et al. Phase 1 trial of AMA1-C1/Alhydrogel plus CPG 7909: an asexual blood-stage vaccine for Plasmodium falciparum malaria. PLoS One, 2008, 3(8):e2940.
[12] Sagara I, Dicko A, Ellis RD, et al. A randomized controlled phase 2 trial of the blood stage AMA1-C1/Alhydrogel malaria vaccine in children in Mali. Vaccine, 2009, 27(23): 3090-3098.
[13] Sharma S, Griffin N, Cleverleyl S, et al. Evidence that hexa histidine tags on therapeutic proteins are not immunogenic in patients.(2009-10-05)[2012-04-02]. http://www.ncri.org.uk/ncriconference/2009 abstracts/abstracts/C117.htm.
[14] Nelson AL, Reichert JM. Development trends for therapeutic antibody fragments. Nat Biotechnol, 2009, 27(4): 331-337.
[15] Perez L, Ayala M, Pimentel G, et al. A multivalent recombinant antibody fragment speci fi c for carcinoembryonic antigen. Biotechnol Appl Biochem, 2006, 43(Pt 1):39-48.
[16] González GP, García IG, González JG, et al. Phase I clinical trial of the(131)I-labeled anticarcinoembryonic antigen CIGB-M3 multivalent antibody fragment. Cancer Biother Radiopharm, 2011, 26(3):353-363.[17] Mayer A, Tsiompanou E, O'malley D, et al. Radioimmunoguided surgery in colorectal cancer using a genetically engineered anti-CEA single-chain Fv antibody. Clin Cancer Res, 2000, 6(5):1711-1719.
[18] Begent RH, Verhaar MJ, Chester KA, et al. Clinical evidence of efficient tumor targeting based on single-chain Fv antibody selected from a combinatorial library. Nat Med, 1996, 2(9):979-984.
[19] Kowalski M, Entuistle J, Cizeau J, et al. A Phase I study of an intravesically administered immunotoxin targeting EpCAM for the treatment of nonmuscle-invasive bladder cancer in BCGrefractory and BCG-intolerant patients. Drug Des Devel Ther, 2010, 4:313-320.
[20] MacDonald GC, Rasamoelisolo M, Entwistle J, et al. A phase I clinical study of VB4-845: weekly intratumoral administration of an anti-EpCAM recombinant fusion protein in patients with squamous cell carcinoma of the head and neck. Drug Des Devel Ther, 2009,2:105-114.

