动物源肠杆菌分离株质粒介导的喹诺酮类耐药基因的检测
张 悦,王 杨,张美君,刘雅红
(华南农业大学兽医学院 广东省兽药研制与安全评价重点实验室,广东 广州 510642)
随着喹诺酮类药物在兽医临床中的广泛应用,细菌对其产生耐药性的问题逐渐显现出来。最初,人们认为细菌对喹诺酮类的耐药性应该是由细菌染色体突变引起的,而不太可能存在耐药性的水平转移[1]。但近年的研究表明,质粒介导的喹诺酮类药物耐药性(PMQR)也是喹诺酮类耐药机制的重要组成部分,虽然质粒只能介导细菌对喹诺酮类的低水平耐药,但是这种耐药机制有助于细菌选择其他的耐药机制,从而导致高水平的耐药。它包括3种主要机制:qnr机制,乙酰基转移酶Aac(6′)-Ib-cr修饰喹诺酮类药物的耐药机制,以及对喹诺酮的主动外排机制。其中qnr机制为最早发现的PMQR机制,由于qnr基因可以编码一种五肽重复片段蛋白,而这种蛋白可以保护DNA促旋酶及拓扑异构酶IV不受喹诺酮类药物的作用,从而使细菌对喹诺酮类的敏感性下降[2],现已发现的qnr基因包括qnrA、qnrB、qnrS、qnrC和qnrD;氨基糖苷类乙酰转移酶基因aac(6′)-Ib的变异体Aac(6′)-Ib-Cr所编码的蛋白可以使含有未被取代的哌嗪基的喹诺酮类药物哌嗪基乙酰化,增强细菌对喹诺酮类的耐药性[3];而质粒介导的喹诺酮类外排泵也可以使革兰阴性菌对喹诺酮类的耐药性增强,目前发现的此类基因有qepA[4]和oqxAB[5]。
肠杆菌科细菌分布广,寄主范围大,可作为原发和继发病原引起多种动物疾病,本试验对广东地区数家养殖场中分离于猪、鸡、鸭的肠杆菌进行了PMQR 基 因qnrA、qnrB、qnrS、qnrC、qnrD、aac(6′)-Ib-cr及qepA 的检测,并进行兽医临床常用抗菌药物的敏感性试验,以期对广东地区近几年质粒介导喹诺酮耐药基因在动物体内的分布情况,以及养殖场肠杆菌耐药情况进行了解,为进一步研究动物源PMQR基因的传播机制、指导兽医临床合理应用抗菌药物奠定基础。
1 方法
1.1 菌株来源 2007~2009年在广东猪、禽养殖场分离的407株肠杆菌,经生化鉴定发现有350株大肠杆菌,26株变形杆菌,21株沙门菌及10株弗劳地枸橼酸杆菌。质控菌E.coli ATCC 25922为本实验室保存。
1.2 PMQR基因的检测 采用水煮法提取菌株DNA。引物序列见表1,引物由北京六合华大基因科技股份有限公司合成。PCR反应体系为50μL,反应参数为95℃预变性5min;95℃变性45s,退火参数为:qnrA48℃45s、qnrB52℃30s、qnrS52℃30s、qnrC 50℃30s、qnrD 50℃45s、qepA 59℃30s、aac(6′)-Ib-cr55℃45s,共30 个循环,最后72℃延伸10min。取适量扩增产物经1%~2%琼脂糖凝胶电泳后用凝胶成像系统拍照分析。疑似阳性产物送北京六合华大基因科技股份有限公司进行测序。测序结果在GenBank上进行序列比对以确定菌株是否为阳性。

表1 PMQR基因的PCR引物
1.3 药物敏感性试验 参照CLSI2007抗菌药物敏感性试验执行标准,采用琼脂稀释法测定407株肠杆菌对氨苄西林、头孢曲松、氯霉素、氟苯尼考、四环素、多西环素、萘啶酸、环丙沙星,氧氟沙星、左旋氧氟沙星、恩诺沙星、庆大霉素、卡那霉素、磺胺间甲氧嘧啶、磺胺二甲氧嘧啶进行药物的敏感性试验,质控菌采用大肠埃希氏菌ATCC25922。
2 结果
2.1 PMQR基因检测结果 407株肠杆菌中共有92(22.6%)株携带PMQR基因,其中qnrA、qnrB、qnrS、qnrD、qepA 及aac(6′)-Ib-cr 的 分 别检出4(0.98%)、20(4.91%)、66(16.22%)、7(1.72%)、1(0.25%)、22(5.41%)株,并有27(6.63%)株同时携带两种或两种以上PMQR基因。PMQR基因阳性株PCR目的片段电泳图谱见图1。
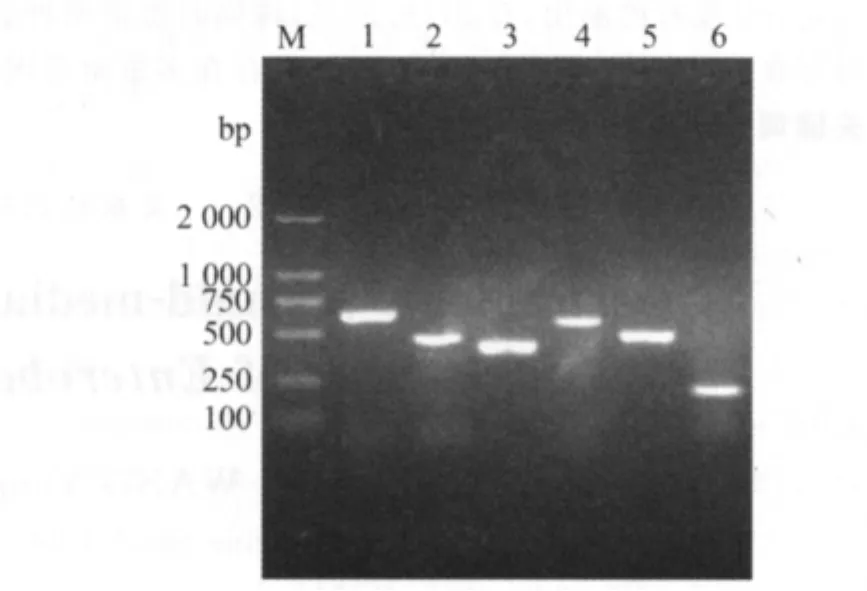
图1 PMQR基因PCR产物电泳图
2.2 药物敏感性测定结果 407株肠杆菌对15种药物耐药率在由高到低依次为磺胺间甲氧嘧啶、磺胺二甲氧嘧啶、四环素、氨苄西林、氟苯尼考、氯霉素、萘啶酸、卡那霉素、恩诺沙星、庆大霉素、多西环素、环丙沙星、氧氟沙星、左旋氧氟沙星、头孢曲松,且均表现出多重耐药(4~15耐),而出现最多的耐药表型为8耐、9耐、10耐和11耐(表2、表3)。
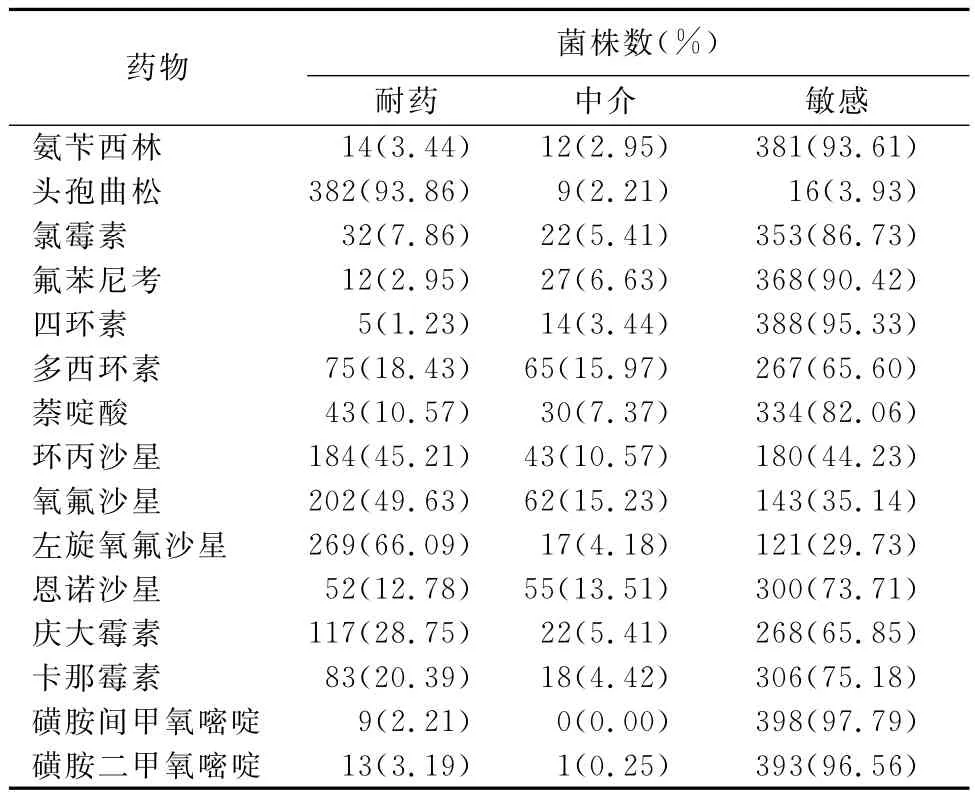
表2 407株动物源肠杆菌对15种抗菌药的药物敏感性试验结果
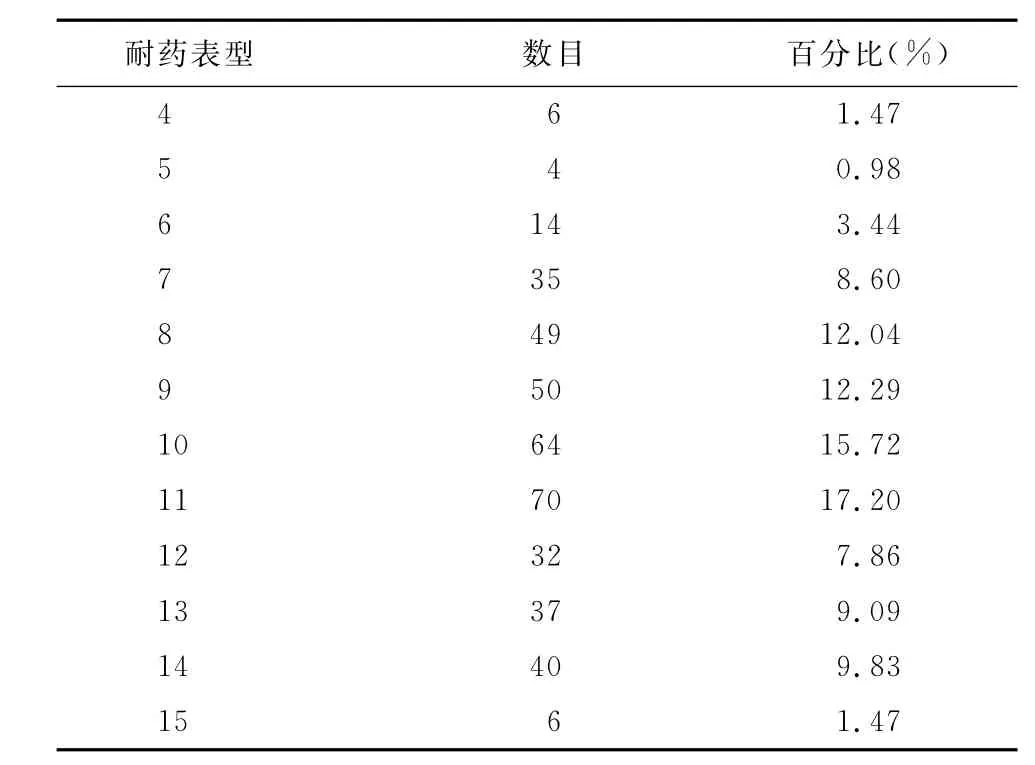
表3 407株鸡源肠杆菌对15种抗菌药物的多重耐药情况
3 讨论
407株动物源肠杆菌qnrA、qnrB、qnrS、qnrD、qepA和aac(6′)-Ib-cr的检出率分别在0.98%、4.91%、16.22%、1.72%、0.25%和5.41%,可以看出,PMQR基因在广东地区中存在流行,且以qnrS和aac(6′)-Ib-cr为主,与近几年国内动物源肠杆菌报道有异[10-11],这可能是由于菌株来源不同,以及地区性差异所导致的。Cavaco等人于2008年首次在河南省分离的人源沙门菌中发现qnrD基因,而本试验在2007年所分离的动物源肠杆菌中就检测到7株qnrD阳性菌,由此推测,该基因的出现时间可能更早;同时提示我们,自然界中可能存在其他未被发现的此类耐药基因。对于广东地区肠杆菌,Yue等对2003~2005年232株猪源及禽源大肠杆菌的qnrA、qnrB、qnrS及aac(6′)-Ib-cr基因进行检测,其中qnrB、qnrS及aac(6′)-Ib-cr分别检出1(0.43%)株,13(5.6%)株及2(0.86%)株,qnrA 没有检出[12]。与本试验相比可以看出,近几年广东地区的PMQR流行性明显增强,而且同时携带多个PMQR基因的菌株比例也显著增加。
在15种抗菌药物中,受试菌株只对头孢曲松的敏感率高,达到93.86%,而对于其他多数药物的耐药率在30%以上。超过50%的菌株多重耐药现象较为严重(8~11耐)。
本试验中动物源肠杆菌PMQR基因流行性,以及耐药率高、多重耐药的现象严重,可能是由于养殖场的不合理用药、耐药基因在不同种属细菌间的水平传播、细菌在动物和人之间的互相传递,以及交叉耐药导致的,这可能会给养殖业带来巨大的经济损失,耐药性的水平传播同时也会给人类的健康带来巨大的隐患。因此规范畜禽养殖用药,加强对耐药情况监测是兽医临床作业的重要任务。
[1]Courvalin P.Plasmid-mediated 4-quinolone resistance:a real or apparent absence?[J].Antimicrob Agents Chemother,1990,34(5):681-684.
[2]Tran J H,Jacoby G A.Mechanism of plasmid-mediated quinolone resistance[J].Proc Natl Acad Sci U S A,2002,99(8):5638-5642.
[3]Robicsek A,Strahilevitz J,Jacoby G A,et al.Fluoroquinolone-modifying enzyme:a new adaptation of a common aminoglycoside acetyltransferase[J].Nat Med,2006,12(1):83-88.
[4]Yamane K,Wachino J,Suzuki S,et al.New plasmid-mediated fluoroquinolone efflux pump,QepA,found in an Escherichia coli clinical isolate[J].Antimicrob Agents Chemother,2007,51(9):3354-3360.
[5]Kim H B,Wang M,Park C H,et al.oqxAB encoding a multidrug efflux pump in human clinical isolates of Enterobacteriaceae[J].Antimicrob Agents Chemother,2009,53(8):3582-3584.
[6]Wang M,Tran J H,Jacoby G A,et al.Plasmid-mediated quinolone resistance in clinical isolates of Escherichia coli from Shanghai,China[J].Antimicrob Agents Chemother,2003,47(7):2242-2248.
[7]Gay K,Robicsek A,Strahilevitz J,et al.Plasmid-mediated quinolone resistance in non-Typhi serotypes of Salmonella enterica[J].Clin Infect Dis,2006,43(3):297-304.
[8]Kim H B,Park C H,Kim C J,et al.Prevalence of plasmidmediated quinolone resistance determinants over a 9-year period,[J].Antimicrob Agents Chemother,2009,53(2):639-645.
[9]Park C H,Robicsek A,Jacoby G A,et al.Prevalence in the United States of aac(6′)-Ib-cr encoding a ciprofloxacin-modifying enzyme[J].Antimicrob Agents Chemother,2006,50(11):3953-3955.
[10]Wu C M,Wang Y,Cao X Y,et al.Emergence of plasmid-mediated quinolone resistance genes in Enterobacteriaceae isolated from chickens in China[J].J Antimicrob Chemother,2009,63(2):408-411.
[11]肖方,李新生,张素梅,等.质粒介导的喹诺酮类耐药基因在鸡源大肠杆菌中的流行[J].华北农学报,2010(01):222-225.
[12]Yue L,Jiang H X,Liao X P,et al.Prevalence of plasmid-mediated quinolone resistance qnr genes in poultry and swine clinical isolates of Escherichia coli[J].Vet Microbiol,2008,132(3-4):414-420.

