共表达禽流感HA和NA基因重组鸡痘病毒免疫犬的安全性和抗体应答
甘军纪,李贤舟,张胜文,孟 霞,彭大新,刘秀梵
(扬州大学兽医学院,江苏 扬州 225009)
犬常与野鸟、家禽以及动物肉产品紧密接触,增加了禽流感病毒适应并传播给人的可能性。犬自然感染高致病性禽流感(HPAIV)H5N1已有报道[1]。试验表明,高致病性禽流感(HPAIV)H5N1可以在犬中水平传播,犬饲喂感染H5N1AIV的禽肉或气管内接种可导致临床发病或死亡[2-3]。目前,还没有预防犬流感(H5)的疫苗获得注册[4]。
鸡痘病毒(FPV)具有严格的宿主特异性,虽然其不能在哺乳动物体内进行生产性复制,但携带外源基因的重组鸡痘病毒免疫哺乳动物可产生良好的对表达外源蛋白的免疫应答。近年来,各种不同的用于哺乳动物甚至人的重组禽痘病毒活疫苗试验广泛展开,已有用于预防马流感(H3N8)、马西尼罗病毒、猫狂犬病、犬瘟热、猫白血病重组禽痘病毒疫苗获得注册[5]。Karaca和Kyriakis等的研究表明,禽流感重组鸡痘疫苗(TROVACTM-AIV-H5,美国)在猫和猪上显示良好的免疫原性[6-7]。本研究用一个共表达H5N1亚型禽流感病毒HA和NA基因的重组鸡痘病毒(rFPV-11SH5ANA)免疫犬,评价其生物安全性和抗体应答。
1 材料与方法
1.1 试验犬与SPF种蛋 同窝非免疫家犬6只,实验室饲养至9周龄,经检测无禽流感(H5N1)、犬瘟热、犬细小病毒等抗体。SPF种蛋,购于北京维通利华实验动物技术有限公司,本实验室孵化至10日龄,用于繁殖禽流感病毒或制备鸡胚成纤维细胞(CEF)。
1.2 重组鸡痘病毒与禽流感病毒 共表达H5N1亚型禽流感病毒HA和NA基因的重组鸡痘病毒(rFPV-11SH5ANA),本实验室构建[8]。鸡痘病毒(FPV,282E4株),购自中国兽医药品监察所。禽流感病毒(H5N1)G株,本实验室鉴定和保存。取FPV、rFPV分别接种CEF,进行扩增培养,待80%以上细胞出现病变时收获,分装,于-70℃和37℃冻融3次后,进行空斑形成单位(PFU)计数[9]。取禽流感病毒(H5N1)G株种毒接种10日龄SPF鸡胚,收获24~48h死亡鸡胚尿囊液,小量分装,-70℃保存备用。
1.3 动物接种 试验犬分别编号为犬1~犬6(Dog1~Dog6),隔离饲养。Dog1、Dog2分别皮内接种106PFU 的rFPV-11SH5NA。Dog3、Dog4分别皮下接种106PFU的rFPV-11SH5NA。Dog5皮下接种106PFU的FPV,Dog6皮下注射磷酸盐缓冲液(PBS),作为空白对照。首次免疫4周后,相同途径、剂量进行第2次接种。
1.4 安全性试验 重组鸡痘病毒接种前1d和接种后1~7d,每天观察接种犬接种部位反应(肿胀、疼痛)、精神状态,监测体温(肛温);采集抗凝血进行全血细胞分类计数,检测指标按检测仪(MINDRAY迈瑞,BC-2800vet)设定的参考数据范围自动判定;采集血清进行肌酐(CREA),胰淀粉酶(AMYL),丙氨酸氨基转移酶(ALT),血糖(GLU)等指标测定,检测指标按检测仪(INDEX,vet Test8008)设定的参考数据范围自动判定。
1.5 血清学检测 试验犬接种重组鸡痘病毒前后采血分离血清,-20℃保存备用。AIV的血清抗体应答通过血凝抑制(HI)试验测定,按常规方法进行[10]。
2 结果
2.1 重组鸡痘病毒的安全性 试验犬皮内和皮下接种重组鸡痘病毒(rFPV-11SH5ANA)后,接种部位没有明显红肿等反应,精神状态正常。接种后1~7d体温均在正常值范围 (<39.5℃),rFPV第2次重复接种后,6d内体温也在正常值范围(<39.5℃),结果见图1。全血细胞分类计数结果显示,rFPV接种后1~7d,红细胞数、白细胞数、血小板数、淋巴细胞数均在正常范围内;rFPV接种后1~2d,白细胞数和淋巴细胞数出现轻微的下降,第3天起趋于正常(数据未列出)。接种(皮内、皮下)重组鸡痘病毒犬7d内部分血清生理生化指标平均值(CREA,AMYL,ALT,GLU)与FPV、PBS接种犬之间无明显差异,并且均在正常参考值范围之内,见图2。表明,共表达H5N1亚型禽流感病毒HA和NA基因的重组鸡痘病毒(rFPV-11SH5ANA)接种犬不引起局部和全身性反应,对器官没有损害作用,具有高度的安全性。
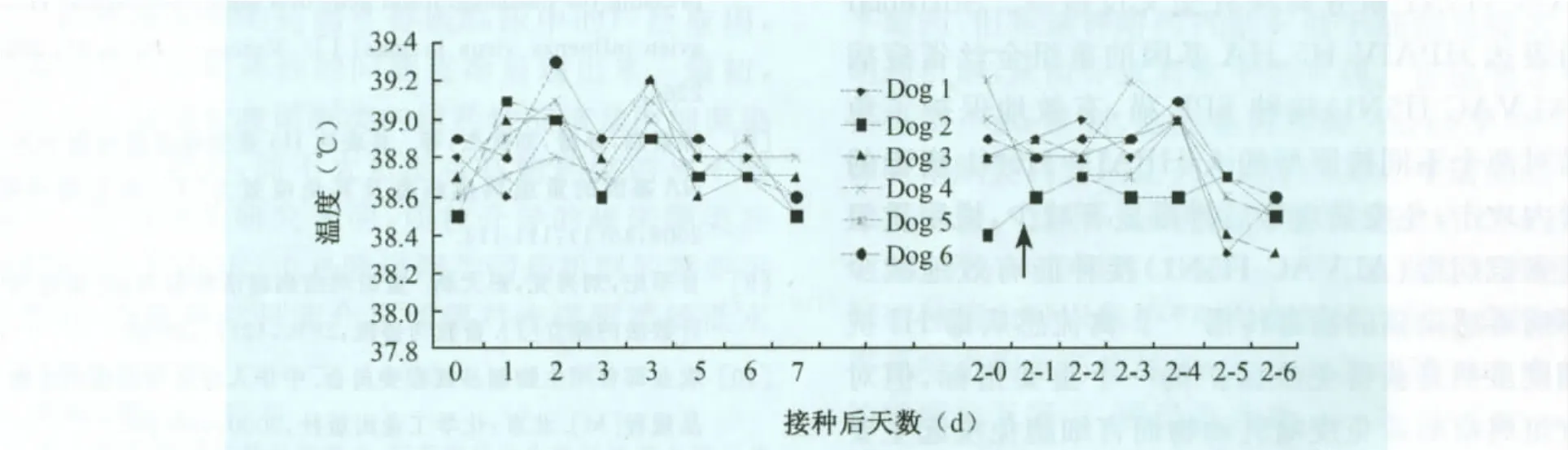
图1 试验犬接种重组鸡痘病毒(rFPV-11SH5ANA)后的体温变化。箭头示第2次接种
2.2 抗体应答 禽流感重组鸡痘病毒(rFPV-11SH5ANA)1次免疫犬(106PFU)1~4周血清的AIV HI抗体滴度均<2,rFPV-11SH5ANA 2次接种犬后1~10周,也未检测到明显的AIV HI抗体滴度增加。
图2 试验犬接种重组鸡痘病毒(rFPV-11SH5ANA)、FPV、PBS前后血清部分生化指标
3 讨论
在家禽上,目前已有表达高致病性禽流感、新城疫和传染性喉气管炎病毒抗原基因的重组鸡痘病毒活疫苗获得注册并投入商品应用。重组鸡痘病毒活疫苗研究中,对rFPV环境释放和对哺乳动物的安全性是疫苗生物安全评价的重要方面。过去的研究表明,禽痘病毒中插入外源基因并没有增强重组禽痘病毒对哺乳动物的毒力。rFPV和rCPV以不同的接种途径接种小鼠、兔、大鼠、豚鼠、猫、狗、马、牛和猪没有副反应[5]。几个已注册的用于犬、猫的禽痘载体疫苗包括用于猫的金丝雀痘病毒载体狂犬病疫苗、金丝雀痘载体猫白血病疫苗,用于犬的金丝雀痘载体犬瘟热疫苗,广泛的应用没有发现明显的副作用[6]。本研究结果进一步表明,禽流感重组鸡痘病毒(rFPV-11SH5ANA)具有良好的生物安全性。
为了预防伴侣动物高致病性禽流感病毒(HPAIV,H5)的感染,Karaca等用表达H5N8禽流感病毒的H5血凝素基因的重组鸡痘病毒(TROVAC AIV-H5)接种猫,产生抗同源H5N8抗原的高水平抗体。第2次接种后,产生的抗体显示与HPAIV H5N1新分离株有交叉反应[6]。Stittelaar等用表达HPAIV H5HA基因的重组金丝雀痘病毒(ALVAC H5N1)接种SPF猫,有效地保护了免疫猫对两个不同抗原型的人HPAIV H5N1病毒的气管内攻击;免疫猫攻毒后排毒显著减少,说明重组金丝雀痘病毒(ALVAC H5N1)接种能有效地减少流感病毒感染猫的病毒传播[11]。禽流感病毒HI抗体滴度虽然是获得免疫保护的一个重要指标,但对于重组鸡痘病毒免疫哺乳动物而言细胞免疫起主要作用,rFPV-11SH5ANA免疫家犬没有检测到有效的AIV HI抗体应答,并不能否定其免疫保护作用,考虑到生物安全因素,本研究未进行攻毒保护试验,因此,该重组鸡痘病毒免疫犬的保护效力尚有待进一步研究。
[1]Harder T C,Vahlenkamp T W.Influenza virus infections in dogs and cats[J].Vet Immunol Immunopathol,2010,134:54-60.
[2]Songserm T,Amonsin A,Jam-on R.Fatal avian Influenza A H5N1in a dog[J].Emerg Infect Dis,2006,12(11),1744-1747.
[3]Maas R,Tacken M,Ruuls L,et al.Avian Influenza(H5N1)susceptibility and receptors in dogs[J].Emerg Infect Dis,2007,13(8):1219-1221.
[4]甘军纪,刘秀梵.犬猫流感病毒感染与疫苗研究进展[J].中国兽医杂志,2011,47(2):45-47.
[5]Poulet H,Minke J,Pardo M C,et al.Development and registration of recombinant veterinary vaccines The example of the canarypox vector platform[J].Vaccine,2007,25:5606-5612.
[6]Karaca K,Swayne D E,Grosenbaugh D,et al.Immunogenicity of fowlpox virus expressing the avian influenza virus H5 gene(TROVAC AIV-H5)in cats[J].Clin Diagn Lab Immunol,2005,12:1340-1342.
[7]Kyriakis C S,Vleeschauwer A D,BarbéF,et al.Safety,immunogenicity and efficacy of poxvirus-based vector vaccines expressing the haemagglutinin gene of a highly pathogenic H5N1 avian influenza virus in pigs[J].Vaccine ,2009,27:2258-2264.
[8]陈素娟,孙蕾,刘武杰,等.共表达H5亚型禽流感病毒HA和NA基因的重组鸡痘病毒及其免疫效力[J].微生物学报,2006,46(1):111-114.
[9]甘军纪,刘秀梵,彭大新.重组鸡痘病毒活疫苗X-gal染色空斑计数法的建立[J].畜牧与兽医,2010,42(7):56-58.
[10]农业部兽用生物制品规程委员会.中华人民共和国兽用生物制品规程[M].北京:化学工业出版社,2000:440-442.
[11]Stittelaar K J,Lacombe V,van Lavieren R,et al.Cross-clade immunity in cats vaccinated with a canarypox-vectored avian influenza vaccine[J].Vaccine,2010,28:4970-4976.

