快速灵敏检测HCV核心抗原的免疫新方法及其性能分析
毛燕群
(重庆市涪陵监狱卫生所 408000)
丙型病毒性肝炎是由丙型肝炎病毒(hepatitis C virus,HCV)感染引起的传染病,中国HCV感染率约为3.2%,其中40%~60%的感染者可发展为慢性丙型肝炎,部分发展为肝硬化,严重威胁人们的健康[1-2]。HCV感染的早期诊断是预防和治疗丙型肝炎的有效途径。目前HCV检测技术主要为抗-HCV抗体检测和HCV RNA检测,但二者均存在一定的局限性。外周血中HCV核心抗原(HCV core antigen,HCcAg)是HCV颗粒的结构蛋白,在各亚型HCV中高度保守,是理想的HCV感染标志物[3],其检测对 HCV感染的诊断和治疗具有重要意义。本文针对现存HCcAg检测方法耗时、操作繁琐等不足,建立一种快速灵敏检测HCcAg含量的电化学免疫传感器方法,并对其检测性能进行分析,现报道如下。
1 材料和方法
1.1 主要试剂与设备 主要试剂:HCcAg和HCV核心抗体(HCV core antibody,HCcAb)购于美国Thermo公司;多壁碳纳米管(multi-wall carbon nanotubes,MWCNTs),纯度大于95%,购于成都有机化学研究所;牛血清清蛋白(bovine serum albumin,BSA)、壳聚糖(chitosan,CS)及氯金酸购自美国Sigma公司。实验所 用 缓 冲液 均 为 含 5mmol/L [Fe(CN)6]3-/4-和0.1mol/L KCl的 0.1mol/L 磷 酸 盐 缓 冲 溶 液 (phosphate buffered solution,PBS)(pH 7.0),实验用水为双蒸水。主要设备:CHI 660D电化学工作站、玻碳电极(工作电极)、铂丝(对电极)、Ag/AgCl电极(参比电极)、LIBROR AEL-200电子天平(日本岛津公司),BRANSON B3200S-T恒温超声仪(上海必能信超声公司)。
1.2 实验方法
1.2.1 胶体金的制备 采用柠檬酸钠还原法制备金溶胶[4],所得金溶胶为酒红色,用透射电子显微镜表征,平均直径约为16nm。
1.2.2 MWCNTs-CS(1.0g/L)的制备 方法参照文献[5],并在此基础上做了一些改变。配制质量分数为1.0%的醋酸溶液,用NaOH调节pH到5.0。取50mg壳聚糖置于10mL上述醋酸溶液中,在室温下搅拌一段时间制得5g/L的壳聚糖溶液。将5mg MWCNTs加入5mL 5g/L壳聚糖溶液中超声溶解。
1.2.3 HCcAg免疫传感器制作 玻碳电极经0.30、0.05μm铝粉抛光至镜面后,用水冲洗干净,分别于双蒸水、乙醇、双蒸水中超声清洗5min,晾干待用。将5μL的MWCNTs-CS滴涂于预处理的玻碳电极表面,室温晾干。在胶体金溶液中浸泡4h,取出后水洗,晾干,置于HCcAb溶液中于4℃过夜。最后在室温下将电极浸入2.5g/L的BSA溶液中1h,以封闭电极上的非特异性吸附位点制成HCcAg电化学免疫传感器,4℃下保存备用。
1.3 检测方法 将HCcAg标准品用双蒸水进行倍比稀释,配置成200.00、100.00、50.00、25.00、12.50、6.25ng/mL 6个浓度的标准溶液。在三电极体系下,将制备好的免疫传感器插入含5mmol/L[Fe(CN)6]3-/4-和0.1mol/L KCl的0.1mol/L PBS溶液(pH 7.0)中,记录免疫电极在稳态时的空白电流值I0。然后与不同浓度的HCcAg标准溶液于35℃反应20min后,再在工作溶液中进行变异系数(coefficient of variation,CV)测试,记录稳定后的电流值I1。根据不同浓度的HCcAg所对应的电流差值(ΔI)绘制标准曲线,其中ΔI=I0-I1。
1.4 性能评价采用回收试验和干扰试验对该免疫传感器检测的准确性和选择性进行分析,通过批内、批间试验评价传感器的精密度。(1)回收试验:用标准HCcAg溶液配置出浓度为100.00、50.00、20.00、10.00、5.00ng/mL的标准溶液,将制备好的HCcAg免疫传感器分别于5个不同浓度的溶液中孵育20min,根据测得的实际浓度与标准浓度的百分比计算回收率。(2)干扰试验:往浓度为50.00ng/mL的 HCcAg标准溶液中分别加入2倍浓度的干扰物质乙型肝炎病毒表面抗原(hepatitis B virus surface antigen,HBsAg)、乙型肝炎病毒e抗原(hepatitis B virus e antigen,HBeAg)、乙型肝炎病毒核心抗体 (hepatitis B virus core antigen,HBcAg),使 其 浓 度 为100.00ng/mL,加入干扰物前、后的电流值分别为Ia和Ib,按照公式计算相对标准偏差(relative standard deviation,RSD),RSD=(Ib-Ia)/Ia×100%。(3)批内试验与批间试验:将制备好的免疫传感器浸于100.00ng/mL HCcAg标准溶液孵育20min,相同条件下重复测定5次,计算批内试验CV值;一次制备5支HCcAg免疫传感器,分别于100.00ng/mL HCcAg标准溶液孵育20min,计算批间试验CV值。
2 结 果
HCcAg标准品用双蒸水进行倍比稀释后,分别采用免疫传感器对6个浓度的标准溶液进行测试,记录电流变化值ΔI,绘制标准曲线,见图1。结果表明,HCcAg浓度在2.50~300.00ng/ml范围内与ΔI成良好的线性关系,线性方程为:Y=0.159+0.128 X,线性相关系数R=0.997。将传感器在空白溶液中连续扫描10次,根据3倍空白标准差与斜率的比值得出其检出限为1.20ng/mL。回收试验结果见表1;干扰试验结果见表2;精密度检测提示批内试验CV值为4.5%,批间试验CV值为5.2%。

表1 回收试验

图1 HCcAg浓度与峰电流变化的线性关系
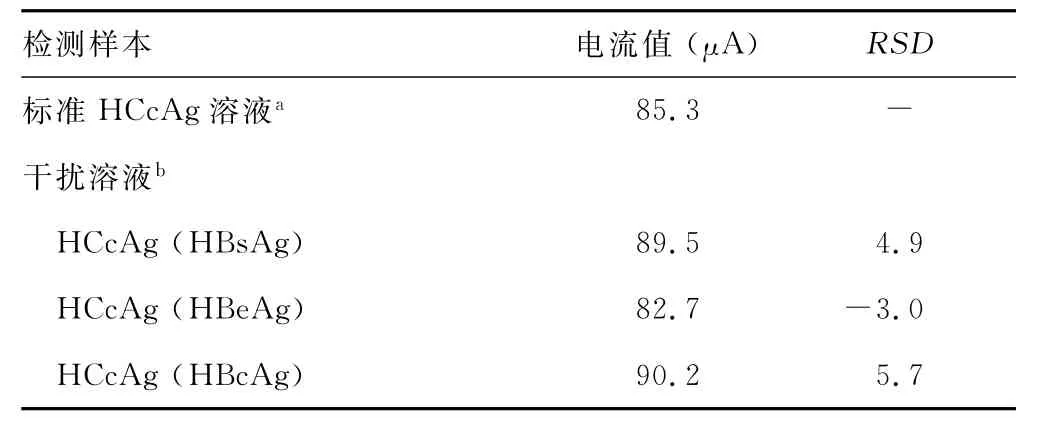
表2 干扰试验
3 讨 论
HCV为嗜肝性慢性病毒,HCV感染后,患者的起病和临床症状极不典型,以亚临床感染为多见,容易造成漏诊。HCV感染的慢性化发生率明显高于乙型肝炎病毒感染。与乙型肝炎比较,丙型肝炎更早出现肝硬化、肝癌,病死率也较高。因此HCV的检测对HCV感染的早期诊断和指导临床治疗有重要意义。目前用于HCV感染诊断的两项主要指标为抗-HCV和HCV RNA,但存在“窗口期”漏检的问题。作为抗-HCV检验的补充试验,HCcAg的检测对处于HCV感染“窗口期”的个体检测有很大价值。
目前,用于HCcAg检测的方法主要有荧光酶免疫分析法[6]和酶联免疫吸附法[7],这些检测方法虽然比较灵敏,但操作繁琐、费时。电化学免疫传感器是基于抗原抗体反应可进行特异性定量或半定量分析的集成器件,抗原(或抗体)是分子识别元件,且与电化学传感元件直接接触,通过传感元件把某种或者某类化学物质浓度信号转变为相应的电信号[8]。由于结合了免疫反应的特异性和电化学传感技术的高灵敏度,电化学免疫传感器具有选择性高、成本低和操作简便等优点,可广泛应用于疾病标志物的检测[9]。
本实验采用 MWCNTs-CS分散液修饰电极,一方面MWCNTs可以极大地促进电子传递,从而提高电流响应,增加检测灵敏度;另一方面,壳聚糖成膜性好,含有大量氨基,在为HCV核心抗体提供良好的生物相容性环境的同时,通过氨基吸附大量的金纳米粒子,增加抗体的负载量,从而也提高检测的灵敏度。由图1可知,该电化学免疫传感器对HCcAg的响应很好,表现出较宽的检测范围,HCcAg浓度在2.50~300.00ng/mL范围内与ΔI呈良好的线性关系,线性相关系数达到0.997。而且检出限较低,可以检测到1.20ng/mL的抗原浓度,说明该免疫传感器的灵敏度较高,可以用来检测HCcAg含量较低的溶液。
本实验对制备的HCcAg电化学免疫传感器的性能进行了评价。表1为回收试验结果,通过回收试验反映该方法检测的准确性。HCcAg免疫传感器分别在5个不同浓度的HCcAg标准溶液中孵育20min,根据测得的实际浓度与标准浓度的百分比计算出回收率,本研究的回收率为96.60%~105.75%,说明该免疫传感器检测的准确性较好。表2为干扰试验结果,可以用来说明该免疫传感器检测的选择性,将HBsAg、HBeAg、HBcAg作为干扰物质,分别加入到50.00ng/mL的HCcAg标准溶液中,使其浓度为100.00ng/mL,比较在有、无干扰物两种情况下,传感器的电流变化。由表2可知,加入2倍浓度的干扰物后,RSD为-3.0%~5.7%,表明该免疫传感器具有良好的选择性,可较特异地检测出HCcAg。
此外,作者还分析了该方法的精密度。将免疫传感器浸到100.00ng/mL HCcAg标准溶液中孵育后,在相同条件下重复测定5次,RSD为4.5%;将同批次制备的5支免疫传感器在相同条件下测定,RSD为5.2%,说明该传感器有良好的重现性。
综上所述,该电化学免疫传感器在检测HCcAg方面表现出较宽的线性范围和较低的检出限,而且具有良好的检测性能。该方法的建立可以为HCcAg的检测提供一种新的思路,有助于实现HCcAg的快速、灵敏检测,对丙型肝炎的早期检测具有一定的意义。
[1] 朱丰村,奚经巧.HCV检测技术的研究进展[J].实验与检验医学,2008,26(2):162-165.
[2] 朱忠政,丛文铭.乙型肝炎病毒和丙型肝炎病毒在肝癌发生中的作用研究进展[J].中华肝脏病杂志,2003,11(9):574-576.
[3] 卢业成,江振友,邝燕玲,等.游离丙型肝炎病毒核心抗原检测的临床价值探讨[J].细胞与分子免疫学杂志,2007,23(7):635-637.
[4] FRENS G.Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions[J].Nat Phys Sci,1973,241:20-22.
[5] Huang KJ,Niu DJ,Xie WZ,et al.A disposable electrochemical immunosensor for carcinoembryonic antigen based on nano-Au/multi-walled carbon nanotubes-chitosans nanocomposite film modified glassy carbon electrode[J].Anal Chim Acta,2010,659(1/2):102-108.
[6] Kashiwakuma T,Hasegawa A,Kajita T,et al.Detection of hepatitis C virus specific core protein in serum of patients by a sensitive fluorescence enzyme immunoassay(FEIA)[J].J ImmunolMethods,1996,190(1):79-89.
[7] 洪俊,饶永彩.HCV核心抗原测定用于丙型病毒性肝炎早期诊断临床价值的评估[J].临床检验杂志,2005,23(2):133-133.
[8] Zhang S,Zheng F,Wu Z,et al.Highly sensitive electrochemical detection of immunospecies based on combination of Fc label and PPD film/gold nanoparticle amplification[J].Biosens Bioelectron,2008,24(1):129-135.
[9] 刘蓓,逯岭松,刘成桂,等.基于 PoPD-MWCNTs-离子液体/纳米金的髓过氧化物酶免疫传感器[J].化学学报,2011,69(4):438-444.

