复方氢氯噻嗪片剂的质量控制
邓紫薇,卢 欣,李美珍,房志仲
(天津医科大学药学院药剂学教研室,天津市临床药物关键技术重点实验室,天津300070)
缬沙坦(valsartan)是一个非肽类口服有效的特异性血管紧张素…受体拮抗剂,对AT1受体亚型有高亲和力。临床应用时不影响高血压患者的总胆固醇、甘油三酯、血糖和尿酸水平[1],同时不影响心率。若突然终止其治疗,不引起高血压“反跳”或其他副作用[2]。氢氯噻嗪(hydrochlorothiazide)为噻嗪类利尿剂,属于中效利尿剂。它影响电解质在肾小管中的再吸收,导致钠和氯排泄增加,使得降低血浆量。氢氯噻嗪主要作用于远曲小管和集合管,通过阻断Na+-Cl-共转运体,阻碍NaCl的重吸收而产生利尿作用[3]。两药联用能降低药物毒性和副作用,维持稳定、持久的血药浓度,提高疗效,提高高血压患者的适应性。复方氢氯噻嗪片剂的研制可以使患者用药方便,减轻患者用药的成本,提高顺应性,以达到良好的治疗效果。为控制本品的质量,分别以缬沙坦和氢氯噻嗪为指标,采用HPLC法建立制剂的质量控制标准。
1 材料与方法
1.1 仪器 高效液相色谱仪(Spectra-Physics,美国),Spectra Focus紫外检测器,输液泵SP8810,色谱柱KromasilC18(Φ200mm×4.6mm,5μm),Anastar色谱工作站,紫外可见分光光度计(U3310 Spectrophotometer HitachiHigh-TechologiesCorporation),2DY-…-…IKVA型高精度单相交流稳压电源(国营启动电讯厂),KQ-100B型超声波清洗器(昆山市超声仪器有限公司),ALC-210.4型电子分析天平(北京赛多利斯系统仪器有限公司),80-2B型台式离心机(上海安亭科学仪器有限公司),微孔滤膜(Φ=13mm,孔径0.45μm,天津市双吉色谱仪器经营部)。
1.2 试药 缬沙坦原料药(浙江新赛科药业,批号:100401),氢氯噻嗪原料药(常州制药厂有限公司,批号:090604),缬沙坦对照品(中国药品生物制品检定所,批号:100651-200902),氢氯噻嗪对照品(中国药品生物制品检定所,批号:10309-0001),复方氢氯噻嗪片剂(自制),乙腈(天津市康科德科技有限公司,色谱纯),其它试剂均为市售分析纯,重蒸水(自制)。
1.3 方法
1.3.1 色谱条件的选择 色谱柱:Kromasil-C18柱,(Φ200mm×4.6mm,5μm);流动相:乙腈-水-冰醋酸(500∶500∶1);检测波长[4-5]:以流动相为空白,用紫外分光光度计在200~400 nm扫描,发现两种药物的检测波长接近,在230 nm左右均有最大吸收,因此选择230 nm为测定波长;流速:0.5mL/min;进样量:20μL;柱温:室温。
1.3.2 专属性试验 分别以甲醇作溶剂,配制复方氢氯噻嗪片剂的溶液,缬沙坦、氢氯噻嗪的原料药溶液及各种辅料的溶液。将所配溶液按照确定色谱条件进行测定,记录色谱图。
1.3.3 片剂含量测定方法[6-13]
1.3.3.1 对照品溶液的制备:精密称取缬沙坦标准品12.5mg,用流动相稀释定容至25mL量瓶中,浓度为500μg/mL,即为缬沙坦对照溶液。另精密称取氢氯噻嗪标准品12.5mg,用流动相稀释定容至10mL,浓度为125μg/mL,即为氢氯噻嗪对照溶液。
1.3.3.2 供试品溶液的制备:取20片样品研细后,精密称定260mg(相当于缬沙坦64mg),放入100mL棕色量瓶中,用流动相稀释,超声20min,静置至室温,用流动相稀释定容。取一定量的溶液,2 000 r/min离心5min后取上清液,用0.45μm微孔滤膜过滤。取续滤液0.5mL至10mL棕色量瓶中,用流动相稀释定容,即得缬沙坦供试品。另取20片样品研细后,精密称定260mg(相当于氢氯噻嗪5mg),样品处理过程与缬沙坦供试品相同,最终取续滤液2mL转移至10mL棕色量瓶中,用流动相稀释定容至刻度,即得氢氯噻嗪供试品。
1.3.3.3 检测限、定量限的测定:将缬沙坦、氢氯噻嗪对照品用流动相溶解配制成溶液,药物信号强度为S,噪音强度为N,记录S/N=3时对照品溶液的浓度为检测限,S/N=10时对照品溶液的浓度为定量限。
1.3.3.4 线性关系考察:按照“1.3.3.2”项下分别取缬沙坦供试品 0.2、0.3、0.4、0.5、0.6、0.7、0.8 mL,用流动相稀释定容至10mL,浓度分别为10、15、20、25、30、35、40 μg/mL,分别进样 20 μL,测定峰面积,对缬沙坦线性关系进行考察。另按照“1.3.3.2”项下分别取氢氯噻嗪 0.04、0.06、0.08、0.10、0.12、0.14、0.16mL用流动相稀释定容10mL,浓度分别为5、7.5、10、12.5、15、17.5、20 μg/mL,分别进样 20 μL,测定峰面积,对氢氯噻嗪线性关系进行考察。
1.3.3.5 精密度:按照“1.3.3.2项下方法处理片剂,所得溶液按照“1.3.1”项下色谱条件同一天内平行进样6次,计算RSD值,得到日内精密度。连续进样6 d,计算RSD值,得到日间精密度。
1.3.3.6 稳定性:按照“1.3.3.2”项下方法处理片剂,所得溶液分别于 0、3、6、9、12、24 和 48 h 进样,计算RSD值。
1.3.3.7 重现性:按照“1.3.3.2”项下方法处理片剂,缬沙坦的样品溶液浓度为32μg/mL,氢氯噻嗪的样品浓度为10μg/mL,溶液在确定色谱条件下重复进样6次,计算RSD值。
1.3.3.8 回收率:按照缬沙坦处方量加入辅料,加入一定量的流动相溶解后分别加入3.2mL、4.0mL、4.8 mL的 16.0 mg/mL的母液作为 80%、100%、120%的回收率试验的溶液。按照“1.3.3.2”项下处理缬沙坦供试品溶液方法进行提取,得到3种不同浓度的溶液。按照“1.3.1”项下色谱条件进样,测定峰面积(A),根据外标一点法,计算浓度,并将测得值与加入值比较,计算缬沙坦回收率。另按照氢氯噻嗪处方量加入辅料,加入一定量的流动相溶解,分别加入 4.0mL、5.0mL、6.0mL的 1.0mg/mL的母液作为80%、100%、120%的回收率试验的溶液。与缬沙坦回收率测定及计算方法相同,计算氢氯噻嗪回收率。
1.3.3.9 含量测定:分别按照“1.3.3.2”项下方法处理片剂,按照“1.3.1”项下色谱条件进样,测定峰面积(A),按照外标一点法,计算浓度,分别测定缬沙坦及氢氯噻嗪的含量。
2 结果
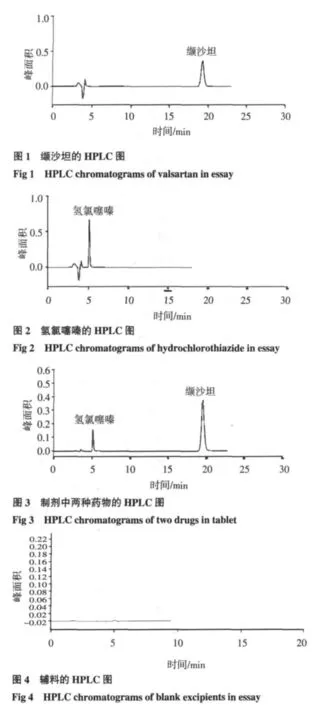
2.1 分离效果 按照HPLC测定法及相应浓度,绘制色谱图,见图1~4。由图可知,在该液相条件下缬沙坦、氢氯噻嗪分离度良好,且辅料对二者无干扰。
2.2 检测限、定量限 缬沙坦的检测限为0.38 ng,定量限为0.64 ng;氢氯噻嗪的检测限为0.20 ng,定量限为0.40 ng。
2.3 标准曲线 按“1.3.3.4”条件测定,以峰面积(A)对浓度(C)做线性回归的标准曲线,缬沙坦和氢氯噻嗪回归方程分别为:Y=31 028X+4 489.3(r=0.999 6,n=9)和 Y=40 626X+10 347(r=0.999 2,n=9)。结果表明,缬沙坦在10~40μg/mL的浓度范围内线性良好,氢氯噻嗪在5~20μg/mL的浓度范围内线性良好。
2.4 精密度 缬沙坦的日内精密度试验RSD值为0.59%,日间精密度试验RSD值为0.44%;氢氯噻嗪的日内精密度试验RSD值为0.33%,日间精密度试验RSD值为0.90%,结果表明,方法重现性良好,均小于2%,符合规定。
2.5 稳定性 缬沙坦稳定性试验RSD值为0.23%,氢氯噻嗪稳定性试验RSD值为0.39%,结果表明供试品溶液在48 h内基本稳定,均小于2%,符合规定。
2.6 重现性 缬沙坦重现性试验RSD值为0.55%,氢氯噻嗪重现性试验RSD值为1.74%,表明样品溶液中两种药物重现性良好,均小于2%,符合规定。
2.7 回收率 缬沙坦和氢氯噻嗪的回收率均在98.00%~102.00%之间,相对标准偏差均小于2%,符合规定,测定结果见表1~2。
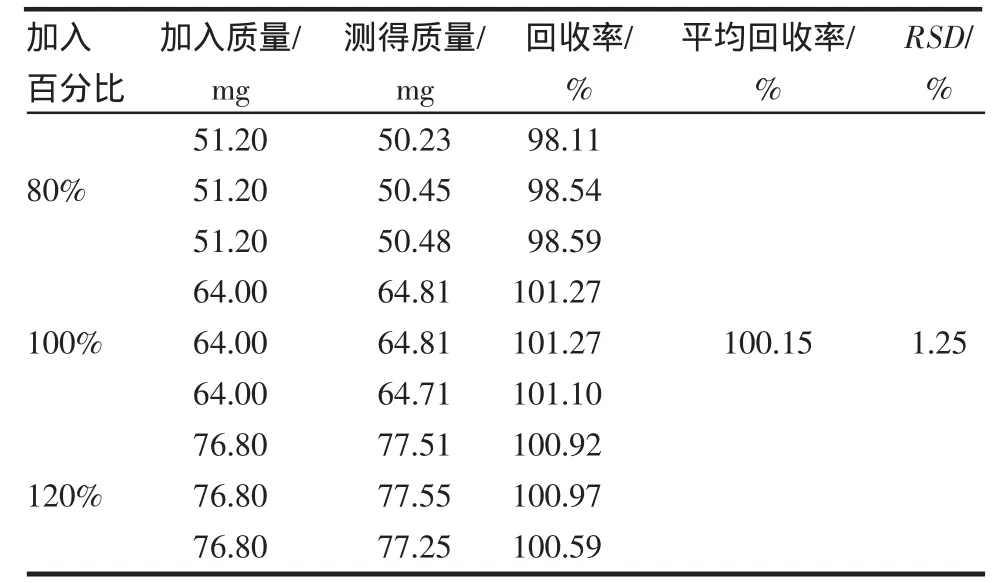
表1 缬沙坦回收率试验结果(n=9)Tab1 Resultsof recovery testof valsartan(n=9)
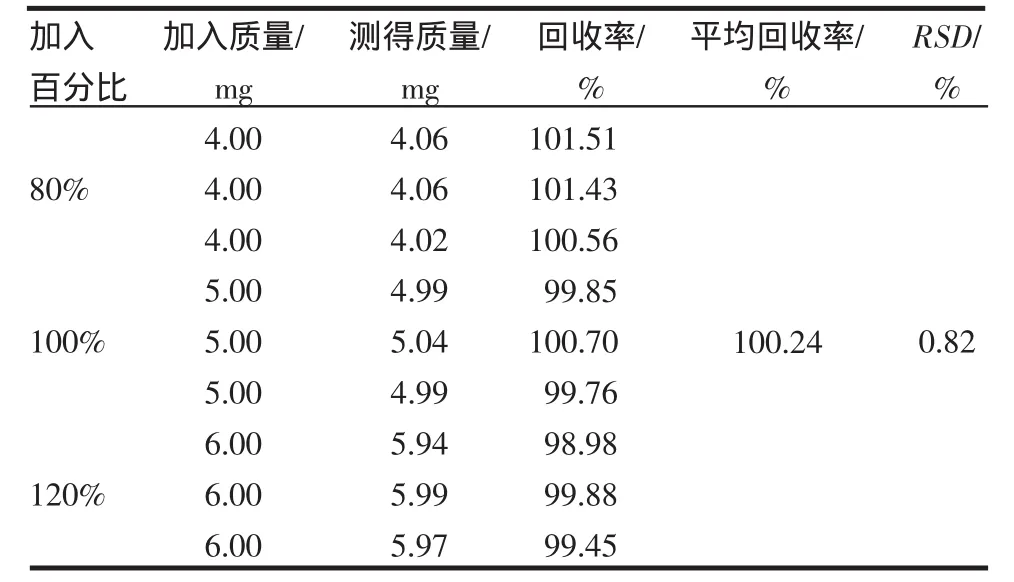
表2 氢氯噻嗪回收率试验(n=9)Tab2 Resultsof recovery testof hydrochlor othiazide(n=9)
2.8 含量测定 结果见表3。根据2010年版《中国药典》(二部)规定,缬沙坦含量应在90.00%~110.00%之间,氢氯噻嗪含量应在93.00%~107.00%之间,本试验测得复方氢氯噻嗪片剂中缬沙坦的平均含量为94.55%,氢氯噻嗪的平均含量为96.63%,相对标准偏差均小于2%,符合要求。
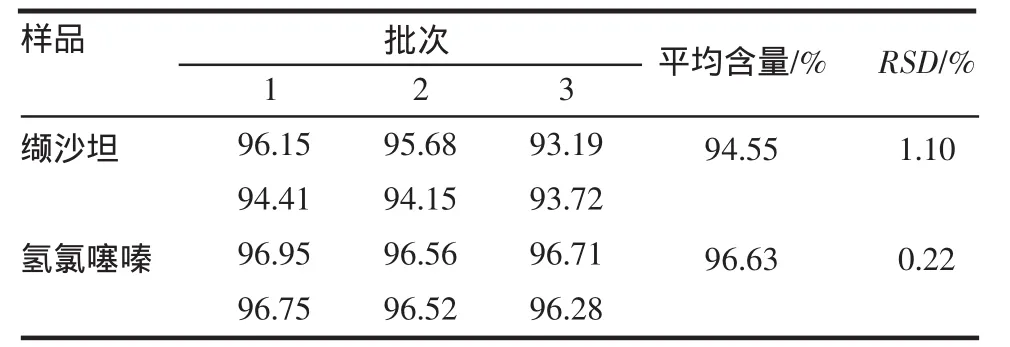
表3 缬沙坦、氢氯噻嗪含量测定结果(n=3)Tab3 Content determ ination ofvalsartan and hydrochlorothiazide
3 讨论
3.1 增大第1次的稀释倍数 试验过程中,分别称取样品于50mL和100mL量瓶中,加流动相稀释。结果表明:稀释至100mL量瓶中的样品缬沙坦提取较完全,含量明显高于稀释至50mL。
3.2 超声时间 试验过程中,分别选择超声5min、10min、20min,结果表明:超声20min的缬沙坦的含量高于其他两种方法,由此可见超声时间越长样品中缬沙坦提取越充分。
3.3 改变溶剂 选择乙腈、甲醇、乙腈∶甲醇=1∶1、乙腈∶水=1∶1、乙腈∶水=8∶2、丙酮、丙酮∶水=1∶1、流动相分别为提取溶剂。结果显示乙腈、甲醇、丙酮为提取溶剂时,对缬沙坦主峰有干扰,其他几种提取溶剂提取率无差异,为了试验的方便,因此选择流动相为提取溶剂。
3.4 色谱条件的选择 以乙腈-水-冰醋酸(500:500:1)为流动相可以作为分析氢氯噻嗪和缬沙坦的流动相,因两种药物的检测波长接近,选择λ=230nm。
本试验建立了高效液相色谱法测定复方氢氯噻嗪片剂中各主药的含量。结果显示本试验方法简便可行、重复性好,适用于复方氢氯噻嗪片剂的质量控制。
[1]Hawkins N M,Huang Z,Pieper K S,etal.Chronic obstructive pulmonary disease is an independent predictor of death but not atherosclerotic events in patients with myocardial infarction:analysis of the valsartan in acutemyocardial infarction trial(VALIANT)[J].Eur JHeart Failure,2009,11(3):292
[2]谢柏如,周国维.国产和进口缬沙坦治疗原发性高血压疗效比较[J].中国实用医药,2007,2(33):9
[3]许钟烨,丁峰.利尿剂临床应用的新进展[J].上海医药,2009,30(7):293
[4]国家药典委员会.中华人民共和国药典(二部)[S].2010版.北京:化学工业出版社,2010:555
[5]国家药典委员会.中华人民共和国药典(二部)[S].2010版.北京:化学工业出版社,2010:1136
[6]国家药典委员会.中华人民共和国药典(二部)[S].2010版.北京:化学工业出版社,2010:附录ⅩE:附录88
[7]吴娟娟,李玉琴.高效液相色谱法测定缬沙坦氢氯噻嗪分散片中两组份含量[J].现代医药卫生,2011,27(23):3532
[8]廖红娟,张涛.高效液相色谱法测定缬沙坦片的含量[J].中国药业,2010,19(9):36
[9]张芳.HPLC法同时测定复方利血平片中苯磺酸氨氯地平和缬沙坦含量[J].中国医院用药评价与分析,2011,11(8):721
[10]吴迪,郭伟英.HPLC法同时测定缬沙坦氢氯噻嗪胶囊中缬沙坦和氢氯噻嗪的含量[J].中国药房,2012,23(9):846
[11]杨卿.高效液相色谱法测定复方缬沙坦片中缬沙坦的含量[J].山西医科大学学报,2009,40(12):1093
[12]苏明武,史小四,李志浩,等.HPLC法测定复方氢氯噻嗪片中氢氯噻嗪的含量[J].中国药师,2006,9(5):436
[13]张冬,李宏斌,刘海宏.反相高效液相色谱法测定氢氯噻嗪片含量[J].中国药房,2004,15(8):497

