基于tufA基因的泡状饶氏藻系统发育分析
翟丽莎,冯 佳,谢树莲
(山西大学生命科学学院,山西 太原 030006)
泡状饶氏藻[Jaoa bullata(Jao)Fan]属绿藻门(Chlorophyta)绿藻纲(Chlorophyceae)。该种于1947年由饶钦止先生从贵州省湄潭县小河急流中的岩石上发现并命名为 Coelodiscus bullatus[1],隶属饶先生之前建立的空盘藻科(Coelodiscaceae)空盘藻属(Coelodiscus)[2-4]。泡状饶氏藻和饶氏藻[Jaoa prasina(Jao)Fan]是饶氏藻属仅有的2个种,为我国特有种(也有文献认为泡状饶氏藻只是饶氏藻的1个变种[5-7])。自该科属建立以来,有的将其归于丝藻 目 (Ulotrichales)[8],有 的 归 于 胶 毛 藻 目(Chaetophorales)[5,6],有的归于 Ctenocladales[7].也有根据形态特点,将其归于石莼目(Ulvales)[9,10]。可见,其系统位置一直是一个存在争议的问题。
tufA基因是叶绿体基因组中4个翻译因子基因的其中之一,编码翻译延长因子亚基,具有促进翻译的功能。tufA已被用于区别绿藻物种的系统发育分析[11]。Gary的研究表明,tufA基因具有高辨识力、普遍性及好的序列质量,且污染水平较低[12]。
以往对饶氏藻的研究多在形态解剖结构方面[9,13-14]。笔者通过试验测定了泡状饶氏藻的tufA基因序列,并与Genbank获得的绿藻门其它类群的基因序列构建系统树,分析它们之间的关系,以期为进一步研究饶氏藻的系统位置提供依据。
1 材料与方法
1.1 试验材料
供试材料为泡状饶氏藻,采自山西省平定县娘子关泉。样品采集后,用于形态观察的标本保存于4%的福尔马林溶液中;用于DNA分析的材料在解剖镜下挑除杂质,用硅胶粉干燥贮存;凭证标本保存于山西大学植物标本馆。
1.2 试验方法
1.2.1 总DNA的提取
取一定量的干燥藻体于液氮中研磨,然后转至1.5 mL离心管中,用SDS法提取基因组总DNA.
1.2.2 DNA 的电泳检测
将提取的DNA产物进行0.8% ~1.0%琼脂糖凝胶电泳检测,检定样品DNA的完整性。
1.2.3 PCR 扩增
查阅相关文献[15],确定引物。正向引物t36F:5'-GTTAAYATTGGAACWATTGG-3'和反向引物t1070R:5'-CCATCATCAGCWGTRAATTG-3'.
扩增反应在美国BIO-RAD公司生产的PCR仪上进行。反应体积为 25 μL,包括 1.0μL DNA 模板,2.5 μL引物 t36F,2.5 μL 引物 t1070R,2.0 μL 10 mmol/L dNTPs,2.5 μL 10 × buffer( 含 Mg2+),14.3 μL ddH2O 及 0.2 μL Trans TaqTDNA 聚合酶(北京全式金生物技术有限公司)。扩增程序为:95℃,10 min预变性。循环温度94℃,1 min;52℃,1 min;72℃,1 min;35个循环。最后72℃延伸5 min.得到的PCR产物经1.0%琼脂糖凝胶电泳分离,目的条带切割后参照DNA纯化试剂盒使用说明进行纯化回收。
1.2.4 序列测定
序列测定由北京奥科鼎盛生物技术有限责任公司完成。
1.2.5 获得相关序列
从GenBank中获得相关基因序列,登录号见表1.
1.2.6 软件分析
应用Clustal X2.0将所测序列与GenBank中所得序列进行比对[16],人工检查比对结果的正确性,并采用MEGA 4.0计算序列组成。构建系统树,其节点支持率使用1 000次自展(Bootstrap,BP)检验。利用MrBayes3.0,Phyml3.0 和 PAUP*4.0b10 软件分别重建系统发育树,采用贝叶斯法(Bayes)[17]、最大似然法(ML)和最大简约法(MP)3种建树方法。
2 结果与分析
2.1 序列分析
对tufA基因序列分析测得的片段长度为957 bp.tufA 碱 基 组 成 为 A34.6%,T30.1%,C15.0%,G20.3%.A+T 含量(64.7%)明显大于C+8G含量(35.3%),说明tufA基因在进化上具有碱基偏好性。

表1 试验所用基因序列GenBank登录号
2.2 系统树发育分析
以较为原始的团藻目中的Chlamydomonas reinhardtii和Volvox carteri为外类群,用贝叶斯法、最大似然法和最大简约法分别计算得到Bayes树,ML树和MP树,如图1,图2,图3.图中节点处数字代表1 000次重复(Botstrap,BP)分析得到的支持率(%)。
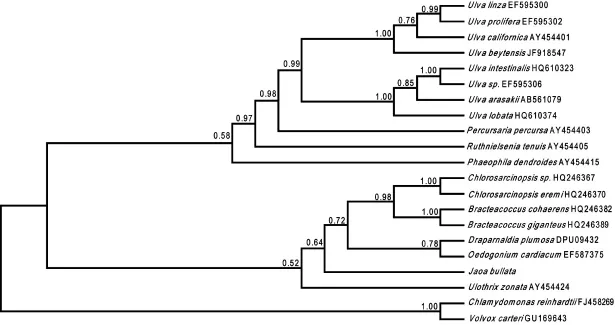
图1 基于tufA基因的Bayes树
比较图1和图2可知,Bayes树和ML树的拓扑结构基本一致。可以看出,泡状饶氏藻与丝藻目的Ulothrix zonata亲缘关系较近,但两种方法构建的系统树自展支持率较低,分别为52%和47%.另外,从系统树位置上看,泡状饶氏藻与鞘藻目(Oedogonia-les)的Oedogonium cardiacum和胶毛藻目的Draparnaldia plumosa也比较接近,而与石莼目的种类关系较远。MP树(图3)显示的结果与前两者略有不同,泡状饶氏藻单独称为一支,但仍与鞘藻目、胶毛藻目的种类较为接近。
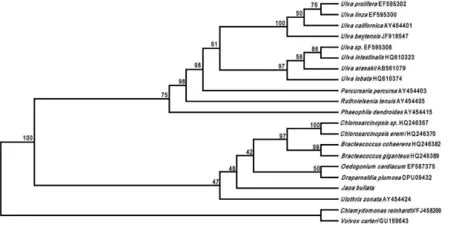
图2 基于tufA基因的ML树
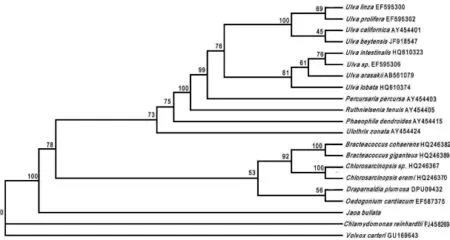
图3 基于tufA基因的MP树
3 结论与讨论
对于饶氏藻科分类系统的研究,以往都是从形态和解剖方面分析探讨的。Papenfuss和石登红等根据饶氏藻科植物体不具分枝及植物体呈假薄壁组织状的形态特征,认为与丝藻目植物不具分枝的丝状体或膜状体相似[8-14],但二者在藻体大小及复杂程度上相差甚远。Printz主张将饶氏藻科列入胶毛藻目[6],虽然该目植物体结构较复杂,但其具有异丝体性分枝的特征似也与饶氏藻科有很大的不同。Silva则认为饶氏藻科尚未获得广泛承认,应将其放在一个分类很不稳定的Ctenocladales中[7]。王模善等从饶氏藻科的藻体形态和超微结构入手,认为将其归于石莼目更合适[9],但笔者的试验结果却不支持这个观点。笔者对泡状饶氏藻的tufA基因进行分析,显示其与丝藻目、鞘藻目和胶毛藻目有一定关系,但未获得较高的支持率。鉴于目前tufA基因用于藻类系统发育的研究报道较少,涉及到的种类较有限,有必要进行更多的基因序列分析,并将传统方法和现代分子生物学方法科学地结合起来,才可能对饶氏藻科的分类地位得到更全面、客观的结论。本试验结果也为tufA基因用于藻类植物系统发育研究的可行性提供了证据。
[1]Jao C C.Coelodiscus bullatus,sp.nov,a second species of the Coelodiscacea[J].Botanical Bulletin Academia Sinica,1947(1):255-256.
[2]Jao C C.Studies on the freshwater algae of China.IX.Coelodiscaceae,a new family of the Chlorophyceae[J].Sinensia,1941(12):291-298.
[3]Baillon M H.Etudes generals du groupe des Euphorbiacées[M].Paris:Librairie de Victor Masson,1858.
[4]樊恭矩.绿藻纲的一个新科名和新属名[J].植物分类学报,1964,9(1):101.
[5]黎尚豪,毕列爵.中国淡水藻志[M].北京:科学出版社,1998.
[6]Printz H.Die Chaetophoralen der Binnengewässer.Eine systematische Übersicht[J].Hydrobiologia,1964,24(1):1-376.
[7]Silva P C.Chlorophycota.In:Parker S P,ed.Synopsis and classification of living organism [C].New York:SP,McGraw-Hill,1982.133-161.
[8]Papenfuss G F.Classification of the algae.In:A century progress in the natural sciences 1 853-1 953[C].San Francisco:California Academy of Sciences,1955,155-244.
[9]王模善,宿文瞳,王晓明.泡状饶氏藻营养细胞的超微结构研究[J].植物学报,1988,30(2):129-133.
[10]胡鸿钧,魏印心.中国淡水藻类——系统、分类及生态[M].北京:科学出版社,2006.
[11]何培民,张荣铣.藻类叶绿体DNA和基因图谱[J].上海水产大学学报,2000,9(1):51-58.
[12]Gary W,Kucera H.An evaluation of rbcL,tufA,UPA,LSU and ITS as DNA barcode markers for the marine green macroalgae[J].Cryptogamie,Algologie,2010,31(4):487-528.
[13]李红丽,胡鸿钧.饶氏藻显微结构及泡状饶氏藻超微结构研究[J].武汉植物学研究,2003,21(6):481-486.
[14]石登红,陈 椽,陈 训.饶氏藻属(Jaoa)的形态学初步研究[J].贵州科学,2004,22(3):89-91.
[15]Yoon H S,Hackett J D,Pinto G,et al.The single,ancient origin of chromist plastids[J].PNAS,2002,99:15 507-15 512.
[16]Thompson J D,Gibson T J,Plewniak F,et al.The Clustal X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Journal of Nucleic Acid Research,1997,25(24):4 876-4 882.
[17]Ronquist F,Huelsenbeck J P.MrBayes 3:Bayesian phylogenetic inference under mixed models[J].Journal of Bioinformatics,2003,19(12):1 572-1 574.

